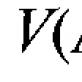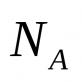Energia internă a unui gaz ideal. Gradele de libertate ale moleculelor. Legea distribuirii uniforme a energiei pe grade de libertate. Numărul de grade de libertate ale unei molecule. Legea distribuției uniforme a energiei pe grade de libertate Numărul de grade de libertate ale moleculei de azot
Ecuația de stare a unui sistem termodinamic. Ecuația Clapeyron-Mendeleev. Termometru pentru gaz ideal. Ecuația de bază a teoriei molecular-cinetice. Distribuția uniformă a energiei pe gradele de libertate ale moleculelor. Energia internă a unui gaz ideal. Diametrul efectiv și calea liberă medie a moleculelor de gaz. Confirmarea experimentală a teoriei molecular-cinetice.
Ecuația de stare a unui sistem termodinamic descrie relația dintre parametrii sistemului . Parametrii de stare sunt presiunea, volumul, temperatura, cantitatea de substanță. În general, ecuația de stare este o dependență funcțională F (p, V, T) = 0.
Pentru majoritatea gazelor, după cum arată experiența, la temperatura camerei și o presiune de aproximativ 10 5 Pa, Ecuația Mendeleev-Clapeyron :
p- presiune (Pa), V- volumul ocupat (m 3), R\u003d 8,31 J / molK - constanta universală a gazului, T - temperatură (K).
mol de substanță
- cantitatea de substanță care conține un număr de atomi sau molecule egal cu numărul lui Avogadro  (atâția atomi sunt conținute în 12 g izotop de carbon 12 C). Lăsa m 0 este masa unei molecule (atom), N este numărul de molecule, atunci
(atâția atomi sunt conținute în 12 g izotop de carbon 12 C). Lăsa m 0 este masa unei molecule (atom), N este numărul de molecule, atunci  - masa gazului,
- masa gazului,  este masa molară a substanței. Prin urmare, numărul de moli ai unei substanțe este:
este masa molară a substanței. Prin urmare, numărul de moli ai unei substanțe este:
 .
.
Un gaz ai cărui parametri satisfac ecuația Clapeyron-Mendeleev este un gaz ideal. Hidrogenul și heliul sunt cele mai apropiate ca proprietăți de ideal.
Termometru pentru gaz ideal.
Un termometru cu gaz de volum constant constă dintr-un corp termometric - o porțiune dintr-un gaz ideal închis într-un vas, care este conectat la un manometru prin intermediul unui tub.
Cu ajutorul unui termometru cu gaz, se poate stabili experimental o relație între temperatura unui gaz și presiunea unui gaz la un anumit volum fix. Constanța volumului se realizează prin faptul că, prin mișcarea verticală a tubului din stânga al manometrului, nivelul din tubul său drept este adus la marcajul de referință și diferența de înălțime a nivelurilor de lichid din manometru este măsurat. Luarea în considerare a diferitelor corecții (de exemplu, dilatarea termică a părților de sticlă ale unui termometru, adsorbția de gaz etc.) face posibilă obținerea unei precizii a măsurării temperaturii cu un termometru de gaz cu volum constant egal cu 0,001 K.
Termometrele cu gaz au avantajul că temperatura determinată cu ajutorul lor la densități scăzute gazul nu depinde de natura sa, iar scara unui astfel de termometru coincide bine cu scala de temperatură absolută determinată cu ajutorul unui termometru cu gaz ideal.
În acest fel, o anumită temperatură este legată de temperatura în grade Celsius prin relația:  LA.
LA.
Condiții normale de gaz - o stare în care presiunea este egală cu cea atmosferică normală: R\u003d 101325 Pa10 5 Pa și temperatura T \u003d 273,15 K.
Din ecuația Mendeleev-Clapeyron rezultă că volumul unui mol de gaz în condiții normale este egal cu:  m 3.
m 3.
Fundamentele TIC
Teoria cinetică moleculară (MKT) ia în considerare proprietățile termodinamice ale gazelor din punctul de vedere al structurii lor moleculare.
Moleculele se află într-o mișcare termică aleatorie constantă, ciocnând constant unele cu altele. Procedând astfel, ei fac schimb de impuls și energie.
Presiunea gazului.
Luați în considerare un model mecanic al unui gaz în echilibru termodinamic cu pereții vasului. Moleculele se ciocnesc elastic nu numai între ele, ci și cu pereții vasului în care se află gazul.
Ca idealizare a modelului, înlocuim atomii din molecule cu puncte materiale. Se presupune că viteza tuturor moleculelor este aceeași. De asemenea, presupunem că punctele materiale nu interacționează între ele la distanță, astfel încât energia potențială a unei astfel de interacțiuni se presupune a fi zero.
P  gură
gură
 este concentrația moleculelor de gaz, T este temperatura gazului, u este viteza medie a mișcării de translație a moleculelor. Alegem un sistem de coordonate astfel încât peretele vasului să se afle în planul XY, iar axa Z să fie direcționată perpendicular pe peretele din interiorul vasului.
este concentrația moleculelor de gaz, T este temperatura gazului, u este viteza medie a mișcării de translație a moleculelor. Alegem un sistem de coordonate astfel încât peretele vasului să se afle în planul XY, iar axa Z să fie direcționată perpendicular pe peretele din interiorul vasului.
Luați în considerare impactul moleculelor asupra pereților unui vas. pentru că Deoarece impacturile sunt elastice, după lovirea peretelui, impulsul moleculei își schimbă direcția, dar amploarea acesteia nu se schimbă.
Pentru o perioadă de timp t numai acele molecule care se află la o distanță de perete la o distanță de cel mult L= ut. Numărul total de molecule dintr-un cilindru cu o suprafață de bază S si inaltime L, al cărui volum este V = LS = utS, egală N = nV = nutS.
Într-un anumit punct din spațiu, trei direcții diferite de mișcare moleculară pot fi distinse în mod convențional, de exemplu, de-a lungul axelor X, Y, Z. O moleculă se poate deplasa de-a lungul fiecărei direcții „înainte” și „înapoi”.
Prin urmare, nu toate moleculele din volumul selectat se vor deplasa spre perete, ci doar o șaseme din numărul lor total. Prin urmare, numărul de molecule care în timpul t loviți de perete, va fi egal cu:
N 1 = N/6= nutS/6.
Modificarea impulsului moleculelor la impact este egală cu impulsurile forței care acționează asupra moleculelor din partea laterală a peretelui - cu aceeași forță, moleculele acționează asupra peretelui:
P Z = P 2 Z – P 1 Z = Ft, sau
N 1 m 0 tu-( N 1 m 0 u)= Ft,
2N 1 m 0 u=Ft,
 ,
,
 .
.
Unde găsim presiunea gazului pe perete:  ,
,
Unde  - energia cinetică a unui punct material (mișcarea de translație a unei molecule). Prin urmare, presiunea unui astfel de gaz (mecanic) este proporțională cu energia cinetică a mișcării de translație a moleculelor:
- energia cinetică a unui punct material (mișcarea de translație a unei molecule). Prin urmare, presiunea unui astfel de gaz (mecanic) este proporțională cu energia cinetică a mișcării de translație a moleculelor:
 .
.
Această ecuație se numește ecuația de bază a MKT .
Legea distribuției uniforme a energiei pe grade de libertate .
FUNDAMENTELE FIZICE ALE TERMODINAMICII
1. Prima lege a termodinamicii
§unu. Energie interna
Orice sistem termodinamic în orice stare are o energie numită energie totală. Energia totală a sistemului este suma energiei cinetice a mișcării sistemului ca întreg, a energiei potențiale a sistemului ca întreg și a energiei interne.
 Energia internă a sistemului este suma tuturor tipurilor de mișcare haotică (termică) a moleculelor: energia potențială din mișcările intra-atomice și intra-nucleare. Energia internă este o funcție de starea gazului. Pentru o stare dată a gazului, energia internă este determinată în mod unic, adică este o funcție definită.
Energia internă a sistemului este suma tuturor tipurilor de mișcare haotică (termică) a moleculelor: energia potențială din mișcările intra-atomice și intra-nucleare. Energia internă este o funcție de starea gazului. Pentru o stare dată a gazului, energia internă este determinată în mod unic, adică este o funcție definită.
În timpul trecerii de la o stare la alta, energia internă a sistemului se modifică. Dar, în același timp, energia internă în noua stare nu depinde de procesul prin care sistemul a trecut în această stare.
§2. Caldura si munca
Există două moduri diferite de a modifica energia internă a unui sistem termodinamic. Energia internă a unui sistem se poate modifica ca urmare a lucrului și ca urmare a transferului de căldură către sistem. Munca este o măsură a modificării energiei mecanice a unui sistem. La efectuarea lucrărilor, există o mișcare a sistemului sau a părților macroscopice individuale una față de alta. De exemplu, prin mutarea unui piston într-un cilindru care conține gaz, comprimăm gazul, în urma căruia temperatura acestuia crește, adică. energia internă a gazului se modifică.
Energia internă se poate modifica și ca urmare a transferului de căldură, de exemplu. oferind o oarecare căldură gazuluiQ.
Diferența dintre căldură și muncă este că căldura este transferată ca urmare a unui număr de procese microscopice în care energia cinetică a moleculelor unui corp mai fierbinte în timpul ciocnirilor este transferată către moleculele unui corp mai puțin încălzit.
Ceea ce este comun între căldură și muncă este că acestea sunt funcții ale procesului, adică putem vorbi despre cantitatea de căldură și lucru atunci când sistemul trece de la starea primei la starea celui de-al doilea. Căldura și robotul nu sunt o funcție de stare, spre deosebire de energia internă. Este imposibil de spus cu ce este egală lucrul și căldura gazului în starea 1, dar se poate vorbi despre energia internă în starea 1.
§3euînceputul termodinamicii
Să presupunem că un anumit sistem (un gaz închis într-un cilindru sub un piston), având energie internă, a primit o anumită cantitate de căldurăQ, trecând într-o stare nouă, caracterizată de energie internăU 2
,
a facut treaba A asupra mediului extern, adică împotriva forțelor externe. Cantitatea de căldură este considerată pozitivă atunci când este furnizată sistemului și negativă atunci când este preluată din sistem. Munca este pozitivă atunci când este efectuată de gaz împotriva forțelor externe și negativă atunci când este efectuată pe gaz.
euînceputul termodinamicii : Cantitatea de căldură (Δ Q ), sistemul comunicat merge să crească energia internă a sistemului și să efectueze lucru (A) de către sistem împotriva forțelor externe.
Înregistrare euînceputul termodinamicii în formă diferenţială
dU- o modificare infinitezimală a energiei interne a sistemului
munca elementara,- o cantitate infinitezimală de căldură.
Dacă sistemul revine periodic la starea inițială, atunci modificarea energiei sale interne este zero. Atunci
adică mașină cu mișcare perpetuăeuamabil, un motor care funcționează periodic și care ar lucra mai mult decât energia care i-a fost comunicată din exterior este imposibil (una dintre formulările loreuînceputul termodinamicii).
§2 Numărul de grade de libertate ale unei molecule. lege uniformă
distribuția energiei pe gradele de libertate ale moleculei
Numărul de grade de libertate: un sistem mecanic se numeste numarul de marimi independente, cu ajutorul carora se poate stabili pozitia sistemului. Un gaz monoatomic are trei grade de libertate de translației = 3, deoarece trei coordonate (x, y, z).
Conexiune hardO legătură se numește legătură în care distanța dintre atomi nu se modifică. Molecule diatomice cu o legătură rigidă (N 2 , O 2 , H 2) au 3 grade de libertate de translație și 2 grade de libertate de rotație:i= irapid + ivr=3 + 2=5.
Grade de libertate translaționale asociat cu mișcarea moleculei ca întreg în spațiu, rotațional - cu rotația moleculei ca întreg. Rotația axelor de coordonate relativeXși z in colt va duce la o modificare a poziției moleculelor în spațiu, în timpul rotației în jurul axei la molecula nu își schimbă poziția, deci coordonatele φ ynu este necesar în acest caz. O moleculă triatomică cu o legătură rigidă are 6 grade de libertate.
i= irapid + ivr=3 + 3=6
Dacă legătura dintre atomi nu este rigidă, atunci vibrațională Cu grade de libertate. Pentru o moleculă neliniarăEu contez . = 3 N - 6 , Unde Neste numărul de atomi dintr-o moleculă.
Indiferent de numărul total de grade de libertate ale moleculelor, cele 3 grade de libertate sunt întotdeauna translaționale. Niciuna dintre puterile de translație nu are un avantaj față de celelalte, deci fiecare dintre ele are aceeași energie în medie, egală cu 1/3 din valoare.
![]()
Boltzmann a stabilit legea conform căreia pentru un sistem statistic (adică, pentru un sistem în care numărul de molecule este mare), care se află într-o stare de echilibru termodinamic, pentru fiecare grad de libertate de translație și rotație, există o cinematică medie. energie egală cu 1/2 kT , iar pentru fiecare grad de libertate vibrațional - în medie, energia egală cu kT . Gradul de libertate vibrațional „deține” de două ori mai multă energie, deoarece ține cont nu numai de energia cinetică (ca în cazul mișcării de translație și rotație), ci și de energia potențială șideci energia medie a unei molecule
O caracteristică importantă a unui sistem termodinamic este sa energie internă U este energia de mișcare termică a microparticulelor din sistem (molecule, atomi, electroni, nuclee etc.) și energia de interacțiune a acestor particule.
Energie interna - funcţie cu o singură valoare starea termodinamică a sistemului, adică în fiecare stare, sistemul are o energie internă bine definită (nu depinde de modul în care sistemul a ajuns în această stare). Aceasta înseamnă că în timpul tranziției sistemului de la o stare la alta, schimbarea energiei interne este determinată numai de diferența dintre valorile energiei interne a acestor stări și nu depinde de calea de tranziție.
Introducem conceptul numărul de grade de libertate i: acesta este numărul de variabile independente (coordonate) care determină complet poziția sistemului în spațiu. Într-o serie de probleme, o moleculă de gaz monoatomic este considerată un punct material, căruia îi sunt atribuite trei grade de libertate de mișcare de translație ( i=3). În acest caz, energia mișcării de rotație poate fi ignorată.
În mecanica clasică, o moleculă de gaz diatomic, în prima aproximare, este considerată ca un set de două puncte materiale legate rigid printr-o legătură nedeformabilă. . Acest sistem, pe lângă trei grade de libertate de mișcare de translație, mai are două grade de libertate. mișcare de rotație. Rotația în jurul celei de-a treia axe (axa care trece prin ambii atomi) este lipsită de sens. Astfel, un gaz biatomic are cinci grade de libertate ( i=5). Moleculele triatomice și poliatomice neliniare au șase grade de libertate: trei de translație și trei de rotație ( i=6).
Desigur, nu există nicio legătură rigidă între atomi. Prin urmare, pentru moleculele reale, este necesar să se țină cont și de gradele de libertate miscare oscilatoare.
Pentru fiecare grad de mișcare de translație, există în medie aceeași energie, egală cu 1/3 din valoare<w 0 >:
<w 0 >= . (7.1)
Gradul de vibrație „deține” de două ori mai multă energie, deoarece reprezintă nu numai energia cinetică (ca în cazul mișcărilor de translație și rotație), ci și energia potențială, iar valorile medii ale energiilor cinetice și potențiale sunt aceleași. Astfel, energia medie a unei molecule
Unde i este suma numărului de grade de libertate de translație, rotație și de două ori față de numărul de grade de libertate vibraționale ale moleculei.
Întrucât într-un gaz ideal energia potențială reciprocă a moleculelor este zero (moleculele nu interacționează între ele), energia internă per mol de gaz va fi egală cu suma energiilor cinetice. N / A molecule.
Să ne întoarcem acum la o analiză detaliată a conceptului de energie internă a unui gaz ideal și a relației dintre această energie cu numărul de grade de libertate al moleculelor. Anterior, în modelul de gaz ideal, am luat în considerare doar energia mișcării de translație a moleculelor. Această abordare descrie bine un gaz monoatomic. Conform mecanicii clasice, numărul grade de libertate ale unei molecule monoatomice este egal cu numărul de coordonate necesare pentru a-și stabili poziția în spațiu. În spațiul nostru tridimensional, numărul de coordonate și numărul de grade de libertate ale unui gaz monoatomic este de trei. În conformitate cu (9.6), energia cinetică medie a mișcării de translație a moleculelor, determinată prin pătratul mediu al vitezei v? b, proporțional cu temperatura gazului
În același timp, din izotropia spațiului (egalitatea tuturor direcțiilor), pătratele medii ale componentelor vitezei sunt egale cu v * KB = Vy KB == Vz KB , ceea ce face posibilă compararea fiecărei coordonate și a fiecărui grad de libertate cu o treime din energia cinetică medie a mișcării de translație a moleculelor. Astfel, putem presupune că pentru fiecare grad de libertate există o energie medie
Dacă molecula de gaz nu este monoatomică, ci este formată din N atomi, atunci pentru a-și stabili poziția în spațiu este necesar 3N coordonatele. Astfel, o moleculă N atomi are 3N grade de libertate. Deoarece o moleculă poliatomică este un singur întreg, este convenabil să se ia în considerare mișcarea centrului său de masă cu trei grade de libertate de translație. În acest caz, gradele de libertate rămase cad asupra mișcărilor de rotație și vibrație ale moleculei. Mecanica teoretică afirmă că o moleculă neliniară constând din trei sau mai mulți atomi este capabilă să participe la trei mișcări de rotație independente în jurul a trei axe de coordonate. Orice altă rotație poate fi gândită ca o combinație a acestora. Prin urmare, numărul de grade de libertate de rotație ale unei molecule neliniare este de trei. Pentru o moleculă liniară de doi sau mai mulți atomi (aliniați de-a lungul unei linii), luând în considerare rotația în jurul axei care leagă atomii, care sunt considerați puncte materiale, nu contribuie la energie. Prin urmare, numărul de grade de libertate de rotație ale unei molecule liniare este de două. Gradele de libertate rămase cad asupra mișcării oscilatorii. Este ușor de calculat că numărul de grade de libertate vibraționale pentru o moleculă neliniară este egal cu 3N-6,și pentru o moleculă liniară - 3N-5.
În cazul unui gaz poliatomic (precum și pentru unul monoatomic), legea privind distribuția uniformă a energiei pe grade de libertate: energia cinetică medie pe un grad de libertate a unei molecule la echilibru termic este ~kT.
Ar trebui luată în considerare în special energia gradelor de libertate vibraționale. La temperaturi normale și scăzute, mișcarea vibrațională a moleculelor este de obicei descrisă de legile mecanicii cuantice. Aceste legi justifică rigiditatea moleculelor și absența energiei vibraționale - în acest caz, se crede că gradele de libertate vibraționale înghețat afară(dispărut). La temperaturi ridicate, pe gradul de libertate vibrațional, pe lângă energia cinetică - kT au aceeași energie potențială, astfel încât în total obținem kt.(Din modelul unui oscilator armonic rezultă că energia potențială medie a mișcării oscilatorii este egală cu energia cinetică medie.)
Astfel, în cazul general, energia internă medie a unei molecule este egală cu
iar energia internă a unui mol dintr-un gaz ideal este
Unde i este numărul efectiv de grade de libertate ale moleculei.
După cum rezultă din raționamentul de mai sus, pentru o moleculă monoatomică /=3, pentru o moleculă liniară la temperaturi normale și scăzute /=5, pentru o moleculă neliniară la temperaturi normale și scăzute /=6. La temperaturi ridicate de ordinul a 10 3 K pentru o moleculă liniară i=6N-5, pentru o moleculă neliniară i=6 N-6 .
Observăm că la temperaturi foarte scăzute (de ordinul a 10 K) gradele de libertate de rotație îngheață și ele. Acest lucru se datorează faptului că legile mecanicii statistice clasice, pe care se bazează legea distribuției uniforme a energiei pe grade de libertate, încetează să funcționeze, iar aplicarea legilor mecanicii cuantice este necesară.
Resursa digitală poate fi utilizată pentru predare în cadrul programului de liceu (nivel de profil și avansat).
Modelul computerizat ilustrează caracteristicile mișcării moleculelor. Sunt luate în considerare moleculele monoatomice, diatomice și triatomice, se introduce conceptul de „grade de libertate”.
Scurtă teorie
Lucrul cu modelul
Modelul poate fi utilizat în modul de comutare manuală a cadrelor și în modul demonstrativ automat (Film).
Acest model poate fi folosit ca ilustrație în lecțiile de studiere a materialelor noi, repetare în clasa a 10-a la tema „Ecuația de bază a teoriei cinetice moleculare”.
Conceptul de „grad de libertate” este destul de dificil pentru percepția elevilor de liceu. Modelul ne permite să demonstrăm natura mișcării diferitelor molecule.
Exemplu de planificare a lecției folosind modelul
Subiectul „Ecuația de bază a teoriei cinetice moleculare”
Scopul lecției: de a deriva și analiza ecuația de bază a MKT.
|
|||||||||||||||||||||||||
|
Tabelul 1. |
Exemple de întrebări și sarcini