Hidroxid de crom 2 acid sulfuric concentrat. Compuși ai cromului (III). Proprietățile chimice ale cromului
Cromul formează trei oxizi: CrO, Cr 2 O 3 , CrO 3 .
Oxid de crom (II) CrO - pulbere neagră piroforică. Are proprietăți de bază.
În reacțiile redox, se comportă ca un agent reducător:
CrO se obține prin descompunerea în vid a crom carbonil Cr(CO) 6 la 300°C.
Oxid de crom (III) Cr 2 O 3 - pulbere verde refractară. Este aproape de corindon ca duritate, prin urmare este introdus în compoziția agenților de lustruire. Format prin interacțiunea Cr și O 2 la temperatură ridicată. În laborator, oxidul de crom (III) poate fi obținut prin încălzirea dicromatului de amoniu:
(N -3 H 4) 2 Cr +6 2 O 7 \u003d Cr +3 2 O 3 + N 0 2 + 4H 2 O
Oxidul de crom (III) are proprietăți amfotere. Când interacționează cu acizii, se formează săruri de crom (III): Cr 2 O 3 + 3H 2 SO 4 \u003d Cr 2 (SO 4) 3 + 3H 2 O
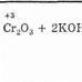
Când interacționează cu alcalii din topitură, se formează compuși de crom (III) - cromiți (în absența oxigenului): Cr 2 O 3 + 2NaOH \u003d 2NaCrO 2 + H 2 O
Oxidul de crom (III) este insolubil în apă.
În reacțiile redox, oxidul de crom (III) se comportă ca un agent reducător:

Oxidul de crom (VI) CrO 3 - anhidridă cromică, este un cristal roșu închis asemănător unui ac. Când este încălzit la aproximativ 200 ° C, se descompune:
4CrO 3 \u003d 2Cr 2 O 3 + 3O 2
Ușor solubil în apă, având un caracter acid, formează acizi cromici. Cu apă în exces se formează acidul cromic H 2 CrO 4:
CrO 3 + H 2 O \u003d H 2 CrO 4
La o concentrație mare de CrO 3 se formează acid dicromic H 2 Cr 2 O 7:
2CrO 3 + H 2 O \u003d H 2 Cr 2 O 7
care, atunci când este diluat, devine acid cromic:
H 2 Cr 2 O 7 + H 2 O \u003d 2H 2 CrO 4
Acizii cromici există numai în soluție apoasă; niciunul dintre acești acizi nu a fost izolat în stare liberă. Cu toate acestea, sărurile lor sunt foarte stabile.
Oxidul de crom (VI) este un agent oxidant puternic:
3S + 4CrO 3 \u003d 3SO 2 + 2Cr 2 O 3
Oxidează iodul, sulful, fosforul, cărbunele, transformându-se în Cr 2 O 3. CrO 3 se obține prin acțiunea unui exces de acid sulfuric concentrat pe o soluție apoasă saturată de dicromat de sodiu: Na 2 Cr 2 O 7 + 2H 2 SO 4 \u003d 2CrO 3 + 2NaHSO 4 + H 2 O Trebuie remarcat faptul că toxicitatea puternică a oxidului de crom (VI).
„Universitatea Politehnică Națională din Tomsk”
Institutul de Geoecologie și Geochimie a Resurselor Naturale
Crom
După disciplină:
Chimie
Efectuat:
elevă grupa 2G41 Tkacheva Anastasia Vladimirovna 29.10.2014
Verificat:
profesorul Stas Nikolay Fedorovich
Poziția în sistemul periodic
Crom- un element dintr-un subgrup lateral al grupei a 6-a a perioadei a 4-a a sistemului periodic de elemente chimice a lui D. I. Mendeleev cu număr atomic 24. Este indicat prin simbol Cr(lat. Crom). substanță simplă crom- metal dur alb-albăstrui. Cromul este uneori denumit metal feros.
Structura atomului
17 Cl) 2) 8) 7 - diagrama structurii atomului
1s2s2p3s3p - formula electronica
Atomul este situat în perioada III și are trei niveluri de energie
Atomul este situat în VII în grup, în subgrupul principal - la nivelul de energie externă de 7 electroni
Proprietățile elementului
Proprietăți fizice
Cromul este un metal alb strălucitor cu o rețea cubică centrată pe corp, o \u003d 0,28845 nm, caracterizată prin duritate și fragilitate, cu o densitate de 7,2 g / cm 3, unul dintre cele mai dure metale pure (al doilea numai după beriliu, wolfram și uraniu), cu un punct de topire de 1903 grade. Și cu un punct de fierbere de aproximativ 2570 de grade. C. În aer, suprafața cromului este acoperită cu o peliculă de oxid, care o protejează de oxidarea ulterioară. Adăugarea de carbon la crom crește și mai mult duritatea acestuia.
Proprietăți chimice
Cromul în condiții normale este un metal inert, când este încălzit devine destul de activ.
Interacțiunea cu nemetale
Când este încălzit peste 600°C, cromul arde în oxigen:
4Cr + 3O 2 \u003d 2Cr 2 O 3.
Reacționează cu fluorul la 350°C, cu clorul la 300°C, cu bromul la o temperatură de căldură roșie, formând halogenuri de crom (III):
2Cr + 3Cl2 = 2CrCl3.
Reacționează cu azotul la temperaturi peste 1000°C pentru a forma nitruri:
2Cr + N2 = 2CrN
sau 4Cr + N2 = 2Cr2N.
2Cr + 3S = Cr2S3.
Reacționează cu borul, carbonul și siliciul formând boruri, carburi și siliciuri:
Cr + 2B = CrB 2 (formarea de Cr 2 B, CrB, Cr 3 B 4, CrB 4 este posibilă),
2Cr + 3C \u003d Cr 2 C 3 (formarea Cr 23 C 6, Cr 7 B 3 este posibilă),
Cr + 2Si = CrSi 2 (posibilă formare de Cr3Si, Cr5Si3, CrSi).
Nu interacționează direct cu hidrogenul.
Interacțiunea cu apa
În stare fierbinte măcinată fin, cromul reacţionează cu apa, formând oxid de crom (III) şi hidrogen:
2Cr + 3H 2 O \u003d Cr 2 O 3 + 3H 2
Interacțiunea cu acizii
În seria electrochimică de tensiuni ale metalelor, cromul este înaintea hidrogenului, înlocuiește hidrogenul din soluțiile de acizi neoxidanți:
Cr + 2HCl \u003d CrCl2 + H2;
Cr + H 2 SO 4 \u003d CrSO 4 + H 2.
În prezența oxigenului atmosferic, se formează sărurile de crom (III):
4Cr + 12HCI + 3O2 = 4CrCl3 + 6H2O.
Acizii azotic și sulfuric concentrați pasivează cromul. Cromul se poate dizolva în ele numai cu încălzire puternică, se formează săruri de crom (III) și produși de reducere a acidului:
2Cr + 6H2S04 = Cr2 (S04)3 + 3S02 + 6H20;
Cr + 6HNO 3 \u003d Cr (NO 3) 3 + 3NO 2 + 3H 2 O.
Interacțiunea cu reactivii alcalini
În soluțiile apoase de alcalii, cromul nu se dizolvă; reacţionează lent cu topiturile alcaline pentru a forma cromiți și eliberează hidrogen:
2Cr + 6KOH \u003d 2KCrO 2 + 2K 2 O + 3H 2.
Reacționează cu topiturile alcaline ale agenților oxidanți, cum ar fi cloratul de potasiu, în timp ce cromul trece în cromat de potasiu:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O.
Recuperarea metalelor din oxizi și săruri
Cromul este un metal activ, capabil să înlocuiască metalele din soluțiile sărurilor lor: 2Cr + 3CuCl 2 = 2CrCl 3 + 3Cu.
Proprietățile unei substanțe simple
Stabil în aer datorită pasivării. Din același motiv, nu reacționează cu acizii sulfuric și azotic. La 2000 °C, arde cu formarea de oxid de crom (III) verde Cr 2 O 3, care are proprietăți amfotere.
Compușii cromului au fost sintetizați cu bor (boruri Cr 2 B, CrB, Cr 3 B 4, CrB 2, CrB 4 și Cr 5 B 3), cu carbon (carburi Cr 23 C 6, Cr 7 C 3 și Cr 3 C 2 ), cu siliciu (siliciuri Cr 3 Si, Cr 5 Si 3 şi CrSi) şi azot (nitruri CrN şi Cr 2 N).
Compuși Cr(+2).
Starea de oxidare +2 corespunde oxidului bazic CrO (negru). Sărurile de Cr 2+ (soluții albastre) se obțin prin reducerea sărurilor de Cr 3+ sau dicromaților cu zinc într-un mediu acid („hidrogen în momentul izolării”):
Toate aceste săruri de Cr 2+ sunt agenți reducători puternici, în măsura în care înlocuiesc hidrogenul din apă la repaus. Oxigenul din aer, mai ales într-un mediu acid, oxidează Cr 2+, drept urmare soluția albastră devine rapid verde.
Hidroxidul de Cr(OH)2 maro sau galben precipită atunci când se adaugă alcalii la soluțiile de săruri de crom(II).
Au fost sintetizate dihalogenuri de crom CrF 2 , CrCl 2 , CrBr 2 și CrI 2
Compuși Cr(+3).
Starea de oxidare +3 corespunde oxidului amfoter Cr 2 O 3 și hidroxidului Cr (OH) 3 (ambele verzi). Aceasta este cea mai stabilă stare de oxidare a cromului. Compușii cromului în această stare de oxidare au o culoare de la violet murdar (ion 3+) la verde (anionii sunt prezenți în sfera de coordonare).
Cr 3+ este predispus la formarea de sulfați dubli de forma M I Cr (SO 4) 2 12H 2 O (aun)
Hidroxidul de crom (III) se obține prin acționarea cu amoniac asupra soluțiilor de săruri de crom (III):
Cr+3NH+3H2O→Cr(OH)↓+3NH
Se pot folosi soluții alcaline, dar în excesul lor se formează un complex hidroxo solubil:
Cr+3OH→Cr(OH)↓
Cr(OH)+3OH→
Prin fuzionarea Cr 2 O 3 cu alcalii se obțin cromiți:
Cr2O3+2NaOH→2NaCrO2+H2O
Oxidul de crom (III) necalcinat se dizolvă în soluții alcaline și în acizi:
Cr2O3+6HCl→2CrCl3+3H2O
Când compușii de crom (III) sunt oxidați într-un mediu alcalin, se formează compușii de crom (VI):
2Na+3HO→2NaCrO+2NaOH+8HO
Același lucru se întâmplă atunci când oxidul de crom (III) este fuzionat cu alcali și agenți oxidanți sau cu alcalii în aer (topirea devine galbenă în acest caz):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4H2O
Compuși ai cromului (+4)[
Prin descompunerea atentă a oxidului de crom (VI) CrO 3 în condiții hidrotermale, se obține oxidul de crom (IV) CrO 2 , care este un feromagnet și are conductivitate metalică.
Dintre tetrahalogenurile de crom, CrF 4 este stabil, tetraclorura de crom CrCl 4 există numai în vapori.
Compuși ai cromului (+6)
Starea de oxidare +6 corespunde oxidului de crom acid (VI) CrO 3 și unui număr de acizi între care există un echilibru. Cele mai simple dintre ele sunt H 2 CrO 4 cromic și H 2 Cr 2 O 7 bicrom. Ele formează două serii de săruri: cromați galbeni și, respectiv, bicromați portocalii.
Oxidul de crom (VI) CrO 3 se formează prin interacțiunea acidului sulfuric concentrat cu soluții de dicromați. Un oxid acid tipic, atunci când interacționează cu apa, formează acizi cromici puternici instabili: H 2 CrO 4 cromic, H 2 Cr 2 O 7 dicromic și alți acizi izopoli cu formula generală H 2 Cr n O 3n+1. O creștere a gradului de polimerizare are loc cu o scădere a pH-ului, adică o creștere a acidității:
2CrO+2H→Cr2O+H2O
Dar dacă se adaugă o soluție alcalină la o soluție portocalie de K 2 Cr 2 O 7, cum devine din nou culoarea galbenă, deoarece se formează din nou cromat K 2 CrO 4:
Cr2O+2OH→2CrO+HO
Nu atinge un grad ridicat de polimerizare, așa cum se întâmplă în wolfram și molibden, deoarece acidul policromic se descompune în oxid de crom (VI) și apă:
H2CrnO3n+1→H2O+nCrO3
Solubilitatea cromaților corespunde aproximativ cu solubilitatea sulfaților. În special, cromat de bariu galben BaCrO 4 precipită atunci când sărurile de bariu sunt adăugate atât la soluții de cromat, cât și de dicromat:
Ba+CrO→BaCrO↓
2Ba+CrO+H2O→2BaCrO↓+2H
Formarea unui cromat de argint roșu-sânge, slab solubil este utilizată pentru a detecta argintul în aliaje folosind acidul de testare.
Sunt cunoscute pentafluorura de crom CrF 5 și hexafluorura de crom instabilă CrF 6. S-au obţinut de asemenea oxihalogenuri volatile de crom CrO 2 F 2 şi CrO 2 Cl 2 (clorură de cromil).
Compușii de crom (VI) sunt agenți puternici de oxidare, de exemplu:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2+7H2O
Adăugarea de peroxid de hidrogen, acid sulfuric și un solvent organic (eter) la dicromați duce la formarea peroxidului de crom albastru CrO 5 L (L este o moleculă de solvent), care este extras în stratul organic; această reacție este folosită ca una analitică.
Cromul este un element dintr-un subgrup lateral din grupa a 6-a a perioadei a IV-a a sistemului periodic de elemente chimice al lui D. I. Mendeleev, cu număr atomic 24. Este desemnat prin simbolul Cr (lat. Crom). Substanța simplă cromul este un metal dur alb-albăstrui.
Proprietățile chimice ale cromului
În condiții normale, cromul reacționează numai cu fluor. La temperaturi ridicate (peste 600°C) interacționează cu oxigenul, halogenii, azotul, siliciul, borul, sulful și fosforul.
4Cr + 3O 2 – t° →2Cr 2 O 3
2Cr + 3Cl 2 – t° → 2CrCl 3
2Cr + N 2 – t° → 2CrN
2Cr + 3S – t° → Cr 2 S 3
În stare fierbinte, reacţionează cu vaporii de apă:
2Cr + 3H2O → Cr2O3 + 3H2
Cromul se dizolvă în acizi puternici diluați (HCl, H2SO4)
În absenţa aerului se formează sărurile Cr 2+, iar în aer se formează sărurile Cr 3+.
Cr + 2HCI → CrCI2 + H2
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2
Prezența unui film protector de oxid pe suprafața metalului explică pasivitatea acestuia în raport cu soluțiile concentrate de acizi - agenți oxidanți.
Compuși ai cromului
Oxid de crom (II).şi hidroxidul de crom (II) sunt bazici.
Cr(OH)2 + 2HCI → CrCI2 + 2H2O
Compușii cromului (II) sunt agenți reducători puternici; trec în compușii cromului (III) sub acțiunea oxigenului atmosferic.
2CrCl2 + 2HCl → 2CrCl3 + H2
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
oxid de crom (III) Cr 2 O 3 este o pulbere verde, insolubilă în apă. Se poate obține prin calcinarea hidroxidului de crom (III) sau a bicromaților de potasiu și amoniu:
2Cr(OH) 3 – t° → Cr 2 O 3 + 3H 2 O
4K 2 Cr 2 O 7 – t° → 2Cr 2 O 3 + 4K 2 CrO 4 + 3O 2
(NH 4) 2 Cr 2 O 7 - t ° → Cr 2 O 3 + N 2 + 4H 2 O (reacția vulcanului)
oxid amfoter. Când Cr 2 O 3 este fuzionat cu alcalii, sodă și săruri acide, se obțin compușii de crom cu o stare de oxidare (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr 2 O 3 + Na 2 CO 3 → 2NaCrO 2 + CO 2
Atunci când sunt fuzionați cu un amestec de alcali și un agent oxidant, compușii de crom se obțin în starea de oxidare (+6):
Cr 2 O 3 + 4KOH + KClO 3 → 2K 2 CrO 4 + KCl + 2H 2 O
Hidroxid de crom (III) C r (OH) 3 . hidroxid amfoter. Gri-verde, se descompune la încălzire, pierzând apă și formând verde metahidroxid CrO(OH). Nu se dizolvă în apă. Precipită din soluție sub formă de hidrat gri-albastru și verde-albăstrui. Reacționează cu acizi și alcalii, nu interacționează cu hidratul de amoniac.
Are proprietăți amfotere - se dizolvă atât în acizi, cât și în alcalii:
2Cr(OH) 3 + 3H 2 SO 4 → Cr 2 (SO 4) 3 + 6H 2 O Cr(OH) 3 + ZH + = Cr 3+ + 3H 2 O
Cr (OH) 3 + KOH → K, Cr (OH) 3 + ZON - (conc.) \u003d [Cr (OH) 6] 3-
Cr (OH) 3 + KOH → KCrO 2 + 2H 2 O Cr (OH) 3 + MON \u003d MCrO 2 (verde) + 2H 2 O (300-400 ° C, M \u003d Li, Na)
Cr(OH) 3 →(120 o C – H 2 O) CrO(OH) →(430-1000 0 С –H 2 O) Cr2O3
2Cr(OH) 3 + 4NaOH (conc.) + ZN 2 O 2 (conc.) \u003d 2Na 2 CrO 4 + 8H 2 0
chitanta: precipitare cu hidrat de amoniac dintr-o soluție de săruri de crom(III):
Cr3+ + 3(NH3H20) = CUr(OH) 3 ↓+ ЗНН 4+
Cr 2 (SO 4) 3 + 6NaOH → 2Cr(OH) 3 ↓+ 3Na 2 SO 4 (în exces de alcali - precipitatul se dizolvă)
Sărurile de crom (III) au o culoare violet sau verde închis. Prin proprietățile chimice, ele seamănă cu sărurile incolore de aluminiu.
Compușii Cr(III) pot prezenta atât proprietăți oxidante, cât și reducătoare:
Zn + 2Cr +3 Cl 3 → 2Cr +2 Cl 2 + ZnCl 2
2Cr +3 Cl 3 + 16NaOH + 3Br 2 → 6NaBr + 6NaCl + 8H 2 O + 2Na 2 Cr +6 O 4
Compuși ai cromului hexavalent
Oxid de crom (VI). CrO 3 - cristale roșii strălucitoare, solubile în apă.
Preparat din cromat (sau dicromat) de potasiu și H2SO4 (conc.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
CrO 3 - oxid acid, formează cromați galbeni CrO 4 2- cu alcalii:
CrO3 + 2KOH → K2CrO4 + H2O
Într-un mediu acid, cromații se transformă în dicromați portocalii Cr 2 O 7 2-:
2K 2 CrO 4 + H 2 SO 4 → K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
Într-un mediu alcalin, această reacție are loc în direcția opusă:
K 2 Cr 2 O 7 + 2KOH → 2K 2 CrO 4 + H 2 O
Bicromatul de potasiu este un agent oxidant într-un mediu acid:
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3Na 2 SO 3 \u003d Cr 2 (SO 4) 3 + 3Na 2 SO 4 + K 2 SO 4 + 4H 2 O
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3NaNO 2 = Cr 2 (SO 4) 3 + 3NaNO 3 + K 2 SO 4 + 4H 2 O
K 2 Cr 2 O 7 + 7H 2 SO 4 + 6KI = Cr 2 (SO 4) 3 + 3I 2 + 4K 2 SO 4 + 7H 2 O
K 2 Cr 2 O 7 + 7H 2 SO 4 + 6FeSO 4 = Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O
Cromat de potasiu K2 Cr Cam 4 . Oksosol. Galben, nehigroscopic. Se topește fără descompunere, stabilă termic. Foarte solubil în apă galben culoarea soluţiei corespunde ionului CrO 4 2-, hidrolizează uşor anionul. Într-un mediu acid, trece în K 2 Cr 2 O 7. Agent oxidant (mai slab decât K 2 Cr 2 O 7). Intră în reacții de schimb ionic.
Reacție calitativă pe ionul CrO 4 2- - precipitarea unui precipitat galben de cromat de bariu, descompunându-se în mediu puternic acid. Este folosit ca mordant pentru vopsirea țesăturilor, agent de tăbăcire a pielii, agent de oxidare selectivă și reactiv în chimia analitică.
Ecuațiile celor mai importante reacții:
2K 2 CrO 4 + H 2 SO 4 (30%) = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
2K 2 CrO 4 (t) + 16HCl (conc., orizont) \u003d 2CrCl 3 + 3Cl 2 + 8H 2 O + 4KCl
2K 2 CrO 4 +2H 2 O+3H 2 S=2Cr(OH) 3 ↓+3S↓+4KOH
2K 2 CrO 4 +8H 2 O+3K 2 S=2K[Сr(OH) 6]+3S↓+4KOH
2K 2 CrO 4 + 2AgNO 3 \u003d KNO 3 + Ag 2 CrO 4 (roșu) ↓
Raspuns calitativ:
K 2 CrO 4 + BaCl 2 \u003d 2KSl + BaCrO 4 ↓
2ВаСrO 4 (t) + 2НCl (razb.) = ВаСr 2 O 7(p) + ВаС1 2 + Н 2 O
chitanta: sinterizarea cromitului cu potasiu în aer:
4(Cr 2 Fe ‖‖)O 4 + 8K 2 CO 3 + 7O 2 = 8K 2 CrO 4 + 2Fe 2 O 3 + 8СO 2 (1000 °С)
Bicromat de potasiu K 2 Cr 2 O 7 . Oksosol. denumire tehnică chrompeak. Roșu portocaliu, nehigroscopic. Se topește fără descompunere, se descompune la încălzire ulterioară. Foarte solubil în apă portocale culoarea soluţiei corespunde ionului Cr 2 O 7 2-). Într-un mediu alcalin, formează K2CrO4. Un agent oxidant tipic în soluție și atunci când este topit. Intră în reacții de schimb ionic.
Reacții calitative- colorarea albastră a unei soluţii eterice în prezenţa H 2 O 2, colorarea în albastru a unei soluţii apoase sub acţiunea hidrogenului atomic.
Se folosește ca agent de tăbăcire a pielii, mordant pentru vopsirea țesăturilor, component al compozițiilor pirotehnice, reactiv în chimia analitică, inhibitor de coroziune a metalelor, amestecat cu H 2 SO 4 (conc.) - pentru spălarea vaselor chimice.
Ecuațiile celor mai importante reacții:
4K 2 Cr 2 O 7 \u003d 4K 2 CrO 4 + 2Cr 2 O 3 + 3O 2 (500-600 o C)
K 2 Cr 2 O 7 (t) + 14HCl (conc) \u003d 2CrCl 3 + 3Cl 2 + 7H 2 O + 2KCl (fierbe)
K 2 Cr 2 O 7 (t) + 2H 2 SO 4 (96%) ⇌2KHSO 4 + 2CrO 3 + H 2 O („amestec de crom”)
K 2 Cr 2 O 7 +KOH (conc) \u003d H 2 O + 2K 2 CrO 4
Cr 2 O 7 2- + 14H + + 6I - \u003d 2Cr 3+ + 3I 2 ↓ + 7H 2 O
Cr 2 O 7 2- + 2H + + 3SO 2 (g) \u003d 2Cr 3+ + 3SO 4 2- + H 2 O
Cr 2 O 7 2- + H 2 O + 3H 2 S (g) \u003d 3S ↓ + 2OH - + 2Cr 2 (OH) 3 ↓
Cr 2 O 7 2- (conc) + 2Ag + (razb.) \u003d Ag 2 Cr 2 O 7 (deci roșu) ↓
Cr 2 O 7 2- (razb.) + H 2 O + Pb 2+ \u003d 2H + + 2PbCrO 4 (roșu) ↓
K 2 Cr 2 O 7 (t) + 6HCl + 8H 0 (Zn) \u003d 2CrCl 2 (syn) + 7H 2 O + 2KCl
Chitanță: tratarea K 2 CrO 4 cu acid sulfuric:
2K2Cr04 + H2S04 (30%) = K 2Cr 2 O 7 + K2SO4 + H2O

Cromul este un element chimic cu număr atomic 24. Este un metal dur, strălucitor, de culoare gri-oțel, care se lustruiește bine și nu se pătează. Folosit în aliaje precum oțelul inoxidabil și ca acoperire. Corpul uman necesită cantități mici de crom trivalent pentru a metaboliza zahărul, dar Cr(VI) este foarte toxic.
Diferiți compuși ai cromului, cum ar fi oxidul de crom (III) și cromatul de plumb, sunt viu colorați și sunt utilizați în vopsele și pigmenți. Culoarea roșie a unui rubin se datorează prezenței acestui element chimic. Unele substanțe, în special sodiul, sunt agenți oxidanți folosiți pentru oxidarea compușilor organici și (împreună cu acidul sulfuric) pentru curățarea sticlei de laborator. În plus, oxidul de crom (VI) este utilizat în producția de bandă magnetică.
Descoperire și etimologie
Istoria descoperirii elementului chimic crom este următoarea. În 1761, Johann Gottlob Lehmann a găsit un mineral roșu portocaliu în Munții Urali și l-a numit „plumb roșu siberian”. Deși a fost identificat în mod eronat ca un compus de plumb cu seleniu și fier, materialul a fost de fapt cromat de plumb cu formula chimică PbCrO 4 . Astăzi este cunoscut drept mineralul croconte.
În 1770, Peter Simon Pallas a vizitat locul unde Leman a găsit un mineral de plumb roșu care avea proprietăți pigmentare foarte utile în vopsele. Utilizarea plumbului roșu siberian ca vopsea sa dezvoltat rapid. În plus, galbenul strălucitor din croconte a devenit la modă.
În 1797, Nicolas-Louis Vauquelin a obţinut probe de roşu Prin amestecarea croconte-ului cu acid clorhidric, a obţinut oxidul CrO 3 . Cromul ca element chimic a fost izolat în 1798. Vauquelin a obținut-o prin încălzirea oxidului cu cărbune. De asemenea, a putut detecta urme de crom în pietre prețioase precum rubinul și smaraldul.
În anii 1800, Cr era folosit în principal în vopsele și săruri de piele. Astăzi, 85% din metal este folosit în aliaje. Restul este folosit în industria chimică, producția de materiale refractare și industria de turnătorie.
Pronunțarea elementului chimic crom corespunde grecului χρῶμα, care înseamnă „culoare”, din cauza numeroșilor compuși colorați care se pot obține din acesta.

Exploatare și producție
Elementul este realizat din cromit (FeCr 2 O 4). Aproximativ jumătate din acest minereu din lume este extras în Africa de Sud. În plus, Kazahstan, India și Turcia sunt principalii săi producători. Există suficiente zăcăminte explorate de cromit, dar din punct de vedere geografic sunt concentrate în Kazahstan și Africa de Sud.
Depozitele de crom metal nativ sunt rare, dar ele există. De exemplu, este extras la mina Udachnaya din Rusia. Este bogat în diamante, iar mediul reducător a ajutat la formarea cromului pur și a diamantelor.
Pentru producția industrială de metal, minereurile de cromit sunt tratate cu alcalii topite (sodă caustică, NaOH). În acest caz, se formează cromat de sodiu (Na 2 CrO 4), care este redus cu carbon la oxid de Cr 2 O 3. Metalul se obține prin încălzirea oxidului în prezența aluminiului sau siliciului.
În 2000, aproximativ 15 Mt de minereu de cromit au fost extrase și prelucrate în 4 Mt de ferocrom, 70% crom-fier, cu o valoare de piață estimată la 2,5 miliarde USD.

Principalele caracteristici
Caracteristica elementului chimic crom se datorează faptului că este un metal de tranziție din perioada a patra a tabelului periodic și se află între vanadiu și mangan. Inclus în grupa VI. Se topește la o temperatură de 1907 °C. În prezența oxigenului, cromul formează rapid un strat subțire de oxid, care protejează metalul de interacțiunea ulterioară cu oxigenul.
Ca element de tranziție, reacționează cu substanțe în diferite proporții. Astfel, formează compuși în care are diferite stări de oxidare. Cromul este un element chimic cu stări fundamentale +2, +3 și +6, dintre care +3 este cel mai stabil. În plus, stările +1, +4 și +5 sunt observate în cazuri rare. Compușii cromului în starea de oxidare +6 sunt agenți oxidanți puternici.
Ce culoare este cromul? Elementul chimic conferă o nuanță de rubin. Cr 2 O 3 folosit pentru este, de asemenea, folosit ca pigment numit „verde crom”. Sărurile sale colorează sticla într-o culoare verde smarald. Cromul este un element chimic a cărui prezență face un roșu rubin. Prin urmare, este utilizat în producția de rubine sintetice.

izotopi
Izotopii cromului au greutăți atomice de la 43 la 67. De obicei, acest element chimic constă din trei forme stabile: 52 Cr, 53 Cr și 54 Cr. Dintre acestea, 52 Cr este cel mai comun (83,8% din tot cromul natural). În plus, au fost descriși 19 radioizotopi, dintre care 50 Cr este cel mai stabil, cu un timp de înjumătățire depășind 1,8 x 10 17 ani. 51 Cr are un timp de înjumătățire de 27,7 zile, iar pentru toți ceilalți izotopi radioactivi nu depășește 24 de ore, iar pentru majoritatea durează mai puțin de un minut. Elementul are, de asemenea, două metastate.
Izotopii de crom din scoarța terestră, de regulă, însoțesc izotopii de mangan, care își găsesc aplicație în geologie. 53 Cr se formează în timpul dezintegrarii radioactive de 53 Mn. Raportul izotopului Mn/Cr întărește alte informații despre istoria timpurie a sistemului solar. Modificările raporturilor dintre 53 Cr/ 52 Cr și Mn/Cr de la diferiți meteoriți demonstrează că noi nuclee atomice au fost create chiar înainte de formarea sistemului solar.

Element chimic crom: proprietăți, formula compușilor
Oxidul de crom (III) Cr 2 O 3, cunoscut și sub denumirea de sesquioxid, este unul dintre cei patru oxizi ai acestui element chimic. Se obține din cromit. Compusul verde este denumit în mod obișnuit „verde crom” atunci când este utilizat ca pigment pentru smalț și vopsire pe sticlă. Oxidul se poate dizolva în acizi, formând săruri și în alcalii topiți, cromiți.
Bicromat de potasiu
K 2 Cr 2 O 7 este un agent oxidant puternic și este preferat ca agent de curățare pentru sticla de laborator din substanțe organice. Pentru aceasta se folosește soluția sa saturată, uneori însă se înlocuiește cu dicromat de sodiu, pe baza solubilității mai mari a acestuia din urmă. În plus, poate regla procesul de oxidare a compușilor organici, transformând alcoolul primar în aldehidă și apoi în dioxid de carbon.
Bicromatul de potasiu poate provoca dermatita cu crom. Cromul este probabil cauza sensibilizării care duce la dezvoltarea dermatitei, în special a mâinilor și antebrațelor, care este cronică și greu de tratat. Ca și alți compuși Cr(VI), bicromatul de potasiu este cancerigen. Trebuie manipulat cu mănuși și echipament de protecție adecvat.

Acidul cromic
Compusul are structura ipotetică H2CrO4. În natură nu se găsesc nici acizii cromici, nici dicromici, dar anionii lor se găsesc în diferite substanțe. „Acidul cromic”, care poate fi găsit la vânzare, este de fapt anhidrida sa acidă - trioxidul CrO 3 .
Cromat de plumb(II).
PbCrO 4 are o culoare galben strălucitor și este practic insolubil în apă. Din acest motiv, și-a găsit aplicație ca pigment colorant sub denumirea de „coroană galbenă”.
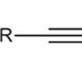
Cr și legătura pentavalentă
Cromul se distinge prin capacitatea sa de a forma legături pentavalente. Compusul este creat de Cr(I) și un radical de hidrocarbură. Între doi atomi de crom se formează o legătură pentavalentă. Formula sa poate fi scrisă ca Ar-Cr-Cr-Ar unde Ar este o grupare aromatică specifică.

Aplicație
Cromul este un element chimic ale cărui proprietăți i-au oferit numeroase utilizări diferite, dintre care unele sunt enumerate mai jos.
Oferă metalelor rezistență la coroziune și o suprafață lucioasă. Prin urmare, cromul este inclus în aliaje precum oțelul inoxidabil, folosit în tacâmuri, de exemplu. Este folosit și pentru cromare.
Cromul este un catalizator pentru diferite reacții. Se folosește la realizarea matrițelor pentru arderea cărămizilor. Sărurile sale bronzează pielea. Bicromatul de potasiu este utilizat pentru oxidarea compușilor organici precum alcoolii și aldehidele, precum și pentru curățarea sticlei de laborator. Servește ca agent de fixare pentru vopsirea țesăturilor și este, de asemenea, utilizat în fotografie și imprimare foto.
CrO 3 este folosit pentru a face benzi magnetice (de exemplu, pentru înregistrarea audio), care au caracteristici mai bune decât filmele cu oxid de fier.
Rolul în biologie
Cromul trivalent este un element chimic esențial pentru metabolismul zahărului în corpul uman. În schimb, Cr hexavalent este foarte toxic.
Masuri de precautie
Cromul metalic și compușii Cr(III) nu sunt în general considerați periculoși pentru sănătate, dar substanțele care conțin Cr(VI) pot fi toxice dacă sunt ingerate sau inhalate. Majoritatea acestor substanțe sunt iritante pentru ochi, piele și membranele mucoase. Cu expunerea cronică, compușii de crom (VI) pot provoca leziuni oculare dacă nu sunt tratați corespunzător. În plus, este un cancerigen recunoscut. Doza letală a acestui element chimic este de aproximativ o jumătate de linguriță. Conform recomandărilor Organizației Mondiale a Sănătății, concentrația maximă admisă de Cr (VI) în apa potabilă este de 0,05 mg pe litru.
Deoarece compușii de crom sunt utilizați în vopsele și tăbăcirea pielii, aceștia se găsesc adesea în solul și apele subterane ale siturilor industriale abandonate care necesită curățarea și remedierea mediului. Primerul care conține Cr(VI) este încă utilizat pe scară largă în industria aerospațială și auto.
Proprietățile elementului
Principalele proprietăți fizice ale cromului sunt următoarele:
- Număr atomic: 24.
- Greutate atomică: 51.996.
- Punct de topire: 1890 °C.
- Punct de fierbere: 2482 °C.
- Stare de oxidare: +2, +3, +6.
- Configurația electronică: 3d 5 4s 1 .
Oxid de crom (II) CrO- pulbere neagră piroforică (piroforic - capacitatea de a se aprinde în aer într-o stare fin divizată). Se obține prin oxidarea amalgamului de crom cu oxigenul atmosferic. Solubil în acid clorhidric diluat:
În aer, când este încălzit peste 100 ° C, oxidul de crom (II) se transformă în oxid de crom (III).
Săruri de crom (II).În ceea ce privește proprietățile lor chimice, sărurile Cr 2+ sunt similare cu sărurile Fe 2+. Prin tratarea soluțiilor lor cu alcalii în absența oxigenului, se poate obține un precipitat galben. hidroxid de crom (II):
care are proprietăți de bază tipice. Este un restaurator. Când Cr(OH)2 este calcinat în absența oxigenului, se formează oxid de crom (II) CrO. Când este calcinat în aer, se transformă în Cr 2 O 3.
Toți compușii de crom (II) sunt destul de instabili și sunt ușor oxidați de oxigenul atmosferic la compuși de crom (III):
Săruri de crom (III). Sărurile de crom trivalente sunt asemănătoare sărurilor de aluminiu ca compoziție, structura rețelei cristaline și solubilitate. În soluțiile apoase, cationul Cr 3+ apare doar ca ion hidratat [Cr(H 2 O) 6 ] 3+ , care conferă o culoare violetă soluției (pentru simplitate, scrieți Cr 3+).
Sub acțiunea alcalinelor asupra sărurilor de crom (III), un precipitat gelatinos hidroxid de crom (III) - Cr (OH) 3 Culoare verde:
Hidroxidul de crom(III) are amfoter proprietăți, dizolvarea ca în acizi cu formarea de săruri de crom (III):
și în alcalii cu formarea de tetrahidroxicromiți, adică săruri în care Cr3+ face parte din anion:
Ca rezultat al calcinării Cr (OH) 3, se poate obține oxid de crom (III) Cr 2 O 3 :
Oxid de crom (III) Cr 2 O 3- pulbere verde refractară. Este aproape de corindon ca duritate, prin urmare este introdus în compoziția agenților de lustruire. Se obține prin combinarea elementelor la temperatură ridicată.
Cr 2 O 3 este un cristal verde, practic insolubil în apă. Cr 2 O 3 poate fi obţinut şi prin calcinarea dicromaţilor de potasiu şi amoniu:
Când Cr 2 O 3 este fuzionat cu alcalii, sodă și săruri acide, se obțin compuși Cr 3+ care sunt solubili în apă:
Oxid de crom (VI).- oxid acid, anhidridă acizi H2CrO4 cromic şi H2Cr2O7 dicromic.
Se obține prin reacția acidului sulfuric concentrat cu o soluție saturată de dicromat de sodiu sau de potasiu:
CrO 3 este de natură acidă: se dizolvă ușor în apă, formând acizi cromici. Cu apă în exces, formează acid cromic H 2 CrO 4:
La o concentrație mare de CrO 3 se formează acid dicromic H 2 Cr 2 O 7:
care, atunci când este diluat, devine acid cromic:
Acizii cromici există numai în soluție apoasă. Cu toate acestea, sărurile lor sunt destul de stabile.
CrO 3 este un cristal de culoare roșie strălucitoare, ușor solubil în apă Agent oxidant puternic: oxidează iodul, sulful, fosforul, cărbunele, transformându-se în Cr 2 O 3 . De exemplu:
Când este încălzit la 250 ° C, se descompune:
Reacționează cu alcalii formând galben cromații CrO 4 2-:
Într-un mediu acid, ionul CrO 4 2- se transformă în ionul Cr 2 O 7 2-.
Într-un mediu alcalin, această reacție are loc în direcția opusă:
V mediu acid ionul dicromat este redus la Cr 3+:
Dacă comparăm hidroxizii de crom cu grade diferite de oxidare
Cr 2+ (OH) 2, Cr 3+ (OH) 3 și H 2 Cr 6+ O 4, este ușor de concluzionat că cu creșterea gradului de oxidare, proprietățile de bază ale hidroxizilor slăbesc, iar cele acide cresc.
Cr(OH)2 prezintă proprietăţi de bază, Cr(OH)3 este amfoter, iar H2CrO4 este acid.
Cromații și dicromații (VI). Cei mai importanți compuși ai cromului în cea mai mare stare de oxidare 6+ sunt cromatul de potasiu (VI) K 2 CrO 4 și dicromatul de potasiu (VI) K 2 Cr 2 O 7 .
Acizii cromici formează două serii de săruri: cromații, așa-numitele săruri ale acidului cromic, și dicromații, așa-numitele săruri ale acidului dicromic. Cromații sunt colorați în galben (culoarea ionului cromat CrO 4 2-), dicromații sunt colorați în portocaliu (culoarea ionului dicromat Cr 2 O 7 2-).
Dicromații Na 2 Cr 2 O 7 × 2H 2 O și K 2 Cr 2 O 7 se numesc vârfuri cromice. Sunt folosiți ca agenți oxidanți în industria pielii (tăbăcire), vopselelor și lacurilor, chibriturii și textilelor. Amestecul de crom - așa-numita soluție 3% de dicromat de potasiu în acid sulfuric concentrat - este utilizat în laboratoarele chimice pentru spălarea sticlei.
Sărurile acizilor cromici într-un mediu acid sunt agenți oxidanți puternici:
Compușii cromului (III) într-un mediu alcalin joacă rolul de agenți reducători. Sub acțiunea diferiților agenți oxidanți - Cl 2, Br 2, H 2 O 2, KmnO 4 etc. - se transformă în compuși de crom (IV) - cromați:
Aici, compusul Cr (III) este prezentat sub formă de Na, deoarece există sub formă de ioni Na + și - într-un exces de soluție alcalină.
Agenții oxidanți puternici, cum ar fi KMnO 4, (NH 4) 2 S 2 O 8 într-un mediu acid, transformă compușii Cr (III) în dicromați:
Astfel, proprietățile de oxidare sunt îmbunătățite constant cu o schimbare a stărilor de oxidare în seria: Cr 2+ ® Cr 3+ ® Cr 6+ . Compușii Cr (II) sunt agenți reducători puternici, se oxidează ușor, transformându-se în compuși de crom. (III). Compușii de crom (VI) sunt oxidanți puternici, ușor de redus la compuși de crom (III). Compușii cu o stare de oxidare intermediară, adică compușii de crom (III), pot prezenta proprietăți oxidante atunci când interacționează cu agenți reducători puternici, transformându-se în compuși de crom (II) și când interacționează cu agenți oxidanți puternici (de exemplu, brom, KMnO 4) pot prezenta proprietăți reducătoare, transformându-se în compuși de crom (VI).
Sărurile de crom (III) sunt foarte diverse ca culoare: violet, albastru, verde, maro, portocaliu, roșu și negru. Toți acizii cromici și sărurile lor, precum și oxidul de crom (VI) sunt otrăvitori: afectează pielea, tractul respirator, provoacă inflamarea ochilor, prin urmare, atunci când lucrați cu ei, trebuie respectate toate precauțiile.