Cataliza în reacții chimice. Reacții catalitice: definiție, descriere, exemple Reacții catalitice catalitice
Majoritatea proceselor care stau la baza tehnologiei chimice sunt reacții catalitice. Acest lucru se datorează faptului că, odată cu introducerea unui catalizator, viteza de interacțiune a substanțelor crește semnificativ. În acest caz, producătorii pot reduce costurile sau pot obține mai multe produse de reacție în aceeași perioadă de timp. De aceea, se acordă multă atenție studiului catalizei în pregătirea tehnologilor. Cu toate acestea, acest fenomen joacă, de asemenea, un rol important în natură. Deci, substanțele speciale reglează cursul reacțiilor biochimice în organismele vii, afectând astfel metabolismul.
Conceptul de cataliză
Esența acestui fenomen chimic este reglarea vitezei de transformare a substanțelor folosind reactivi speciali care pot încetini sau accelera acest proces. În acest caz, se vorbește de cataliză pozitivă sau negativă. Există și fenomenul de autocataliză, când unul dintre produșii intermediari ai unei reacții chimice afectează viteza de reacție. Procesele catalitice sunt diverse, diferă prin mecanisme, starea de agregare a compușilor și direcție.
Substanțele care încetinesc interacțiunile chimice sunt numite inhibitori, iar cele care accelerează reacțiile catalitice sunt numite catalizatori. Atât aceștia, cât și alții modifică viteza de reacție prin interacțiuni intermediare repetate cu unul sau mai mulți dintre participanții săi. În același timp, acestea nu sunt incluse în compoziția produselor și sunt restaurate după încheierea ciclului de transformare a substanțelor. Prin urmare, participarea catalizatorului nu este reflectată în ecuația reacției stoichiometric, ci este indicată doar ca o condiție pentru interacțiunea substanțelor.
Tipuri de reacții catalitice
În funcție de starea de agregare a substanțelor care participă la o reacție chimică, există:
- reacții omogene - reactanții, produșii și catalizatorul sunt în aceeași stare de agregare (fază), în timp ce moleculele substanțelor sunt distribuite uniform în volum;
- reactii catalitice interfaciale - apar la interfata lichidelor nemiscibile, iar rolul catalizatorului se reduce la transferul de reactivi prin acesta;
- reacții catalitice eterogene - în ele, catalizatorul are o stare de agregare diferită de reactivi și el însuși se desfășoară pe interfață;
- reacții heterogene-omogene - sunt inițiate la interfața cu catalizatorul și continuă în volumul de reacție;
- reacții microeterogene - particulele mici ale unui catalizator solid formează micelii pe întregul volum al fazei lichide.
Există, de asemenea, cataliză redox, însoțită de o schimbare a stării de oxidare a catalizatorului la interacțiunea cu reactivii. Astfel de transformări se numesc reacții catalitice de oxidare și reducere. Cea mai comună în producția chimică este oxidarea dioxidului de sulf în trioxid în producerea acidului sulfuric.

Tipuri de catalizatori
După starea de agregare, catalizatorii sunt lichizi (H 2 SO 4, H 3 RO 4), solizi (Pt, V 2 O 5, Al 2 O 3) și gazoși (BF 3).
În funcție de tipul de substanță, catalizatorii sunt clasificați în:
- metale - pot fi pure, aliaje, solide sau depuse pe o bază poroasă (Fe, Pt, Ni, Cu);
- compuși metalici de tip M m E n - cei mai des întâlniți oxizi sunt MgO, Al 2 O 3, MoO 3 etc.;
- acizi și baze - utilizate pentru reacții catalitice acido-bazice, acestea pot fi acizi Lewis, Bronsted etc.;
- complecși metalici - acest grup include, de asemenea, săruri ale metalelor de tranziție, cum ar fi PdCl2, Ni(CO)4;
- enzimele (sunt și enzime) sunt biocatalizatori care accelerează reacțiile care au loc în organismele vii.
După specificul structurii electronice, se disting catalizatorii d, având electroni d și orbitali d, precum și catalizatorii s, p, al căror centru este un element cu electroni de valență s și p.

Proprietățile catalizatorilor
Pentru a fi utilizate eficient, li se aplică o listă destul de extinsă de cerințe, care variază pentru un anumit proces. Dar cele mai semnificative sunt următoarele două proprietăți ale catalizatorilor:
- Specificitatea constă în capacitatea catalizatorilor de a influența doar o reacție sau o serie de transformări similare și de a nu afecta viteza altora. Astfel, platina este cel mai des folosită în reacțiile de hidrogenare organică.
- Selectivitatea este caracterizată prin capacitatea de a accelera una dintre mai multe reacții paralele posibile, crescând astfel randamentul celui mai important produs.
Viteza de reacție catalitică
Motivul pentru accelerarea interacțiunii substanțelor este formarea unui complex activ cu un catalizator, ceea ce duce la o scădere a energiei de activare.

Conform postulatului de bază al cineticii chimice, viteza oricărei reacții chimice este direct proporțională cu produsul concentrațiilor substanțelor inițiale, care sunt luate în puteri corespunzătoare coeficienților lor stoichiometrici:
v = k ∙ C A x ∙ C B y ∙ C D z ,
unde k este constanta de viteză a unei reacții chimice, numeric egală cu viteza aceleiași reacții, cu condiția ca concentrațiile compușilor inițiali să fie de 1 mol/l.
Conform ecuației lui Arrhenius, k depinde de energia de activare:
k \u003d A ∙ exp ^ (-E A / RT).
Aceste regularități sunt valabile și pentru reacțiile catalitice. Acest lucru este confirmat de ecuația pentru raportul constantelor de viteză:
k K / k = A K /A ∙ exp^((E A -E AK)/RT),
unde variabilele cu indicele K se referă la reacții catalitice.
Etapele reacțiilor catalitice
Pentru reacțiile catalitice omogene, sunt suficiente două etape principale:
- Formarea unui complex activat: A + K -> AA.
- Interacțiunea complexului activat cu alte substanțe inițiale: AA + B ―> C + K.
În formă generală, se scrie o ecuație de forma A + B -> C.
Mecanismul reacțiilor catalitice eterogene este complex. Se disting următoarele șase etape:
- Aducerea compușilor de pornire la suprafața catalizatorului.
- Adsorbția reactanților inițiali de către suprafața catalizatorului și formarea unui complex intermediar: A + B + K ―> AVK.
- Activarea complexului rezultat: ΑVC ―> ΑVC * .
- Descompunerea compusului complex, în timp ce produsele formate sunt adsorbite de catalizator: ΑВК * ―> CDK.
- Desorbția produselor rezultate de către suprafața catalizatorului: CDK ―> C + D + K.
- Îndepărtarea produselor din catalizator.

Exemple de reacții catalitice
Catalizatorii sunt utilizați nu numai în industria chimică. Orice persoană din viața de zi cu zi se confruntă cu diverse reacții catalitice. Aceasta este, de exemplu, utilizarea peroxidului de hidrogen în tratamentul rănilor. Peroxidul de hidrogen, atunci când interacționează cu sângele, începe să se descompună sub influența:
2H2O2 -> O2 + 2H2O.

În mașinile moderne, este echipat cu camere catalitice speciale care contribuie la descompunerea substanțelor gazoase nocive. De exemplu, platina sau rodiul ajută la reducerea poluării cu oxid de azot, care se descompune pentru a forma O 2 și N 2 inofensivi.
Unele paste de dinți conțin enzime care descompun placa și resturile alimentare.
În acest articol, vor fi luate în considerare reacțiile catalitice. Cititorul va fi introdus într-o idee generală despre catalizatori și efectul lor asupra sistemului, iar tipurile de reacții, caracteristicile cursului lor și multe altele vor fi descrise.
Introducere în cataliză
Înainte de a vă familiariza cu reacțiile catalitice, merită să știți ce este cataliza.
Este un proces selectiv de accelerare a unei anumite direcții de reacție permise termodinamic, care este expusă unui catalizator. Este inclus în mod repetat în interacțiunea de natură chimică și are un efect asupra participanților la reacție. La sfârșitul oricărui ciclu de natură intermediară, catalizatorul își reia forma inițială. Conceptul de catalizator a fost introdus în circulație de către J. Barzelius și Jens în 1835.

Informatii generale
Cataliza este larg distribuită în natură și este utilizată pe scară largă de către om în industria tehnologică. Numărul predominant al tuturor reacțiilor utilizate în industrie sunt catalitice. Există un concept de autocataliză - un fenomen în care acceleratorul acționează ca produs de reacție sau face parte din compușii de pornire.
Toate tipurile de interacțiuni chimice ale substanțelor care reacţionează sunt împărțite în reacții catalitice și necatalitice. Accelerarea reacțiilor care implică catalizatori se numește cataliză pozitivă. Încetinirea vitezei de interacțiune are loc cu participarea inhibitorilor. Reacțiile sunt de natură negativ-catalitică.
Reacția catalitică nu este doar o modalitate de creștere a productivității, ci și o oportunitate care îmbunătățește calitatea produsului rezultat. Acest lucru se datorează capacității unei substanțe special selectate de a accelera reacția principală și de a încetini viteza celor paralele.
Reacțiile catalitice reduc, de asemenea, costul energiei, care consumă aparatul. Acest lucru se datorează faptului că accelerarea permite procesului să continue la o temperatură mai scăzută, ceea ce ar fi necesar fără ea.
Un exemplu de reacție catalitică este producerea unor lucruri atât de valoroase precum: acid azotic, hidrogen, amoniac etc. Aceste procese sunt cele mai utilizate în producerea de aldehide, fenol, diverse materiale plastice, rășini și cauciucuri etc.
Varietate de reacții

Esența catalizei constă în transferul mecanismului de reacție la cea mai profitabilă opțiune. Acest lucru devine posibil datorită scăderii energiei de activare.
Catalizatorul formează o legătură chimică slabă cu o moleculă specifică de reactant. Acest lucru face posibilă facilitarea reacției cu un alt reactiv. Substanțele care sunt catalitice nu afectează schimbarea echilibrului chimic, deoarece acționează reversibil în ambele direcții.
Cataliza este împărțită în două tipuri principale: omogenă și eterogenă. O caracteristică comună a tuturor interacțiunilor de primul tip este prezența unui catalizator într-o fază comună cu reactantul reacției în sine. Al doilea tip diferă în acest punct.
Reacțiile catalitice omogene ne arată că acceleratorul, interacționând cu o anumită substanță, formează un compus intermediar. Acest lucru va reduce și mai mult cantitatea de energie necesară pentru activare.
Cataliza eterogenă accelerează procesul. De regulă, curge pe suprafața corpurilor solide. Ca rezultat, capacitățile catalizatorului și activitatea sa sunt determinate de dimensiunea suprafeței și de proprietățile individuale. O reacție catalitică eterogenă are un mecanism de funcționare mai complex decât unul omogen. Mecanismul său include 5 etape, fiecare dintre ele putând fi reversibilă.
În prima etapă, începe difuzia reactanților care interacționează în zona solidului, apoi are loc adsorbția de natură fizică, urmată de chimisorbția. Ca urmare, are loc a treia etapă, în care reacția începe să aibă loc între moleculele substanțelor care reacţionează. La a patra etapă se observă desorbția produsului. La a cincea etapă are loc difuzia substanței finale în fluxurile generale din planul catalizatorului.
materiale catalitice
Există un concept de purtător de catalizator. Este un material de tip inert sau slab activ, necesar pentru a aduce particulele care participă la faza de cataliză într-o stare stabilă.
Accelerarea eterogenă este necesară pentru a preveni procesele de sinterizare și aglomerare a componentelor active. În numărul predominant de cazuri, cantitatea de purtători depășește prezența componentei depuse de tip activ. Lista principală de cerințe pe care trebuie să le aibă transportatorul include o suprafață mare și porozitate, stabilitate termică, inerție și rezistență la stres mecanic.
Baza chimica. Chimia accelerării fluxului de interacțiune între substanțe ne permite să distingem două tipuri de substanțe, și anume catalizatori și inhibitori. Acesta din urmă, la rândul său, încetinește viteza reacției. Unul dintre tipurile de catalizatori sunt enzimele.
Catalizatorii nu interacționează stoichiometric cu produsul reacției în sine și sunt întotdeauna regenerați în final. În vremurile moderne, există multe modalități de a influența procesul de activare moleculară. Cu toate acestea, cataliza este baza producției chimice.
Natura catalizatorilor le permite să fie împărțite în omogene, eterogene, interfaciale, enzimatice și micelare. O reacție chimică cu participarea unui catalizator va reduce energia necesară pentru activarea acesteia. De exemplu, descompunerea necatalitică a NH3 în azot și hidrogen ar necesita aproximativ 320 kJ/mol. Aceeași reacție, dar sub influența platinei, va reduce acest număr la 150 kJ/mol.
Procesul de hidrogenare

Numărul predominant de reacții care implică catalizatori se bazează pe activarea unui atom de hidrogen și a unei anumite molecule, ceea ce duce ulterior la o interacțiune de natură chimică. Acest fenomen se numește hidrogenare. Ea stă la baza majorității etapelor rafinării petrolului și creării combustibilului lichid din cărbune. Producția acestuia din urmă a fost deschisă în Germania, din cauza lipsei zăcămintelor de petrol din țară. Crearea unui astfel de combustibil se numește procesul Bergius. Constă în combinația directă de hidrogen și cărbune. Cărbunele este supus încălzirii în condiții de o anumită presiune și prezența hidrogenului. Ca rezultat, se formează un produs de tip lichid. Catalizatorii sunt oxizi de fier. Dar uneori sunt folosite și substanțe pe bază de metale precum molibdenul și staniul.
Există o altă modalitate de a obține același combustibil, care se numește procesul Fischer-Tropsch. Este format din două etape. În prima etapă, cărbunele este supus gazificării prin tratarea lui cu interacțiunea vaporilor de apă și O 2 . Această reacție duce la formarea unui amestec de hidrogen și monoxid de carbon. În plus, cu ajutorul catalizatorilor, amestecul rezultat este transferat în starea de combustibil lichid.
Relația dintre aciditate și capacitatea catalitică

Reacția catalitică este un fenomen dependent de proprietățile acide ale catalizatorului însuși. În conformitate cu definiția lui J. Bronsted, un acid este o substanță care poate dona protoni. Un acid puternic își va dona cu ușurință protonul unei baze. G. Lewis a definit un acid ca fiind o substanță capabilă să accepte perechi de electroni din substanțele donatoare și, ca urmare, să formeze o legătură covalentă. Aceste două idei i-au permis omului să determine esența mecanismului de cataliză.
Puterea unui acid este determinată folosind seturi de baze care își pot schimba culoarea datorită adăugării unui proton. Unii agenți catalitici utilizați în industrie se pot comporta ca acizi extrem de puternici. Puterea lor determină rata de protonare și, prin urmare, este o caracteristică foarte importantă.
Activitatea acidă a catalizatorului se datorează capacității sale de a reacționa cu hidrocarburile, formând astfel un produs intermediar - ionul carbeniu.
Procesul de dehidrogenare
Dehidrogenarea este, de asemenea, o reacție catalitică. Este adesea folosit în diverse industrii. În ciuda faptului că procesele catalitice bazate pe dehidrogenare sunt utilizate mai puțin frecvent decât reacțiile de hidrogenare, ele ocupă totuși un loc important în activitatea umană. Un exemplu de acest tip de reacție catalitică este producerea de stiren, un monomer important. Pentru început, dehidrogenarea etilbenzenului are loc cu participarea substanțelor care conțin oxid de fier. Omul folosește adesea acest fenomen pentru a dehidrogena mulți alcani.
dubla actiune

Există catalizatori cu dublă acțiune capabili să accelereze două tipuri de reacții simultan. Ca urmare, acestea conduc la rezultate mai bune, în comparație cu trecerea reactanților la rândul lor prin 2 reactoare care conțin un singur tip de catalizator. Acest lucru se datorează faptului că locul activ al acceleratorului cu dublă acțiune este într-o poziție apropiată cu un alt loc similar, precum și cu produsul intermediar. Un rezultat bun se obține, de exemplu, prin combinarea catalizatorilor care activează hidrogenul cu o substanță care permite procesul de izomerizare a hidrocarburilor să continue. Activarea este adesea efectuată de metale, iar izomerizarea are loc cu participarea acizilor.
Specificitatea principalelor reacții catalitice
Capacitatea și eficiența catalizatorului sunt, de asemenea, determinate de proprietățile sale de bază. Un exemplu izbitor este hidroxidul de sodiu, care este folosit în timpul hidrolizei grăsimilor pentru a produce săpun. Aceste tipuri de catalizatori sunt, de asemenea, utilizate în producția de spumă și foi de poliuretan. Uretanul se obține în timpul interacțiunii dintre alcool și izocianat. Accelerarea reacției are loc atunci când este expus la o anumită amină bazică. Baza este atașată de atomul de carbon conținut în molecula de izocianat. Ca rezultat, atomul de azot devine încărcat negativ. Acest lucru duce la o creștere a activității în raport cu alcoolul.
Polimerizare stereospecifică

De o mare importanță istorică în istoria studiului catalizei este descoperirea polimerizării olefinelor urmată de producerea de substanțe polimerice stereoregulate. Descoperirea catalizatorilor, care se caracterizează prin polimerizare stereospecifică, aparține lui K. Ziegler. Lucrările lui Ziegler privind producția de polimeri au atras interesul lui J. Natta, care a sugerat că unicitatea polimerului ar trebui să fie determinată de stereoregularitatea acestuia. Un număr mare de experimente care implică raze X supuse difracției au demonstrat că polimerul obținut din propilenă sub influența unui catalizator Ziegler este foarte cristalin. Efectul acțiunii este de natură stereoregulată.
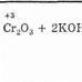
Reacțiile de acest tip au loc pe planul unui catalizator solid care conține metale de tranziție, cum ar fi Ti, Cr, V, Zr. Ele trebuie să fie în oxidare incompletă. Ecuația pentru reacția catalitică dintre TiCl4 care interacționează și Al(C2H5)3, în timpul căreia se formează un precipitat, este un exemplu viu în acest sens. Aici, titanul este redus la o stare 3-valentă. Acest tip de sistem activ face posibilă polimerizarea propilenei în condiții normale de temperatură și presiune.
Oxidarea într-o reacție catalitică
Reacțiile de oxidare catalitică sunt utilizate pe scară largă de către om, datorită capacității anumitor substanțe de a regla viteza reacției în sine. Unele aplicații necesită oxidare completă, cum ar fi neutralizarea contaminanților care conțin CO și hidrocarburi. Cu toate acestea, marea majoritate a reacțiilor necesită oxidare incompletă. Acest lucru este necesar pentru a obține produse valoroase din punct de vedere industrial, dar intermediare, care pot conține un grup intermediar specific și important: COOH, CN, CHO, C-CO. În acest caz, o persoană folosește atât tipuri eterogene, cât și monogeni de catalizatori.
Dintre toate substanțele capabile să accelereze cursul reacțiilor chimice, un loc important este acordat oxizilor. Mai ales în stare solidă. Cursul de oxidare este împărțit în 2 etape. În prima etapă, oxidul de oxigen este captat de molecula de hidrocarbură a oxidului adsorbit. Ca rezultat, oxidul este redus și hidrocarbura este oxidată. Oxidul reînnoit interacționează cu O 2 și revine la starea inițială.
Un număr mare de enzime deja la începutul secolului al XX-lea au pus întrebări cercetătorilor cu privire la nomenclatura și clasificarea enzimelor. O trăsătură distinctivă a enzimei la începutul secolului al XX-lea a fost terminația „aza”, care a fost folosită adăugându-l mai întâi la numele substratului (amil - amidon - amilază) și apoi la numele reacției ( dehidrogenare – dehidrogenază). Comisia pentru Enzime (CE), creată de Uniunea Internațională a Chimiștilor și Biochimiștilor, a dezvoltat principiile de bază pentru clasificarea și nomenclatura enzimelor, care au fost adoptate în 1961. Clasificarea s-a bazat pe tipul de reacție catalizată de enzimă. Toate enzimele pe această bază au fost împărțite în 6 clase, fiecare dintre ele având mai multe subclase.
1. Oxidorreductaza - enzime care catalizează reacţiile de reducere sau oxidare. Un exemplu este alcool dehidrogenaza, o enzimă care oxidează alcoolul etilic în acetaldehidă. O a doua enzimă cunoscută sub numele de aldehid dehidrogenază transformă apoi acetaldehida în acetil CoA. Oxidoreductazele necesită adesea participarea cofactorilor care acționează ca acceptori intermediari de hidrogen în exemplul de mai jos, acesta este NAD + .
 Oxidaze - tip de oxidoreductază. Acesta este numele dat enzimelor care folosesc oxigenul ca acceptor final de hidrogen. Un exemplu este glucoza oxidaza, care oxidează glucoza la acid gluconic. .
FAD servește ca acceptor intermediar de hidrogen.
Oxidaze - tip de oxidoreductază. Acesta este numele dat enzimelor care folosesc oxigenul ca acceptor final de hidrogen. Un exemplu este glucoza oxidaza, care oxidează glucoza la acid gluconic. .
FAD servește ca acceptor intermediar de hidrogen.
2. Transferaze - enzime care transferă grupări funcționale de la o moleculă donor la o moleculă acceptor. Un exemplu sunt metiltransferazele, care transferă o grupare metil de la S-adenosilmetionină la un acceptor. Mai jos este prezentată o reacție catalizată de catecol-O-metiltransferaza, o enzimă implicată în metabolismul neurotransmițătorilor epinefrină și norepinefrină. .

Un alt exemplu foarte important de transferaze sunt enzimele care catalizează transferul grupării amino a α-transaminazei.
Transaminazele folosesc un aminoacid ca donor de grupă amino, pe care îl transferă într-un α-cetoacid, transformând aminoacidul donor în α-cetoacid și, respectiv, cetoacidul acceptor într-un aminoacid. Acesta este folosit pentru a interconversia anumiți aminoacizi și pentru a permite aminoacizilor să intre în căile carbohidraților sau lipidelor.
Transferazele care vor fi adesea menționate în biochimie sunt kinazele care catalizează transferul de fosfat de la o moleculă de ATP de mare energie la un substrat. Există multe kinaze care joacă un rol important în metabolismul celular.
3. Hidrolaze-enzime care catalizează reacţiile biologice de hidroliză. Ele rup legăturile covalente. atașarea elementelor de apă în punctul de rupere. Lipazele, fosfatazele, acetilcolinesteraza și proteazele sunt toate exemple de enzime hidrolitice.
4. Liaze (desmolaze)- enzime care catalizează ruperea legăturilor C-C, C-O și C-N în mod nehidrolitic cu formarea de legături duble. Un exemplu ar fi enzima DOPA decarboxilaza, care este o enzimă cheie în sinteza aminelor biogene epinefrina și norepinefrina.

5. Izomeraze- enzime care catalizează rearanjamente intramoleculare. În acest caz, are loc interconversia izomerilor optici geometrici și poziționali. Epimerazele și racemazele sunt exemple ale acestei clase de enzime.
6. Ligaze catalizează formarea legăturilor C-O, C-S, C-N sau C-C folosind energia hidrolizei ATP. Fosfatul se poate lega sau nu covalent la produsul de reacție.
Comisia Enzimatică a propus, de asemenea, principii pentru nomenclatura enzimelor. Se recomandă utilizarea nomenclaturii sistematice și de lucru. Nomenclatura sistematică se bazează pe același principiu ca și pentru clasificare - tipul de reacție catalizată. La prima vedere, numele devin greoaie, dar din nume devine clar ce face enzima. Numele constă din două părți: numele participanților la reacție (în funcție de clasă, acestea pot fi substraturi, acceptori intermediari) și tipul de reacție catalizată cu terminația „aza”.
Fiecare enzimă primește un anumit număr de cod al enzimei, care reflectă poziția sa în clasificare: prima cifră caracterizează clasa de enzime, a doua o subclasă și a treia subsubclasă. Fiecare sub-subclasă este o listă de enzime. Numărul de secvență al enzimei din această listă este a patra cifră a codului. Figura 1-1 prezintă codul pentru creatinfosfokinaza - CP.2.7.3.2. Această enzimă catalizează reacția de fosforilare a creatinei. Numele sistematic pentru enzima ATP este creatin fosfotransferaza. Numele de lucru al acestei enzime este creatin kinaza sau creatinfokinaza.
R  este 2-1. Codul creatin fosfokinazei și locul enzimei în clasificarea enzimelor
este 2-1. Codul creatin fosfokinazei și locul enzimei în clasificarea enzimelor
Viteza reacțiilor chimice poate crește dramatic în prezența diferitelor substanțe care nu sunt reactanți și nu fac parte din produșii de reacție. Acest fenomen remarcabil se numește cataliză(din grecescul „katalysis” – distrugere). O substanță care crește viteza unei reacții într-un amestec se numește catalizator. Cantitatea sa înainte și după reacție rămâne neschimbată. Catalizatorii nu reprezintă nicio clasă specială de substanțe. În diferite reacții, metalele, oxizii, acizii, sărurile și compușii complecși pot prezenta un efect catalitic. Reacțiile chimice din celulele vii au loc sub controlul proteinelor catalitice numite enzime. Cataliza trebuie considerată ca un adevărat factor chimic în creșterea vitezei reacțiilor chimice, deoarece catalizatorul este direct implicat în reacție. Cataliza este adesea mai puternică și mai puțin riscantă în accelerarea unei reacții decât creșterea temperaturii. Acest lucru se manifestă în mod clar în exemplul reacțiilor chimice din organismele vii. Reacțiile, cum ar fi hidroliza proteinelor, care în laboratoare trebuie efectuate cu încălzire prelungită până la punctul de fierbere, în procesul de digestie se desfășoară fără încălzire la temperatura corpului.
Pentru prima dată, fenomenul de cataliză a fost observat de chimistul francez L. J. Tenard (1777-1857) în 1818. El a descoperit că oxizii anumitor metale, când se adaugă peroxid de hidrogen într-o soluție, provoacă descompunerea acesteia. O astfel de experiență este ușor de reprodus prin adăugarea de cristale de permanganat de potasiu la o soluție de peroxid de hidrogen 3%. Sarea KMp0 4 se transformă în Mn0 2, iar oxigenul este eliberat rapid din soluție sub acțiunea oxidului:
Efectul direct al catalizatorului asupra vitezei de reacție este asociat cu o scădere a energiei de activare. La scaderea normala a temperaturii? iar cu 20 kJ/mol crește constanta de viteză de aproximativ 3000 de ori. downgrade E L poate fi mult mai puternic. Cu toate acestea, scăderea energiei de activare este o manifestare externă a acțiunii catalizatorului. Reacția este caracterizată de o anumită valoare E. v care se poate schimba numai dacă reacția în sine se modifică. Oferind aceleași produse, reacția cu participarea substanței adăugate se desfășoară pe o cale diferită, prin diferite etape și cu o energie de activare diferită. Dacă energia de activare este mai mică pe această nouă cale și reacția este în mod corespunzător mai rapidă, atunci spunem că această substanță este un catalizator.
Catalizatorul interacționează cu unul dintre reactanți, formând un compus intermediar. La una dintre etapele ulterioare ale reacției, catalizatorul este regenerat - lasă reacția în forma sa originală. Reactivii, care participă la o reacție catalitică, continuă să interacționeze între ei și pe o cale lentă, fără participarea unui catalizator. Prin urmare, reacțiile catalitice aparțin unei varietăți de reacții complexe numite serie-paralel. Pe fig. 11.8 arată dependența constantei de viteză de concentrația catalizatorului. Graficul de dependență nu trece prin zero, deoarece în absența unui catalizator, reacția nu se oprește.

Orez. 11.8.
constanta observabila k exprimată ca sumă k u+ & k c(k)
Exemplul 11.5. La o temperatură de -500 °C, reacția de oxidare a oxidului de sulf (IV)
care este una dintre etapele producției industriale de acid sulfuric, este foarte lent. O creștere suplimentară a temperaturii este inacceptabilă, deoarece echilibrul se deplasează spre stânga (reacție exotermă) și randamentul produsului scade prea mult. Dar această reacție este accelerată de diverși catalizatori, dintre care unul poate fi oxidul de azot (II). În primul rând, catalizatorul reacţionează cu oxigenul: ![]()
și apoi transferă un atom de oxigen la oxid de sulf (IV):
Astfel, se formează produsul final al reacției și se regenerează catalizatorul. Pentru reacție, a fost deschisă posibilitatea de a curge pe o nouă cale, în care constantele vitezei au crescut semnificativ:

Diagrama de mai jos prezintă ambele căi ale procesului de oxidare a S02. În absența unui catalizator, reacția se desfășoară numai pe calea lentă și, în prezența unui catalizator, de-a lungul ambelor.
Există două tipuri de cataliză - omogenși eterogen.În primul caz, catalizatorul și reactivii formează un sistem omogen sub formă de amestec sau soluție de gaze. Un exemplu de oxidare a oxidului de sulf este cataliza omogenă. Viteza unei reacții catalitice omogene depinde atât de concentrația reactanților, cât și de concentrația catalizatorului.
În cataliza eterogenă, catalizatorul este un solid în formă pură sau pe suport purtător. De exemplu, platina ca catalizator poate fi fixată pe azbest, alumină etc. Moleculele de reactiv sunt adsorbite (absorbite) dintr-un gaz sau soluție în puncte specifice de pe suprafața catalizatorului - centri activi și sunt activate în același timp. După transformarea chimică, moleculele de produs rezultate sunt desorbite de pe suprafața catalizatorului. Actele de transformare a particulelor se repetă la centrele active. Printre alți factori, viteza unei reacții catalitice eterogene depinde de suprafața materialului catalitic.
Cataliza heterogenă este utilizată în special în industrie. Acest lucru se datorează ușurinței efectuării unui proces catalitic continuu cu trecerea unui amestec de reactanți printr-un aparat de contact cu un catalizator.
Catalizatorii acționează selectiv, accelerând un tip foarte specific de reacție sau chiar o singură reacție fără a-i afecta pe alții. Acest lucru face posibilă utilizarea catalizatorilor nu numai pentru a accelera reacțiile, ci și pentru a transforma intenționat materiile prime în produsele dorite. Metanul și apa la 450 ° C pe catalizatorul Fe 2 0 3 sunt transformate în dioxid de carbon și hidrogen:
Aceleași substanțe la 850 °C reacționează pe suprafața nichelului formând monoxid de carbon (II) și hidrogen:

Cataliza aparține acelor domenii ale chimiei în care nu este încă posibil să se facă predicții teoretice precise. Toți catalizatorii industriali pentru prelucrarea produselor petroliere, a gazelor naturale, a producției de amoniac și mulți alții au fost dezvoltați pe baza unor studii experimentale laborioase și îndelungate.
Capacitatea de a controla viteza proceselor chimice este de o importanță inestimabilă în activitatea economică umană. În producția industrială de produse chimice, de obicei este necesară creșterea ratelor proceselor chimice tehnologice, iar în depozitarea produselor este necesară reducerea ratei de descompunere sau expunere la oxigen, apă etc. Substanțe cunoscute care pot încetini reacțiile chimice. Sunt chemați inhibitori, sau catalizatori negativi. Inhibitorii diferă fundamental de catalizatorii reali prin faptul că reacționează cu specii active (radicali liberi) care, dintr-un motiv sau altul, apar într-o substanță sau în mediul acesteia și provoacă reacții valoroase de descompunere și oxidare. Inhibitorii se consumă treptat, punând capăt acțiunii lor protectoare. Cel mai important tip de inhibitori sunt antioxidanții, care protejează diferite materiale de efectele oxigenului.
De asemenea, trebuie amintit ceea ce nu se poate realiza cu ajutorul catalizatorilor. Sunt capabili să accelereze doar reacții spontane. Dacă reacția nu are loc spontan, atunci catalizatorul nu o va putea accelera. De exemplu, niciun catalizator nu poate determina descompunerea apei în hidrogen și oxigen. Acest proces poate fi efectuat numai prin electroliză, în timp ce cheltuiește lucrări electrice.
Catalizatorii pot activa, de asemenea, procese nedorite. În ultimele decenii, a avut loc o distrugere treptată a stratului de ozon al atmosferei la o altitudine de 20-25 km. Se presupune că unele substanțe sunt implicate în degradarea ozonului, de exemplu, hidrocarburile halogenate emise în atmosferă de întreprinderile industriale, precum și utilizate în scopuri casnice.
S. I. LEVCHENKOV
CHIMIA FIZICĂ ȘI COLOIDĂ
Rezumat al prelegerilor pentru studenții Facultății de Biologie a Universității Federale de Sud (RSU)
2.3 PROCESE CALITICE
Viteza unei reacții chimice la o anumită temperatură este determinată de viteza de formare a complexului activat, care, la rândul său, depinde de valoarea energiei de activare. În multe reacții chimice, structura complexului activat poate include substanțe care nu sunt reactanți stoichiometric; Evident, în acest caz, se modifică și valoarea energiei de activare a procesului. În cazul prezenței mai multor stări de tranziție, reacția se va desfășura în principal pe calea cu cea mai joasă barieră de activare.
Cataliza este fenomenul de modificare a vitezei unei reacții chimice în prezența unor substanțe a căror stare și cantitate rămân neschimbate după reacție.
Distinge pozitivși negativ cataliză (respectiv, o creștere și o scădere a vitezei de reacție), deși adesea termenul „cataliză” înseamnă doar cataliză pozitivă; cataliză negativă se numește inhibitie.
O substanță care face parte din structura unui complex activat, dar nu este un reactant stoichiometric, se numește catalizator. Toți catalizatorii sunt caracterizați de proprietăți generale precum specificitatea și selectivitatea acțiunii.
Specificitate Catalizatorul constă în capacitatea sa de a accelera doar o reacție sau un grup de reacții de același tip și de a nu afecta viteza altor reacții. De exemplu, multe metale de tranziție (platină, cupru, nichel, fier etc.) sunt catalizatori pentru procesele de hidrogenare; oxidul de aluminiu catalizează reacţiile de hidratare etc.
Selectivitate catalizator - capacitatea de a accelera una dintre reacțiile paralele posibile în condiții date. Datorită acestui fapt, este posibil, folosind diferiți catalizatori, să se obțină produse diferite din aceleași materii prime:
|
: CO + H2 ––> CH3OH |
: C2H5OH -–> C2H4 + H2O |
|
: CO + H2 -–> CH4 + H2O |
: C2H5OH -–> CH3CHO + H2 |
Motivul creșterii vitezei de reacție cu cataliză pozitivă este scăderea energiei de activare atunci când reacția se desfășoară prin complexul activat cu participarea catalizatorului (Fig. 2.8).
Deoarece, conform ecuației lui Arrhenius, constanta de viteză a unei reacții chimice este dependentă exponențial de energia de activare, o scădere a acesteia din urmă determină o creștere semnificativă a constantei de viteză. Într-adevăr, dacă presupunem că factorii pre-exponențiali din ecuația Arrhenius (II.32) pentru reacțiile catalitice și necatalitice sunt apropiați, atunci pentru raportul constantelor de viteză putem scrie:
Dacă ΔE A = –50 kJ/mol, atunci raportul constantelor vitezei va fi de 2,7·10 6 ori (într-adevăr, în practică, o astfel de scădere a E A crește viteza de reacție de aproximativ 10 5 ori).
Trebuie remarcat faptul că prezența unui catalizator nu afectează amploarea modificării potențialului termodinamic ca urmare a procesului și, prin urmare, nici un catalizator nu poate face spontan un proces termodinamic imposibil (a unui proces al cărui ΔG (ΔF) este mai mare decât zero). Catalizatorul nu modifică valoarea constantei de echilibru pentru reacțiile reversibile; efectul catalizatorului în acest caz constă doar în accelerarea realizării unei stări de echilibru.
În funcție de starea de fază a reactanților și a catalizatorului, se disting cataliza omogenă și eterogenă.

Orez. 2.8 Diagrama energetică a unei reacții chimice fără catalizator (1)
şi în prezenţa unui catalizator (2).
2.3.1 Cataliza omogenă.
Cataliza omogenă este o reacție catalitică în care reactanții și catalizatorul sunt în aceeași fază. În cazul proceselor catalitice omogene, catalizatorul formează produse reactive intermediare cu reactivii. Luați în considerare o reacție
A + B ––> C
În prezența unui catalizator, se efectuează două etape rapide, care au ca rezultat formarea particulelor de compus intermediar AA și apoi (prin intermediul complexului activat AVK #) produsul final de reacție cu regenerarea catalizatorului:
A + K ––> AK
AK + V -–> C + K
Un exemplu de astfel de proces este descompunerea acetaldehidei, a cărei energie de activare este E A = 190 kJ/mol:
CH 3 CHO -–> CH 4 + CO
În prezența vaporilor de iod, acest proces se desfășoară în două etape:
CH 3 CHO + I 2 ––> CH 3 I + HI + CO
CH 3 I + HI -–> CH 4 + I 2
Scăderea energiei de activare a acestei reacții în prezența unui catalizator este de 54 kJ/mol; în acest caz, constanta vitezei de reacție crește aproximativ cu un factor de 105. Cel mai comun tip de cataliză omogenă este cataliza acidă, în care ionii de hidrogen H + acționează ca catalizator.
2.3.2 Autocataliza.
Autocataliză- procesul de accelerare catalitică a unei reacții chimice de către unul dintre produșii acesteia. Un exemplu este hidroliza esterilor catalizați de ioni de hidrogen. Acidul format în timpul hidrolizei se disociază cu formarea de protoni, care accelerează reacția de hidroliză. O caracteristică a reacției autocatalitice este că această reacție are loc cu o creștere constantă a concentrației catalizatorului. Prin urmare, în perioada inițială a reacției, viteza acesteia crește, iar în etapele ulterioare, ca urmare a scăderii concentrației de reactivi, viteza începe să scadă; curba cinetică a produsului unei reacții autocatalitice are o formă caracteristică în formă de S (fig. 2.9).

Orez. 2.9 Curba cinetică a produsului de reacție autocatalitică
2.3.3 Cataliza eterogenă.
cataliză eterogenă - reacţii catalitice care au loc la interfaţa dintre fazele formate de catalizator şi reactanţi. Mecanismul proceselor catalitice eterogene este mult mai complicat decât în cazul catalizei omogene. În fiecare reacție catalitică eterogenă, se pot distinge cel puțin șase etape:
1. Difuzia materiilor prime pe suprafața catalizatorului.
2. Adsorbția materiilor prime la suprafață cu formarea unui compus intermediar:
A + B + K -–> AVK
3. Activarea stării adsorbite (energia necesară pentru aceasta este energia de activare adevărată a procesului):
AVK ––> AVK #
4. Descompunerea complexului activat cu formarea de produși de reacție adsorbiți:
ABK # ––> CDK
5. Desorbția produșilor de reacție de pe suprafața catalizatorului.
СDК ––> С + D + К
6. Difuzia produselor de reacție de pe suprafața catalizatorului.
O caracteristică specifică a proceselor heterocatalitice este capacitatea catalizatorului de a fi promovat și otrăvit.
Promovare– o creștere a activității catalizatorului în prezența unor substanțe care nu sunt ele însele catalizatori ai acestui proces (promotori). De exemplu, pentru o reacție catalizată de nichel metalic
CO + H2 -–> CH4 + H2O
introducerea unei mici impurități de ceriu în catalizatorul de nichel duce la o creștere bruscă a activității catalizatorului.
Otrăvire- o scădere bruscă a activității catalizatorului în prezența anumitor substanțe (așa-numitele otrăvuri catalitice). De exemplu, pentru reacția de sinteză a amoniacului (catalizator - burete de fier), prezența oxigenului sau a compușilor de sulf în amestecul de reacție determină o scădere bruscă a activității catalizatorului de fier; in acelasi timp, capacitatea catalizatorului de a adsorbi substantele initiale scade foarte usor.
Pentru a explica aceste caracteristici ale proceselor catalitice eterogene, G. Taylor a făcut următoarea presupunere: nu întreaga suprafață a catalizatorului este activă catalitic, ci doar unele dintre secțiunile sale - așa-numitele. centre active , care pot fi diferite defecte ale structurii cristaline a catalizatorului (de exemplu, proeminențe sau depresiuni pe suprafața catalizatorului). În prezent, nu există o teorie unificată a catalizei eterogene. Pentru catalizatori metalici, a teoria multipletelor . Principalele prevederi ale teoriei multipletelor sunt următoarele:
1. Centrul activ al catalizatorului este un set de un anumit număr de centre de adsorbție situate pe suprafața catalizatorului în conformitate geometrică cu structura moleculei în curs de transformare.
2. Atunci când moleculele care reacţionează sunt adsorbite pe centrul activ, se formează un complex multiplet, în urma căruia legăturile sunt redistribuite, ducând la formarea produşilor de reacţie.
Teoria multipleților este uneori numită teoria similitudinii geometrice dintre centrul activ și moleculele care reacţionează. Pentru diferite reacții, numărul de centre de adsorbție (fiecare dintre care este identificat cu un atom de metal) în centrul activ este diferit - 2, 3, 4 etc. Astfel de centri activi se numesc respectiv dublet, triplet, cvadruplet etc. (în cazul general, un multiplet, căruia teoria îi datorează numele).
De exemplu, conform teoriei multipletelor, dehidrogenarea alcoolilor monohidroxilici saturați are loc pe un dublet, iar dehidrogenarea ciclohexanului - pe un sextet (Fig. 2.10 - 2.11); Teoria multipletului a făcut posibilă relația dintre activitatea catalitică a metalelor și raza lor atomică.
 Orez. 2.10 Dehidrogenarea alcoolilor pe dublet
Orez. 2.10 Dehidrogenarea alcoolilor pe dublet
 Orez. 2.11 Dehidrogenarea ciclohexanului pe un sextet
Orez. 2.11 Dehidrogenarea ciclohexanului pe un sextet
2.3.4 Cataliza enzimatică.
Cataliza enzimatică - reacții catalitice care au loc cu participarea enzimelor - catalizatori biologici de natură proteică. Cataliza enzimatică are două caracteristici:
1. activitate ridicată , care este cu câteva ordine de mărime mai mare decât activitatea catalizatorilor anorganici, ceea ce se explică printr-o scădere foarte semnificativă a energiei de activare a procesului de către enzime. Deci, constanta de viteză a reacției de descompunere a peroxidului de hidrogen catalizată de ionii Fe 2+ este 56 s -1 ; constanta de viteză a aceleiași reacții catalizată de enzima catalază este 3,5·10 7 , adică. reacția în prezența enzimei decurge de un milion de ori mai rapid (energiile de activare ale proceselor sunt de 42, respectiv 7,1 kJ/mol). Constantele de viteză ale hidrolizei ureei în prezența acidului și a ureazei diferă cu treisprezece ordine de mărime, în valoare de 7,4·10 -7 și 5·10 6 s -1 (energia de activare este de 103, respectiv 28 kJ/mol).
2. Specificitate ridicată . De exemplu, amilaza catalizează descompunerea amidonului, care este un lanț de unități identice de glucoză, dar nu catalizează hidroliza zaharozei, a cărei moleculă este compusă din fragmente de glucoză și fructoză.
Conform ideilor general acceptate despre mecanismul catalizei enzimatice, substratul S și enzima F sunt în echilibru cu un complex enzimă-substrat FS format foarte rapid, care se descompune relativ lent până la produsul de reacție P cu eliberarea enzimei libere; astfel, etapa de descompunere a complexului enzimă-substrat în produși de reacție este determinantă (limitatoare) de viteză.
F+S<––>FS ––> F+P
Studiul dependenței vitezei reacției enzimatice de concentrația substratului la o concentrație constantă a enzimei a arătat că, odată cu creșterea concentrației substratului, viteza de reacție crește mai întâi și apoi încetează să se schimbe (Fig. 2.12), iar dependența vitezei de reacție de concentrația substratului este descrisă de următoarea ecuație:
 (II.45)
(II.45)