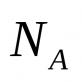Obținerea de fenol. Structura, proprietățile și aplicarea fenolului. Caracteristicile generale ale fenolilor Metode de obţinere a fenolului
Există un, doi, trei fenoli atomici în funcție de numărul de grupări OH din moleculă (Fig. 1)
Orez. unu. FENOLI SINGURI, DOI ȘI TRIATOMICI
În conformitate cu numărul de cicluri aromatice condensate din moleculă, există (Fig. 2) fenolii înșiși (un inel aromatic - derivați de benzen), naftoli (2 inele condensate - derivați de naftalenă), antranoli (3 inele condensate - derivați de antracen) și fenantoli (Fig. 2).
Orez. 2. FENOLI MONO-ȘI POLINUCLEARI
Nomenclatura alcoolilor.
Pentru fenoli, denumirile banale care s-au dezvoltat istoric sunt utilizate pe scară largă. Prefixele sunt folosite și în denumirile fenolilor mononucleari substituiți orto-,meta-și pereche -, utilizate în nomenclatura compuşilor aromatici. Pentru compușii mai complecși, atomii care fac parte din ciclurile aromatice sunt numerotați și poziția substituenților este indicată folosind indici digitali (Fig. 3).
Orez. 3. NOMENCLATURA FENOLOR. Grupurile de substituenți și indicii numerici corespunzători sunt evidențiați în culori diferite pentru claritate.
Proprietățile chimice ale fenolilor.
Nucleul benzenului și grupa OH combinate în molecula de fenol se afectează reciproc, crescând semnificativ reactivitatea reciprocă. Gruparea fenil trage perechea de electroni singuri departe de atomul de oxigen din grupa OH (Fig. 4). Ca urmare, sarcina pozitivă parțială a atomului de H din acest grup crește (indicată prin d+), polaritatea legăturii O–H crește, ceea ce se manifestă printr-o creștere a proprietăților acide ale acestui grup. Astfel, în comparație cu alcoolii, fenolii sunt acizi mai puternici. Sarcina negativă parțială (notată cu d–), care trece la gruparea fenil, este concentrată în pozițiile orto-și pereche-(față de grupa OH). Aceste locuri de reacție pot fi atacate de reactivi care tind spre centrii electronegativi, așa-numiții reactivi electrofili („iubitor de electroni”).
Orez. 4. DISTRIBUȚIA DENSIȚII ELECTRONICE ÎN FENOL
Ca urmare, sunt posibile două tipuri de transformări pentru fenoli: înlocuirea unui atom de hidrogen în grupa OH și substituirea nucleului H-atomobenzen. O pereche de electroni ai atomului O, atrași de inelul benzenic, crește rezistența legăturii C–O, astfel încât reacțiile care apar odată cu ruperea acestei legături, care sunt caracteristice alcoolilor, nu sunt tipice pentru fenoli.
1. Reacții de substituție ale atomului de hidrogen din grupa OH. Când fenolii sunt tratați cu alcalii, se formează fenolați (Fig. 5A), reacția catalitică cu alcooli duce la eteri (Fig. 5B), iar ca urmare a reacției cu anhidride sau cloruri acide ale acizilor carboxilici se formează esteri ( Fig. 5C). Când interacționează cu amoniacul (temperatura și presiune crescute), gruparea OH este înlocuită cu NH2, se formează anilină (Fig. 5D), reactivii reducători transformă fenolul în benzen (Fig. 5E)
2. Reacții de substituție a atomilor de hidrogen din ciclul benzenic.
În timpul halogenării, nitrării, sulfonării și alchilării fenolului sunt atacați centrii cu densitate de electroni crescută (Fig. 4), adică. substituirea are loc în principal în orto-și pereche- poziții (fig.6).
Cu o reacție mai profundă, doi și trei atomi de hidrogen sunt înlocuiți în inelul benzenic.
De o importanță deosebită sunt reacțiile de condensare ale fenolilor cu aldehide și cetone, în esență, aceasta este alchilarea, care are loc ușor și în condiții blânde (la 40–50 ° C, mediu apos în prezența catalizatorilor), în timp ce carbonul atomul este sub forma unei grupări metilen CH 2 sau o grupare metilen substituită (CHR sau CR 2) este inserată între două molecule de fenol. O astfel de condensare duce adesea la formarea de produse polimerice (Fig. 7).
Fenolul dihidric (denumirea comercială bisfenol A, Fig. 7) este utilizat ca componentă în producția de rășini epoxidice. Condensarea fenolului cu formaldehida stă la baza producerii de rășini fenol-formaldehidice utilizate pe scară largă (materiale plastice fenolice).
Metode de obţinere a fenolilor.
Fenolii sunt izolați din gudronul de cărbune, precum și din produsele de piroliză ai cărbunelui brun și a lemnului (gudron). Metoda industrială de obţinere a fenolului C 6 H 5 OH propriu-zis se bazează pe oxidarea cumenului de hidrocarbură aromatică (izopropilbenzen) cu oxigenul atmosferic, urmată de descompunerea hidroperoxidului rezultat diluat cu H 2 SO 4 (Fig. 8A). Reacția se desfășoară cu un randament ridicat și este atractivă prin faptul că permite obținerea simultană a două produse valoroase din punct de vedere tehnic - fenol și acetonă. O altă metodă este hidroliza catalitică a benzenilor halogenați (Fig. 8B).
Orez. opt. METODE DE OBTINEREA FENOLULUI
Utilizarea fenolilor.
O soluție de fenol este utilizată ca dezinfectant (acid carbolic). Fenoli diatomici - pirocatecol, resorcinol (Fig. 3), precum și hidrochinonă ( pereche- dihidroxibenzenul) este utilizat ca antiseptice (dezinfectanți antibacterieni), introduși în agenții de tăbăcire pentru piele și blană, ca stabilizatori pentru uleiuri lubrifiante și cauciuc, precum și pentru prelucrarea materialelor fotografice și ca reactivi în chimia analitică.
Sub formă de compuși individuali, fenolii sunt utilizați într-o măsură limitată, dar diferiții lor derivați sunt utilizați pe scară largă. Fenolii servesc ca compuși de pornire pentru producerea diferitelor produse polimerice, cum ar fi rășini fenol-aldehidice (Fig. 7), poliamide și poliepoxizi. Pe baza de fenoli se obțin numeroase medicamente, de exemplu, aspirina, salol, fenolftaleină, în plus, coloranți, parfumuri, plastifianți pentru polimeri și produse de protecție a plantelor.
Mihail Levitsky
În funcție de numărul de grupări hidroxil:
monoatomic; De exemplu:
diatomic; De exemplu:

triatomic; De exemplu:

Există fenoli și o atomitate mai mare.
Cei mai simpli fenoli monoatomici
C 6 H 5 OH - fenol (hidroxibenzen), numele banal este acid carbolic.

Cei mai simpli fenoli dihidric

Structura electronică a moleculei de fenol. Influența reciprocă a atomilor dintr-o moleculă
Gruparea hidroxil -OH (ca și radicalii alchil) este un substituent de primul fel, adică un donor de electroni. Acest lucru se datorează faptului că una dintre perechile de electroni singuri ale atomului de oxigen hidroxil intră în conjugarea p, π cu sistemul π al nucleului benzenic.

Rezultatul acestui lucru este:
O creștere a densității electronilor pe atomii de carbon din pozițiile orto și para ale nucleului benzenic, ceea ce facilitează înlocuirea atomilor de hidrogen în aceste poziții;
O creștere a polarității legăturii O-H, ceea ce duce la o creștere a proprietăților acide ale fenolilor în comparație cu alcoolii.
Spre deosebire de alcooli, fenolii se disociază parțial în soluții apoase în ioni:

adică prezintă proprietăți slab acide.
Proprietăți fizice
Cei mai simpli fenoli în condiții normale sunt substanțe cristaline incolore, cu punct de topire scăzut, cu miros caracteristic. Fenolii sunt puțin solubili în apă, dar ușor solubili în solvenți organici. Sunt substanțe toxice care provoacă arsuri ale pielii.
Proprietăți chimice
I. Reacții care implică gruparea hidroxil (proprietăți acide)

(reacție de neutralizare, spre deosebire de alcooli)

Fenolul este un acid foarte slab, astfel încât fenolații sunt descompuși nu numai de acizi tari, ci chiar și de un acid atât de slab precum carbonicul:

II. Reacții care implică gruparea hidroxil (formarea de esteri și eteri)
Ca și alcoolii, fenolii pot forma eteri și esteri.
Esterii se formează prin interacțiunea fenolului cu anhidride sau cloruri ale acizilor carboxilici (esterificarea directă cu acizi carboxilici este mai dificilă):

Eteri (alchilaril) se formează prin interacțiunea fenolaților cu halogenuri de alchil:

III. Reacții de substituție care implică inelul benzenic

Formarea unui precipitat alb de tribromofenol este uneori privită ca o reacție calitativă la fenol.

IV. Reacții de adiție (hidrogenare)

V. Reacția calitativă cu clorură de fier (III).
Fenoli monoatomici + FeCl 3 (soluție) → Culoare albastru-violet, dispărând la acidificare.
DEFINIȚIE
Fenolii- derivaţi ai hidrocarburilor aromatice, în moleculele cărora grupările hidroxil sunt legate direct de atomii de carbon din ciclul benzenic. Grupa funcțională, ca și alcoolii, este OH.
Fenolul este o substanță cristalină solidă, incoloră, cu punct de topire scăzut, foarte higroscopică, cu miros caracteristic. În aer, fenolul se oxidează, astfel încât cristalele sale capătă inițial o nuanță roz (Fig. 1) și se întunecă și devin mai roșii în timpul depozitării pe termen lung. Este ușor solubil în apă la temperatura camerei, dar se dizolvă rapid și bine la 60 - 70 o C. Fenolul este fuzibil, punctul său de topire este de 43 o C. Otrăvitor.
Orez. 1. Fenol. Aspect.
Obținerea de fenol
La scară industrială, fenolul este obținut din gudron de cărbune. Printre metodele de laborator cele mai des utilizate se numără următoarele:
– hidroliza clorobenzenului
C6H5CI + NaOH→C6H5OH + NaCI (kat = Cu, t0).
— topirea alcalină a sărurilor acizilor arenesulfonici
C6H5SO3Na + 2NaOH → C6H5OH + Na2S03 + H2O (t0).
– metoda cumenului (oxidarea izopropilbenzenului)
C6H5-C (CH3) H-CH3 + O2 → C6H5OH + CH3-C(O)-CH3 (H+, t0).
Proprietățile chimice ale fenolului
Transformările chimice ale fenolului au loc în principal prin scindare:
1) Conexiuni O-N
- interacțiunea cu metalele
2C6H5OH + 2Na→ 2C6H5ONa + H2.
- interacțiunea cu alcalii
C6H5OH + NaOH → C6H5ONa + H2O.
— interacțiunea cu anhidridele acizilor carboxilici
C6H5-OH + CI-C(O)-O-C(O)-CH3 → C6H5-O-C (O)-CH3 + CH3COOH (t0).
- interacţiunea cu halogenuri de acid carboxilic
C6H5-OH + CI-C(O)-CH3 → C6H5-O-C(O)-CH3 + HCI (t0).
- interacțiune cu FeCl 3 (reacție calitativă la fenol - aspectul unei culori violet care dispare la adăugarea acidului)
6C 6 H 5 OH + FeCl 3 → (C 6 H 5 OH) 3 + 3CI -.
2) conexiuni C sp 2 -H predominant în O- și n-dispoziții
- bromurare
C6H5-OH + 3Br2(aq) →Br3-C6H2-OH↓ + 3HBr.
- nitrarea (formarea acidului picric)
C6H5-OH + 3HONO2 (conc) → (NO2)3-C6H2-OH + 3H2O (H+).
3) un singur nor de electroni de 6π al inelului benzenic
– hidrogenare
C 6 H 5 OH + 3H 2 → C 6 H 11 -OH (kat \u003d Ni, t 0 \u003d 130 - 150, p \u003d 5 - 20 atm).
Aplicarea fenolului
Fenolul este utilizat în cantități mari pentru producerea de coloranți, materiale plastice fenol-formaldehide și substanțe medicinale.
Dintre fenolii diatomici, resorcinolul este folosit în medicină ca antiseptic și ca substanță pentru unele teste clinice, iar hidrochinona și alți fenoli diatomici sunt utilizați ca dezvoltatori în prelucrarea materialelor fotografice.
În medicină, lizolul, care include diverși fenoli, este folosit pentru a dezinfecta încăperile și mobilierul.
Unii fenoli sunt folosiți ca antioxidanți - substanțe care previn alterarea alimentelor în timpul depozitării pe termen lung (grăsimi, uleiuri, concentrate alimentare).
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | O soluţie apoasă conţinând 32,9 g de fenol a fost tratată cu un exces de brom. Calculați masa derivatului brom rezultat. |
| Soluţie | Să scriem ecuația reacției pentru interacțiunea fenolului cu bromul: C6H5OH + 3Br2 → C6H2Br3OH + 3HBr. Ca rezultat al acestei interacțiuni, se formează 2,4,6-tribromofenol. Calculați cantitatea de substanță fenolică (masa molară este de 94 g/mol): n (C6H5OH) \u003d m (C6H5OH) / M (C6H5OH); n (C 6 H 5 OH) \u003d 32,9 / 94 \u003d 0,35 mol. Conform ecuației reacției n(C6H5OH) :n(C6H2Br3OH) = 1:1, adică. n (C 6 H 2 Br 3 OH) \u003d n (C 6 H 5 OH) \u003d 0,35 mol. Apoi masa de 2,4,6-tribromofenol va fi egală cu (masa molară -331 g / mol): m (C 6 H 2 Br 3 OH) \u003d 0,35 × 331 \u003d 115,81 g. |
| Răspuns | Masa derivatului brom rezultat este de 115,81 g. |
EXEMPLUL 2
| Exercițiu | Cum să obțineți fenol din iodobenzen? Calculați masa de fenol care poate fi obținută din 45,9 g de iodobenzen. |
| Soluţie | Scriem ecuația de reacție pentru producerea de fenol din iodobenzen: C6H5I + NaOH → C6H5OH + Nal (kat = Cu, t0). |
Fenolii- derivați ai hidrocarburilor aromatice, care pot include una sau mai multe grupări hidroxil legate la ciclul benzenic.
Cum se numesc fenolii?
Conform regulilor IUPAC, numele " fenol". Numerotarea atomilor provine de la atom, care este direct legat de gruparea hidroxi (dacă este cea mai veche) și sunt numerotați astfel încât substituenții să primească cel mai mic număr.
Reprezentant - fenol - C6H5OH:
Structura fenolului.
Atomul de oxigen are o pereche de electroni neîmpărtășită la nivelul exterior, care este „trasă” în sistemul inelar (+ efect M EL-grupuri). Ca urmare, pot apărea 2 efecte:
1) o creștere a densității electronice a inelului benzenic la pozițiile orto și para. Practic, acest efect se manifestă în reacțiile de substituție electrofilă.
2) densitatea pe atomul de oxigen scade, drept urmare legătura EL slăbit și se poate rupe. Efectul este asociat cu aciditatea crescută a fenolului în comparație cu alcoolii saturați.
Derivați monosubstituiți fenol(crezolul) poate fi în 3 izomeri structurali:

Proprietățile fizice ale fenolilor.
Fenolii sunt substanțe cristaline la temperatura camerei. Puțin solubil în apă rece, dar bine - în soluții calde și apoase de alcalii. Au un miros caracteristic. Datorită formării legăturilor de hidrogen, acestea au un punct de fierbere și de topire ridicat.
Obținerea de fenoli.
1. Din halobenzeni. Când clorbenzenul și hidroxidul de sodiu sunt încălzite sub presiune, se obține fenolat de sodiu, care, după interacțiunea cu acidul, se transformă în fenol:
2. Metoda industrială: în timpul oxidării catalitice a cumenului în aer, se obțin fenol și acetonă:

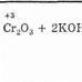
3. Din acizi sulfonici aromatici prin fuziune cu alcalii. Mai des, se efectuează o reacție pentru a obține fenoli polihidroxici:

Proprietățile chimice ale fenolilor.
R-orbital atomului de oxigen formează un singur sistem cu inelul aromatic. Prin urmare, densitatea electronilor pe atomul de oxigen scade, în inelul benzenic crește. Polaritatea comunicării EL crește, iar hidrogenul grupării hidroxil devine mai reactiv și poate fi ușor înlocuit cu un atom de metal chiar și sub acțiunea alcalinelor.
Aciditatea fenolilor este mai mare decât cea a alcoolilor, astfel încât reacțiile pot fi efectuate:
Dar fenolul este un acid slab. Dacă dioxidul de carbon sau dioxidul de sulf este trecut prin sărurile sale, atunci se eliberează fenol, ceea ce demonstrează că acidul carbonic și sulfuros sunt acizi mai puternici:
Proprietățile acide ale fenolilor sunt slăbite prin introducerea substituenților de primul fel în inel și sunt îmbunătățite prin introducerea lui II.
2) Formarea esterilor. Procesul decurge sub influența clorurilor acide:
3) Reacție de substituție electrofilă. pentru că EL-grupa este un substituent de primul fel, apoi reactivitatea inelului benzenic în pozițiile orto și para crește. Sub acțiunea apei de brom asupra fenolului, se observă precipitații - aceasta este o reacție calitativă la fenol:

4) Nitrarea fenolilor. Reacția se efectuează cu un amestec de nitrare, rezultând formarea acidului picric:

5) Policondensarea fenolilor. Reacția se desfășoară sub influența catalizatorilor:

6) Oxidarea fenolilor. Fenolii sunt ușor oxidați de oxigenul atmosferic:

7) O reacție calitativă la fenol este efectul unei soluții de clorură ferică și formarea unui complex violet.
Utilizarea fenolilor.
Fenolii sunt utilizați în producția de rășini fenol-formaldehidice, fibre sintetice, coloranți și medicamente și dezinfectanți. Acidul picric este folosit ca explozivi.
Descrierea prezentării pe diapozitive individuale:
1 tobogan
Descrierea diapozitivului:
2 tobogan
Descrierea diapozitivului:
Scop: Caracterizarea proprietăților fizice și chimice ale fenolului Arătați rolul negativ și pozitiv al fenolului și al derivaților săi în natură și viața umană
3 slide
Descrierea diapozitivului:
Fenol (oxibenzen, acid carbolic învechit) C6H5OH este cel mai simplu reprezentant al clasei de fenoli. Substanță cristalină, incoloră, cu miros caracteristic. Se oxidează ușor în aer, devenind mai întâi roz, apoi maro. Cristale ac de fenol
4 slide
Descrierea diapozitivului:
Clasificarea fenolilor Există un, doi, trei fenoli atomici în funcție de numărul de grupe OH din moleculă:
5 slide
Descrierea diapozitivului:
Metoda de preparare Cumene pentru producerea de fenol (URSS, Sergeev P.G., Udris R.Yu., Kruzhalov B.D., 1949). Avantajele metodei: tehnologie fără deșeuri (randament produse utile > 99%) și economie. Fuziunea sărurilor acizilor sulfonici aromatici cu alcaline solide: C6H5-SO3Na + NaOH t → Na2SO3 + C6H5 - OH Din gudron de cărbune: C6H5ONa + H2SO4 (dif) → C6H5 - OH + NaHSO4 OH+NaCl
6 slide
Descrierea diapozitivului:
Proprietăți fizice Solubil în apă (6 g la 100 g apă), în soluții alcaline, în alcool, în benzen, în acetonă. Fenolul este extrem de toxic și periculos pentru organismul uman.
7 slide
Descrierea diapozitivului:
Structura electronică Gruparea hidroxil -OH este un substituent de primul fel, adică contribuie la creșterea densității electronilor în inelul benzenic (în special în pozițiile orto și para). Acest lucru se datorează faptului că una dintre perechile de electroni singure ale atomului de oxigen din grupa OH intră în conjugare cu sistemul π al inelului benzenic. Deplasarea perechii singure de electroni a atomului de oxigen spre inelul benzenic duce la o creștere a polarității legăturii O-H.
8 slide
Descrierea diapozitivului:
Proprietăți chimice Interacțiune cu sodiul metalic: 2C6H5OH + 2Na 2C6H5ONa + H2 Posedă proprietăți acide slabe, formează săruri - fenolați sub acțiunea alcaline (de exemplu, fenolat de sodiu - C6H5ONa): C6H5OH + NaOH C6H5ONa + H2O Interacțiunea cu bromina calitativă (Interacțiunea cu apa la fenol) : C6H5OH + 3Br2 C6H2Br3OH + 3HBr (formând 2,4,6-tribromofenol solid alb) Reacția cu acid azotic concentrat: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (formând 2,4,6-trinitro) Reacție cu clorură de fier(III) (reacție calitativă pentru fenol): 6C6H5OH + FeCl3 Cl3
9 slide
Descrierea diapozitivului:
Rolul biologic Uleiurile esențiale (au proprietăți bactericide și antivirale puternice, stimulează sistemul imunitar, cresc tensiunea arterială: - anetol în mărar, fenicul, anason - carvacrol și timol în cimbru - eugenol în cuișoare, busuioc Flavonoide (ajută la eliminarea elementelor radioactive din organism). ) Preparate medicinale (purgen, paracetamol) Antiseptice (soluție 3-5% - acid carbolic) Fenolul este unul dintre poluanții industriali Fenolul este destul de toxic pentru animale și oameni Fenolul este dăunător pentru multe microorganisme, de aceea ape uzate industriale cu un conținut ridicat de fenol este dificil de tratat biologic.
10 diapozitive
Descrierea diapozitivului:
Proprietăți toxice Se referă la substanțe foarte periculoase (clasa de pericol II). Când este inhalat, provoacă leziuni ale funcțiilor sistemului nervos. Praful, vaporii și soluția de fenol irită mucoasele ochilor, căilor respiratorii, pielii, provocând arsuri chimice. Ajuns pe piele, fenolul se absoarbe foarte repede chiar si prin zonele intacte si dupa cateva minute incepe sa afecteze tesutul creierului.
11 diapozitiv
Descrierea diapozitivului:
Proprietăți toxice În primul rând, există o excitație pe termen scurt și apoi paralizia centrului respirator. Chiar și atunci când este expus la doze minime de fenol, se observă strănut, tuse, dureri de cap, amețeli, paloare, greață și pierderea forței. Cazurile severe de otrăvire se caracterizează prin inconștiență, cianoză, dificultăți de respirație, insensibilitate a corneei, puls rapid, abia perceptibil, transpirație rece, adesea convulsii.
12 slide
Descrierea diapozitivului:
Impact asupra organismului Când o soluție de fenol ajunge pe piele, apar imediat arsuri chimice severe, transformându-se în ulcere. Dacă un sfert din întreaga suprafață a corpului este arsă prin expunerea la fenol, atunci probabilitatea de deces este aproape de 100%. Ingestia unei substanțe în organism prin tractul gastrointestinal contribuie la dificultatea mișcării, poate provoca sângerări, un ulcer. Doza letală pentru om atunci când este ingerată este de 1-10 g, pentru copii 0,05-0,5 g. În ciuda perioadei de eliminare rapidă din organism (doar o zi), fenolul poate provoca daune ireparabile, iar tratamentul poate dura câțiva ani. Cele mai grave consecințe sunt dezvoltarea cancerului, infertilitatea, problemele cardiace.