Reparația ca mecanism de menținere a homeostaziei genetice Tipuri și mecanisme de reparare. Sisteme de reparare a ADN-ului: o prezentare generală Variante de reparare a ADN-ului
Principiile reparării ADN-ului sunt similare în diferite organisme. O celulă elimină o serie de daune din ADN prin reactivare directă. Astfel, bazele azotate alchilate sunt corectate. Îndepărtarea dimerilor de timină în lumină aparține, de asemenea, aceluiași tip de reparație. Alte tipuri de reparații ale daunelor ADN-ului ultraviolete sunt numite reparație întunecată, pentru a distinge de fotoreactivarea directă.
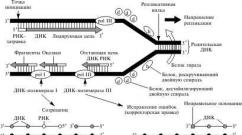
Dacă reactivarea directă nu este posibilă, mecanismele repararea exciziei care elimină regiunile deteriorate din ADN. Cu acest tip de reparare, endonucleazele speciale taie o catenă de ADN în apropierea locului de deteriorare. Apoi, exonucleazele îndepărtează zona deteriorată. Golul rezultat este umplut de ADN polimerază, iar golul rămas este reticulat de ADN ligază. Se poate observa că repararea prin excizie folosește întotdeauna același principiu: regiunea ADN deteriorată este îndepărtată și apoi restaurată pe șablonul catenei de ADN complementare nedeteriorate.
reparație indusă.În condiții care cresc cantitatea de deteriorare a ADN-ului, sunt induse resurse reparatorii suplimentare ale celulei. La bacterii, repararea indusă este utilizată numai atunci când există atât de multe leziuni în ADN încât acesta începe să amenințe celula cu moartea. Prin urmare, se numește sistemul de reparare indusă SOS reparație. Gradul de inducție a sistemului SOS este determinat de cantitatea de deteriorare. Gradul de inducție a sistemului SOS într-un anumit sens reflectă „bunăstarea” celulei și șansele acesteia de supraviețuire. Prin urmare, unii bacteriofagi temperați folosesc inducerea sistemului SOS ca semnal pentru multiplicarea și distrugerea celulei gazdă.
Duplicarea informațiilor în două catene complementare de ADN nu permite corectarea tuturor tipurilor de daune fără eroare. Mecanismele de reparare descrise nu pot face față unei astfel de daune aduse structurii ADN-ului, cum ar fi legăturile încrucișate intercatenare covalente, care pot apărea sub acțiunea unui număr de mutageni sau rupturi duble catenare ale ADN-ului. O astfel de deteriorare poate fi reparată numai în prezența unei molecule de ADN omoloage intacte, de exemplu. prin recombinare.
7608 0
Sub regenerare implică restaurarea de către un țesut, organ a unei structuri specializate pierdute sau deteriorate.
Regenerarea fiziologică constă în actualizarea proprietăților morfologice și funcționale ale unui țesut sau organ folosind mecanisme naturale, de exemplu, formarea de noi și resorbția osteonilor vechi și uzați în os.
La regenerare reparatorie există un proces de formare a unor noi structuri la locul deteriorării sau rănirii. Ca o ilustrare, putem cita procesul de fractură a oaselor tubulare lungi. Procesele de regenerare celulară reparatoare, care constau în formarea de țesut la locul morții elementelor deteriorate, sunt în mare măsură reglementate de condiții mecanice. În special, deformarea materialului regenerat, cum ar fi întinderea, din cauza instabilității, poate stimula atât formarea calusului, cât și resorbția osoasă în zona suprafețelor de contact. Dacă are loc resorbția, atunci instabilitatea în zona de fractură crește. Creșterea deformației regenerate, de exemplu, cu utilizarea dispozitivelor de compresie-distracție pentru osteosinteză, poate duce la o diferențiere treptată a celulelor stromale în direcția creșterii rezistenței și rigidității acestora. Deci, țesutul moale de granulație, care poate rezista la deformări semnificative, este înlocuit cu țesut conjunctiv, care are o rigiditate mai mare, dar o rezistență mai mică la deformare. Acest proces este adesea denumit vindecare „indirectă”. Dacă golul de fractură este mic și fragmentele osoase sunt bine stabilizate prin compresie interfragmentară, atunci deformarea se manifestă minim. În acest caz, apare adesea formarea osoasă directă, iar resorbția osoasă și formarea calusului periostal nu sunt întotdeauna necesare. Acest tip de vindecare a fracturilor se numește „direct” (de contact).
După igienizarea focarului de inflamație din corpurile microbiene și străine, mecanismele care au loc cu participarea limfocitelor și macrofagelor sunt pornite. Limfocitele secretă IL-2 și TNF, care activează monocitele din sânge, care trec prin stadiul de amorsare în țesuturi și se transformă în macrofage activate. Aceste celule, la rândul lor, secretă factori de creștere precum FGF, factor de creștere derivat din trombocite, IL-6 în țesutul din jur, care afectează osteoblastele, fibroblastele și celulele endoteliale. Fibroblastele se divid și, pe măsură ce se maturizează, încep să secrete componente ale matricei extracelulare (proteoglicani, glicozaminoglicani, fibronectină, adezine etc.), inclusiv colagen. Macrofagele controlează fibrilogeneza producând, dacă este necesar, enzimele colagenaza și elastaza. Trebuie remarcat faptul că funcționarea optimă a majorității izoformelor acestor enzime se află într-un mediu neutru, de exemplu. când toate produsele acide aflate în focarul inflamației au fost deja îndepărtate sau neutralizate. În plus, macrofagele prin secreția de prostaglandine și FGF, FGF și alți factori pot stimula sau suprima funcția fibroblastelor, afectând astfel volumul de țesut nou (Ketlitsky, 1995; Serov și colab., 1995).
În paralel, procesele de angiogeneză sunt activate. În același timp, macrofagele, așa cum ar fi, străpung tunelurile din matricea extracelulară, în care migrează celulele endoteliale. În acest caz, apar noi capilare, care cresc, se transformă în vase mai mari, se ramifică și pătrund în noul țesut (Mayansky, Ursov, 1997). Acest proces seamănă într-o oarecare măsură cu mecanismul creșterii apoziționale a țesutului osos sau cu formarea calusului în fracturi, în care poate fi urmărită aceeași, aparent, secvența biologică generală a evenimentelor.
Ca urmare a vindecării rănilor, se formează un țesut nou, care înlocuiește într-o oarecare măsură funcția structurilor deteriorate. Din păcate, nu toată inflamația se termină într-un astfel de rezultat. În unele cazuri, apare cu formarea diferitelor defecte, țesut cicatricial grosier, trece în stadiul cronic, include mecanisme autoimune și scleroza (calcificarea) țesuturilor.
A.V. Karpov, V.P. Şahhov
Sisteme de fixare externă și mecanisme de reglare a biomecanicii optime
Istoria descoperirilor
Leziuni ale ADN-ului monocatenar și dublu
Surse de deteriorare a ADN-ului
- radiații UV
- Substanțe chimice
- erori de replicare a ADN-ului
- Apurinizare - scindarea bazelor azotate din coloana vertebrală zahăr-fosfat
- Dezaminarea - scindarea unei grupări amino dintr-o bază azotată
Principalele tipuri de leziuni ale ADN-ului
- Lezarea unui singur nucleotide
- Deteriorarea unei perechi de nucleotide
- Ruperea lanțului ADN
- Formarea de legături încrucișate între bazele aceleiași catene sau ale diferitelor catene de ADN
Dispozitivul sistemului de reparare
Fiecare dintre sistemele de reparare include următoarele componente:
- o enzimă care „recunoaște” secțiuni modificate chimic din lanțul ADN și rupe lanțul în apropierea daunei
- o enzimă care îndepărtează zona deteriorată
- o enzimă (ADN polimeraza) care sintetizează secțiunea corespunzătoare a lanțului ADN pentru a o înlocui pe cea eliminată
- o enzimă (ADN ligază) care închide ultima legătură din lanțul polimeric și, prin urmare, îi restabilește continuitatea
Tipuri de reparații
Reparație de excizie
reparatie exciziala precizie- excizia) include îndepărtarea bazelor azotate deteriorate din ADN și restabilirea ulterioară a structurii normale a moleculei.
Note
Fundația Wikimedia. 2010 .
Vedeți ce înseamnă „Reparație (biologie)” în alte dicționare:
Un sistem pentru detectarea și repararea inserțiilor, golurilor și nepotrivirilor nucleotidelor care apar în timpul replicării și recombinării ADN-ului, precum și ca urmare a unor tipuri de deteriorare a ADN-ului Însuși faptul de nepotrivire nu permite ... ... Wikipedia
Acest termen are alte semnificații, vezi Reparație. Repararea cromozomilor deteriorați este o funcție specială a celulelor, care constă în capacitatea de a corecta daune chimice și rupturi în moleculele de ADN deteriorate în condiții normale ... ... Wikipedia
Biologia radiațiilor sau radiobiologia este o știință care studiază efectul radiațiilor ionizante și neionizante asupra obiectelor biologice. Cod științific conform clasificării UNESCO din 4 cifre (engleză) 2418 (secțiunea biologie). Radiobiologie ... Wikipedia
I Genetica (din greacă. origine genesis) este știința legilor eredității și a variabilității organismelor. Cea mai importantă sarcină a lui G. este dezvoltarea metodelor de gestionare a eredității și variabilității ereditare pentru a obține formele necesare unei persoane ... ... Marea Enciclopedie Sovietică
Specializare: Biologie celulară Periodicitate: lunar Nume prescurtat: Nat. celulă. Biol. Limba: engleză Editor-șef: Saumya Suominata ... Wikipedia
Mutageneza este introducerea de modificări în secvența de nucleotide a ADN-ului (mutații). Există mutageneza naturală (spontană) și artificială (indusă). Cuprins 1 Mutageneză naturală ... Wikipedia
Biologia radiațiilor sau radiobiologia este o știință independentă, complexă, fundamentală, constând din multe domenii științifice, care studiază efectul radiațiilor ionizante și neionizante asupra obiectelor biologice. Cod științific din 4 cifre... Wikipedia
Halobacterii, tulpina NRC 1, fiecare celulă de aproximativ 5 µm lungime... Wikipedia
Repararea ADN-ului
Informatii generale
Agenți care dăunează ADN-ului
Radiația
1. radiații ionizante (raze gamma, raze X)
2. Radiația ultravioletă (în special ~260 nm, în această regiune are loc absorbția maximă a ADN-ului)
Radicali reactivi de oxigen produși în timpul respirației celulare normale în diferite căi biochimice.
Produse chimice de mediu.
multe hidrocarburi.
Substanțe chimice utilizate în chimioterapia anticanceroasă.
Tipuri de leziuni ale ADN-ului
1. Toate cele patru baze din ADN (A, T, C, G) pot fi modificate covalent în diferite poziții.
Cea mai frecventă este pierderea grupării amino (deminare) - în acest caz, C se transformă în U.
Încorporarea incorectă a bazei care apare din cauza erorilor în funcționarea ADN polimerazelor în timpul replicării.
Cel mai adesea, uracil este inclus în loc de timină.
Încălcări ale structurii.
Pot apărea rupturi în ADN. Rupele pot fi monocatenar sau ambele catenele de ADN se pot rupe.
Radiațiile ionizante pot fi o cauză comună a unor astfel de rupturi.
O legătură covalentă poate fi formată între baze adiacente, iar legătura poate fi formată între baze adiacente din aceeași catenă sau între două catene de ADN.
tipuri de leziuni ale ADN-ului
o schimbare de bază
apurinizare
schimbare de la s la y
substituirea lui A cu hipoxantina
alchilarea bazei
inserarea sau deleția unei nucleotide
înglobând o bază similară
schimbarea a doua baze
formarea dimerului de timină
reticulare cu un agent de alchilare bifuncţional
ruperea lanțului
radiatii ionizante
distrugerea radioactivă a elementelor de bază
legături încrucișate
între bazele unui fir sau a două fire paralele
între ADN și moleculele de proteine, cum ar fi histonele
Repararea bazelor deteriorate
Bazele deteriorate pot fi reparate în diferite moduri:
Reparație directă a daunelor chimice.
Reparație prin excizie (ER), în care baza deteriorată este îndepărtată și înlocuită cu una nouă. Există trei modele de reparații prin excizie, fiecare folosind propriul set de enzime.
Repararea exciziei bazei (BER).
Repararea exciziei nucleotidelor (NER).
Repararea nepotrivirii (MMR).
Repararea daunelor directe.
Cea mai frecventă cauză a mutațiilor punctiforme la om este adăugarea spontană a unei grupări metil, un tip de alchilare. Astfel de modificări sunt corectate de enzime numite glicozilaze, care corectează eroarea fără a distruge catena de ADN.
Unele medicamente utilizate în chimioterapie dăunează și ADN-ului prin alchilare.
Problema reparării este că, cu un set limitat de enzime și mecanisme, celula trebuie să facă față multor daune cauzate de o mare varietate de agenți chimici și fizici.
Repararea exciziei bazei (BER)
Principalele evenimente cheie:
1. Îndepărtarea bazei deteriorate (apare de ~20.000 de ori pe zi în fiecare celulă a corpului uman) ADN glicozilamină. Oamenii au cel puțin 8 gene care codifică diverse ADN glicozilaze, fiecare dintre acestea recunoscând un set diferit de leziuni de bază.
2. Îndepărtarea dezoxiribofosfatului duce la formarea unui gol în ADN.
3. Înlocuire cu nucleotida corectă. Această funcție la om este îndeplinită de betta ADN polimeraza.
4. Ligarea ruperii lanțului. Există două enzime, ambele necesită ATP.
Repararea prin excizie a nucleotidelor (NER)
NER diferă de BER în mai multe moduri.
Utilizarea diferitelor sisteme enzimatice.
Chiar dacă eroarea este într-o singură nucleotidă, multe nucleotide sunt îndepărtate simultan în zona de deteriorare.
Principalele evenimente cheie ale NER:
1. Daunele sunt recunoscute de unul sau mai mulți factori asociați cu locul deteriorării.
2. ADN-ul se derulează la locul deteriorării. Acest proces presupune
diverși factori de transcripție IIH, TFIIH, (care funcționează și în transcripția normală).
3. Tăierea ADN-ului are loc de la capetele de 3" și 5" ale leziunii, în urma căreia fragmentul de ADN care conține nucleotida deteriorată este îndepărtat.
4. O nouă catenă de ADN este completată conform șablonului unei catene de ADN intacte de către polimeraze delta sau epsilon.
5. Ligazele reticulă capătul nou sintetizat al lanțului.
Xerodermie pigmentară (XP)
XP este o boală umană ereditară rară care provoacă leziuni ale pielii atunci când este expusă la lumină, ceea ce duce în cele din urmă la dezvoltarea cancerului de piele și la moartea pacientului.
Boala apare din cauza mutațiilor la nivelul genelor implicate în repararea NER. De exemplu:
XPA codifică o proteină care se leagă de locul leziunii și ajută la asamblarea complexului de reparare.
XPB și XPD, care fac parte din factorul de transcripție TFIIH. Anumite mutații ale XPB și XPD pot fi, de asemenea, responsabile de îmbătrânirea prematură.
XPF taie catena de ADN la capătul de 5" al daunei.
XPG taie lanțul la capătul de 3".
Reparație nepotrivire (MMR)
Repararea nepotrivirii corectează bazele intacte încorporate eronat care nu formează o pereche Watson-Crick normală (AT, C G). Astfel de erori apar în timpul funcționării ADN polimerazei în timpul replicării.
Repararea nepotrivirii implică enzime implicate atât în repararea BER, cât și în repararea NER, precum și enzime specializate.
Sinteza ADN-ului în timpul reparării nepotrivirii este efectuată de polimerazele ADN delta sau epsilon.
Sistemul de reparare a nepotrivirii este implicat în creșterea preciziei recombinării în timpul meiozei.
Repararea ruperii ADN-ului
Radiațiile ionizante și unele substanțe chimice pot rupe una sau două fire de ADN.
Rupere cu un singur fir (SSB)
Rupele uneia dintre catenele de ADN sunt adesea reparate de enzimele implicate în repararea BER.
Rupere duble ale catenei (DSB)
Există două mecanisme care sunt capabile să elimine rupturile ADN-ului dublu catenar:
Conectarea directă a capetelor rupte. Acest proces necesită special
enzime care recunosc și leagă capetele rupte cu cusăturile ulterioare. Dacă ADN-ul rupt are capete contondente și conexiunea a două fragmente de ADN are loc întâmplător, atunci o astfel de reparație se numește NHEJ. Proteina Ku este esențială pentru NHEJ. Ku este o subunitate heterodimerică formată din două proteine Ku70 și Ku80.
Erorile care apar în timpul atașării directe pot fi cauza translocațiilor.
Polinucleotidă ligază- restaurat. un singur lanț ADN-ul se rupe
Recombinare omologa
Recombinarea omologă este capabilă să repare capetele rupte ale cromozomilor folosind ADN-ul din cromatida soră intactă disponibilă după duplicarea cromozomilor.
Genele necesare pentru recombinarea omoloagă sunt BRCA-1 și BRCA-2.
conversia genelor
Donatorul noii gene poate fi:
cromozom omolog (în timpul meiozei)
cromatidă soră (și în timpul meiozei)
genă duplicată pe același cromozom (în timpul mitozei)
Corectarea erorilor datorate activității exonucleazei 3’-5’ a polimerazei în timpul replicării (numai la procariote) (mutația subunității E. coli mutD-mutD-change-ADN-pol.III)
Dimeri de timină, gena enzimei fotoliază-phr (la eucariotele inferioare)
Îndepărtarea grupărilor alchil și metil atașate - O-6-metilguanin transferaza (gena ada) - elimină O-6-metilguanina
excizial r. baze [E.coli] [man | recunoașterea daunelor. Proteina XPA în asociere cu RPA | implicat f-r transkr. TFIIH (activitate P52, P34, P44, P62, XPB-XPD-helicaza) | ERCC1-XPF, XPG - nucleaze, taie ADN-ul pe ambele părți ale leziunii. | ADN polimerază și auxiliare. proteinele RFC și PCNA umple golul]
R. baze azotate.-glicozilaza elimină bazică.
Sit AP (apurinic, apirimidină) | AP-endonucleaza recunoaște un gol, o tăietură. 5'-ADN
postreplicativ r. (PRP)
SOS-r. proteine comp. cu ADN polimerază, fiică. ADN-ul se acumulează împotriva daunelor. ADN
Abrevieri.
BER - Reparație prin excizie de bază
NER - Repararea exciziei nucleotidelor
MMR - Reparație nepotrivire
NHEJ - Îmbinare la capăt neomolog
repararea nepotrivirii
În timpul replicării, ca urmare a erorilor de polimerază, pot fi inserate nucleotide necomplementare, ceea ce poate duce la mutații în catena ADN fiică. Bazele nepereche sunt recunoscute de enzimele de reparare a nepotrivirii și efectuează înlocuirea nucleotidelor nepotrivite.
Enzimele acestui sistem asigură recombinarea omoloagă, precum și întârzierea ciclului celular ca răspuns la deteriorarea ADN-ului.
Sistemul de reparare a nepotrivirii E. coli, care utilizează proteine MutHLS, recunoaște și repară toate perechile de baze non-complementare, cu excepția C-C. În plus, acest sistem repara micile inserții într-una dintre catenele de ADN rezultate din erori de replicare, a căror lungime nu depășește patru nucleotide.
În mod normal, ADN-ul de E. coli este metilat Dam-metilază pe site-uri GATC. Cu toate acestea, după ce replicarea este finalizată, catena fiică a ADN-ului rămâne nemetilată pentru o perioadă de timp.
Acest sistem poate fi reconstruit in vitro folosind
ADN cu o singură catenă metilată ca substrat, la care se adaugă proteinele purificate MutH, MutL, MutS, UvrD (helicaza II), holoenzima ADN polimeraza III, ADN ligaza, proteina SSB și una dintre exonucleaze: ExoI, ExoVII sau RecJ . Procesul de reparare este inițiat prin introducerea unei rupturi cu o singură catenă în catena nemetilată în apropierea situsului GATC parțial metilat, urmată de hidroliza catenei de ADN și completarea golului monocatenar rezultat. În acest caz, proteina MutS se leagă de nucleotide nepotrivite. Proteina MutL nu are activitate enzimatică, deși interacționează cu MutS și este necesară pentru activarea MutH, o endonuclează care efectuează rupturi de ADN monocatenar. Astfel, complexul MutS-MutL asamblat la locul ADN cu o nucleotidă nepotrivită stimulează activitatea endonucleazei (nickază) a MutH. Sistemul fără celule nu necesită prezența MutH în prezența unei ruperi cu o singură catenă în substratul ADN. Sistemul de reparații MutHLS poate
utilizați secvențe GATC parțial metilate situate deasupra și sub regiunea ADN deteriorată. În același timp, în
excizia nucleotidei introduse eronat, pe lângă helicaza II, ia parte una dintre exonucleaze: ExoI (3'-exo), ExoVII (3'- şi 5'-exo) sau RecJ (5'-exo), în funcţie de pe locația situsului GATC în raport cu nucleotida corectată. După excizia nucleotidei, golul monocatenar rezultat este umplut cu holoenzima ADN polimeraza III în prezența proteinei SSB și ADN ligazei. Trebuie subliniat faptul că utilizarea proteinei MutH și a metilazei Dam pentru a recunoaște catena fiică a ADN-ului replicat este o proprietate unică a bacteriilor Gram-negative. Bacteriile Gram-pozitive nu metilează catenele de ADN în scopuri de etichetare. Dacă situsurile GATC sunt complet metilate, sistemul de reparare MutHLS de E. coli modifică nucleotidele nepotrivite în ambele catene de ADN cu eficiență egală.
E. coli are cel puțin două mai specifice
Căile de reparare a nucleotidelor nepotrivite. Sistemul VSP (very short patchrepair pathway) repară perechile G–T non-complementare, înlocuindu-le cu G–C. Se crede că astfel de perechi sunt formate ca rezultat al dezaminării 5-metilcitozinei la locurile în care reziduurile C sunt metilate de către Dcm-metilază. Cu o eficiență mai mică, același sistem înlocuiește perechile G–U cu G–C. Un alt sistem de reparare dependent de MutY inversează în mod specific efectele daunelor oxidative ale guaninei. Dacă dGTP este oxidat pentru a forma 8-oxo-dGTP, proteina MutT scindează pe acesta din urmă, împiedicând-o să fie încorporată în ADN. Dacă totuși activează restul opus C, atunci Fpg glicozilaza (MutM) îndepărtează această bază modificată. În cazul în care 8-oxo-G rămâne în ADN, se împerechează cu A în următoarea rundă de replicare și, ca rezultat, poate avea loc transversia G–C>T–A. În acest caz, proteina MutY acționează ca o ADN glicozilază, îndepărtând reziduul A din perechea incorectă și ca o liază AP, introducând o monocatenar.
pauză în vecinătatea site-ului AP. Următoarele sunt procesele deja discutate mai sus în legătură cu funcționarea sistemului de reparații BER. Secvența de reacții care implică MutY repară, de asemenea, perechile A-G și A-C necomplementare pentru a forma perechi C-G și, respectiv, G-C. Repararea bazelor nepotrivite la eucariote are loc atunci când
participarea unui complex de proteine similar sistemului de bacterii MutHLS. Proteina GTBP umană este un omolog al proteinei bacteriene MutS, în timp ce în drojdie, proteina Msh6 joacă rolul corespunzător. Recunoașterea nucleotidelor nepotrivite la om este efectuată de heterodimerul MSH2-GTBP. Omologii MutL din celulele S. cerevisiae sunt proteinele MLH1 și PMS2, care există și ca complexe heterodimerice. Mutațiile genelor care codifică aceste proteine la oameni sunt însoțite de formarea unui fenotip mutator și de dezvoltarea cancerului de colon ereditar nonpolipoz (sindrom HNPCC).
Reparație directă
Există două căi principale pentru repararea bazelor alchil: repararea prin excizie a bazei (BER) și repararea directă a bazelor deteriorate. În timpul BER, ADN glicozilazele scindează bazele alchilate citotoxice din ADN la prima etapă cu formarea situsului AP și prelucrarea ulterioară a acestuia.În cazul reparării directe se implementează două metode: repararea prin alchil transferaze sau oxidarea grupării alchil, în ambele cazuri are loc regenerarea bazelor intacte. Dacă repararea are loc prin alchiltransferaze (la mamifere, numai O 6 -alchilguanina este reparată pe această cale), atunci O 6 -alchilguanin transferaza (AGT) transferă o grupare metil sau etil de la O 6 -alchilguanină la unul dintre propriile reziduuri de cisteină. . Proteina alchilată ca urmare a propriei sale activități este inactivată, dar poate servi ca un regulator al activității propriei sale gene și a altora. Spre deosebire de O 6-metilguanin transferazele suicidare, care demetilează substanțele extrem de mutagene și toxice
deteriorarea O6-metilguaninei, AlkB din E. coli și analogii săi umani hABH2 și hABH3 oxidează grupările metil 1-metiladenină (1-meA) și 3-metilcitozină (3-meC) din ADN pentru a regenera bazele adenină și citozină nemodificate.
O 6-alchilguanin transferaza
Activitatea O6-alchilguaninei transferazei se găsește în majoritatea organismelor și previne acțiunea mutagenă a O6-alchilguaninei. AGT transformă O 6-alchilguanina în guanină prin transferul unei grupări alchil din ADN într-un reziduu reactiv de cisteină din proteină într-o reacție ireversibilă.
Această atașare covalentă a unei grupări alchil la un reziduu de cisteină inactivează enzima. Prin urmare, AGT este o enzimă suicidară care suferă degradare proteolitică după una
reacții de transalchilare. Studiile structurale arată că situsul activ AGT este situat în volumul enzimei la o anumită distanță de locul de legare a ADN-ului. Se crede că enzima „funcționează” printr-un mecanism de „întorsătură de nucleotide” pentru a aduce baza substratului aproape de situsul activ nucleofil al AGT.
Importanța AGT în protejarea mamiferelor de efectele toxice și mutagene ale agenților de alchilare a fost demonstrată la șoareci. Șoarecii transgenici care supraexprimă AGT prezintă o rată semnificativ mai mică de tumorigeneză ca răspuns la acțiunea agentului de metilare, N-metil-N-nitrozureea, în timp ce șoarecii cu deficit de AGT au fost mult mai sensibili la inițierea tumorii și la efectele toxice ale acestui agent. la soareci salbatici. AGT este o enzimă importantă în terapia antitumorală, deoarece interferează cu efectele citotoxice ale agenților antitumorali din clasa cloroetilnitrozureei (CENU), de ex.
BCNU (N,N-bis(2-cloretil)N-nitrozuree) sau temozolomidă. S-a demonstrat că cantitatea în care AGT este prezentă în tumori determină în principal cât de favorabil va fi rezultatul terapiei antitumorale folosind CENU. CENU reacţionează iniţial cu gruparea carbonil O 6 a guaninei pentru a forma compusul 4
, care este ulterior transformată în N1,O6-etanoguanină 5
. Compus 5
se regrupează în câteva ore într-un ICL activ fiziologic 6
. AGT interferează cu educația 6
atunci când interacționează cu 4
sau 5
, reînnoind guanina sau formând un aduct ADN-protein 8
. Confirmarea experimentală a formării aductului 8
, dar a fost izolat într-o cantitate prea mică pentru descrierea sa detaliată. Într-un studiu biochimic al acestei probleme, a fost introdusă N1,O6-etanoxantina
9
ca analog stabil 5
în ADN. Etanoxantina 9
reacţionează cu AGT pentru a forma un aduct stabil ADN-proteină 7
. Această abordare a permis formarea unui aduct AGT-ADN legat covalent 10
în cantități mari, care pot fi utilizate pentru a determina structura AGT asociată cu ADN-ul. Interacțiunea dintre AGT și terapia de alchilare a condus la căutarea inhibitorilor de AGT care pot fi utilizați în terapia cancerului în combinație cu agenți de alchilare. Până în prezent, au fost creaţi inhibitori, în principal derivaţi de guanină cu substituenţi în poziţia O6. O 6 -benzilguanină 2
s-a dovedit a fi un inhibitor tipic de AGT cu care sunt comparate noi molecule. Eficacitatea O6-BzG în creșterea citotoxicității CENU a fost demonstrată pe modele animale. Factorul limitativ al acestei abordări terapeutice este toxicitatea pentru organele sănătoase, parțial pentru măduva osoasă. niste
Un grup de oameni de știință își propune să ocolească această problemă prin generarea unei variante ATG care este rezistentă la inhibarea O 6 -BzG, care poate fi folosită pentru a proteja măduva osoasă prin transfer de gene.

oxidoreductazele AlkB, hABH2 și hABH3
O altă modalitate de reparare directă a bazelor alchil este oxidarea grupării alchil cu regenerarea bazei azotate intacte. Enzima AlkB a lui Escherichia coli și doi analogi umani, hABH2 și hABH3, demetilează 1-metiladenină și 3-metilcitozină în ADN într-o manieră țintită. Dar, spre deosebire de AGT, aceste enzime au specificitate de substrat direcționată către suprafața perechilor de baze G:C și A:T. Deteriorarea 1-alchiladeninei
și 3-metilcitozină se formează atunci când adenina și citozina sunt într-o structură cu o singură catenă (în timpul replicării sau transcripției) și sunt substraturi pentru AlkB, hABH2 și hABH3. Ele oxidează grupările metil ale 1-metiladeninei (1-meA) și 3-metilcitozinei (3-meC) din ADN pentru a regenera bazele azotate ale adeninei și citozinei. De asemenea, s-a demonstrat că AlkB protejează împotriva daunelor toxice - un aduct cu o grupare etil și transformă 1-etiladenina în adenină în ADN, care produce acetaldehidă ca urmare a reacției. În acest fel, este reparată deteriorarea cunoscutului mutagen și cancerigen de etilenă oxid, care se formează endogen în timpul metabolismului etilenei și este, de asemenea, utilizat pe scară largă ca fumigant pentru sterilizare. Aductii de hidroxietil generați de oxidul de etilenă se găsesc în ADN-ul celular. Alți epoxizi alchilanți mici sunt, de asemenea, utilizați în cantități mari în industria chimică. S-a demonstrat că AlkB reduce efectele toxice ale agenților dăunători ADN-ului care generează hidroxietil,
aducti de propil și hidroxipropil. AlkB repară trifosfații 1-me-dATP alchilați în mod activ, dar ineficient. S-a presupus că această capacitate poate reduce nivelul de încorporare a alchil trifosfaților în timpul sintezei ADN; în plus, fragmentul Klenow al ADN polimerazei I din E. coli poate folosi 1-me-dATP ca precursor pentru sinteza ADN in vitro. Enzimele umane hABH2 și hABH3 au demetilat și resturile de 1-metiladenină în poli(dA) și au fost ineficiente pe substraturi scurte. Astfel, hABH3 a avut activitate foarte scăzută asupra trimerului d(Tp1-meApT), în timp ce nu a fost găsită activitate pe hABH2.
AlkB și analogii săi umani fac parte din superfamilia dependentă de α-cetoglutarat/Fe(II) a dioxigenazelor, iar în timpul procesului de reparare, decarboxilarea β-cetoglutaratului și demetilarea oxidativă a bazei deteriorate au loc împreună. Leziunile 1-meA și 3-meC se formează în principal în ADN monocatenar și probabil
apar la bifurcația de replicare și în genele transcrise activ unde pot bloca ADN și ARN polimeraze. Într-adevăr, AlkB, hABH2 și hABH3 repară aceste leziuni în ADN-ul monocatenar, dar oligonucleotidele recoapte la catena complementară după alchilare repară și ele. Eficiența reparației 1-metiladeninei AlkB nu depinde de structura polinucleotidei, dar este necesară prezența unei grupări nucleotide-5"-fosfat. De asemenea, enzimele umane hABH2 și hABH3 demetilate resturile de 1-metiladenină în poli(dA), au fost ineficiente pe substraturi scurte.În plus, leziunile încărcate pozitiv (ribonucleozide 1-meA, respectiv 3-meC, pKa = 9,3 și 9,6) au fost mai bine reparate decât bazele neîncărcate (1-meG și 3-meT).grad 3-meT. ) au fost reparate de AlkB, atunci sarcina pozitivă formală a bazei nu este o condiție necesară pentru funcționarea AlkB.
nu este clar dacă acest rezultat se datorează faptului că bazele încărcate pozitiv sunt mai bine recunoscute prin interacțiuni electrostatice cu AlkB sau dacă bazele încărcate pozitiv pur și simplu fac din ADN o grupare mai bună după hidroxilarea grupării metil.
Abrevieri:
- AGT - alchilguanin transferaza
- BER - repararea exciziei bazei
- ADN - acid dezoxiribonucleic
- ARN - acid ribonucleic
- BCNU - N,N-bis(2-cloretil)N-nitrozouree
- CENU - cloroetilnitrozouree
- O6-BzG-O6-benzilguanină
- 1-meA - 1-metiladenină
- 1-meG-1-metilguanină
- 3-meC - 3-metilcitozină
- 3-meT - 3-metiltimină
Literatură:
» Orlando D. Scharer (2003) Angew. Chim. Int. Ed. 42, 2946-2974
» James C. Delaney și John M. Essigmann Mutageneză, genotoxicitate și reparare a 1-metiladeninei, 3-alchilcitozinelor, 1-metilguaninei și 3-metiltiminei în alkB Escherichia coli
» Pertti Koivisto, Tod Duncan, Tomas Lindahl și Barbara Sedgwick Substrat metilat minim și gamă extinsă de substrat de proteină AlkB de Escherichia coli, o 1-metiladenin-ADN dioxigenază*
» Duncan, T., Trewick, S. C., Koivisto, P., Bates, P. A., Lindahl, T. & Sedgwick, B. (2002) Proc. Natl. Acad. sci. SUA 99, 16660-16665. 5. Aas, PA, Otterlei, M., Falnes, PO, Vagbo, CB, Skorpen, F., Akbari, M., Sundheim, O., Bjoras, M., Slupphaug, G., Seeberg, E., et. al. (2003) Nature 421, 859-863.
» Hollis, T., Lau, A. şi Ellenberger, T. (2000) Mutat. Res. 460, 201-210
» Daniels, D. S. și Tainer, J. A. (2000) Mutat. Res. 460, 151-163
» Trewick, S. C., Henshaw, T. F., Hausinger, R. P., Lindahl, T. și Sedgwick, B. (2002) Nature 419, 174-178
» Falnes, P. O., Johansen, R. F. și Seeberg, E. (2002) Nature 419, 178-181
» Duncan, T., Trewick, S. C., Koivisto, P., Bates, P. A., Lindahl, T. și Sedgwick, B. (2002) Proc. Natl. Acad. sci. U. S. A. 99, 16660-16665
» Aas, PA, Otterlei, M., Falnes, PO, Vagbo, CB, Skorpen, F., Akbari, M., Sundheim, O., Bjoras, M., Slupphaug, G., Seeberg, E. și Krokan , HE (2003) Nature 421, 859-863
» Aravind, L. și Koonin, E. V. (2001) Genome Biology 2, 0007.1-0007.8
» Bodell, W. J. și Singer, B. (1979) Biochemistry 18, 2860-2863
» Boiteux, S. și Laval, J. (1982) Biochimie (Paris) 64, 637-641
» Larson, K., Sahm, J., Shenkar, R. și Strauss, B. (1985) Mutat. Res. 150, 77-84
» Dinglay, S., Trewick, S. C., Lindahl, T. și Sedgwick, B. (2000) Genes Dev. 14, 2097-2105
Repararea ruperii ADN-ului
Fotoreactivare
Absorbția energiei radiațiilor UV de către moleculele de ADN duce la formarea diferitelor tipuri de daune. Deși pot apărea rupturi simple și duble, precum și legături încrucișate ADN-proteină, majoritatea daunelor induse de UV se datorează modificării bazelor azotate, cu formarea de dimeri de ciclobutan pirimidină (CPD) și pirimidină. -fotoproduse pirimidone (6-4PP), ca fiind cele mai comune tipuri de fotodaune.
Dimerii de pirimidină sunt inhibitori atât ai replicării, cât și ai transcripției, ceea ce întârzie creșterea și duce la mutageneză în timpul replicării ADN-ului dacă o astfel de deteriorare rămâne nereparată.
Enzimele care se leagă în mod specific la CPD (CPD fotoliază) sau 6-4PP (6-4PP fotoliază) și repară aceste daune sunt utilizate pentru a elimina deteriorarea ADN-ului indusă de lumină în multe organisme. Fotoliazele CPD au fost găsite în bacterii, ciuperci, plante, nevertebrate și multe vertebrate, fotoliazele 6-4PP au fost găsite până acum doar la Drosophila, viermi de mătase, Xenopus laevis și șerpi cu clopoței, dar nu și la Escherichia coli sau drojdie. Fotoliaza nu a fost găsită la om. Fotoliazele conțin FAD ca cofactor catalitic și un cromofor suplimentar ca antenă de recoltare a luminii.
Cromoforii suplimentari sunt fie 5,10-meteniltetrahidrofolat (MTHF) fie 8-hidroxi-5-deazoriboflavină (8-HDF), cu maxime de absorbție la 380 și, respectiv, 440 nm. Structurile cristaline ale fotoliazelor E. coli și Anacystis nidulans CPD confirmă faptul că enzimele rotesc dimerul de pirimidină din duplex în godeul care conține cofactorul catalitic pentru a se lega de ADN. Ciclul ciclobutan este apoi scindat prin transfer indus de lumina electronică. Fotoliazele CPD recunosc selectiv CPD, similar proteinelor care leagă ADN-ul. Lumina albă sau radiația UV-B induce expresia fotoliazelor CPD. Spre deosebire de fotoliazele CPD, fotoliaza 6-4PP este exprimată stabil și nu este reglementată nici de lumina albă, nici de radiația UV-B. 
Reprezentarea schematică a fotoreactivării în cromatină. Octamerii Giton sunt albaștri, ADN-ul este negru. Fotoliaza se leagă de dimerii de ciclobutan-pirimidină (CPD), rotește dimerul de pirimidină și regenerează pirimidinele native într-o reacție dependentă de lumină. Fotoliaza repară de preferință CPD în ADN-ul linket. Repararea în nucleozomi este încetinită și probabil facilitată de proprietățile dinamice ale nucleozomilor care mută deteriorarea ADN-ului în regiunea ADN-ului linker.
Clasa fotoliazelor specifice CDP de la microorganisme, definită ca fotoliazele de clasa I, a fost primul membru al familiei fotoliazelor care a fost caracterizat. O clasă strâns înrudită de fotoliaze specifice 6-4-fotoproduselor a fost descoperită recent, membrii acestei familii au fost găsiți în Drosophila melanogaster, Xenopus laevis și Arabidopsis thaliana. Criptocromii, care sunt fotoreceptori pentru partea violetă a spectrului de lumină găsit în plante și alte organisme, sunt, de asemenea, strâns legate de fotoliazele de clasa I.
O familie mai îndepărtată de fotoliaze CPD, numită fotoliaz de clasa II, a fost identificată la un număr de specii, inclusiv animale, Archaebacterium, Eubacterium și plante superioare. S-a demonstrat că toate fotoliazele caracterizate conțin FAD redus și majoritatea conțin cromofori secundari, în funcție de specie, fie MTHF, fie 8-HDF. Un mecanism de reacție similar a fost propus pentru ambele clase de fotoliaze CPD. Cromoforul MTHF sau 8-HDF este ca o antenă care absoarbe lumina violetă și folosește energia absorbită pentru a regenera FADH-.
Compoziția cofactorului de fotoliază din plante nu este pe deplin înțeleasă, deși recent s-a demonstrat că fotoliazele CPD din Arabidopsis care conțineau numai FADH au avut activitate enzimatică.
Literatură:
» Fritz Thoma, Light and dark in chromatin repair: repair of UV-induced DNA leions by photolyase and nucleotid excision repair, Institut fur Zellbiologie, ETH-Zurich, Honggerberg, CH-8093 Zurich, Elveția
» Caracterizarea enzimelor fotoliază Arabidopsis și analiza rolului lor în protecția împotriva radiațiilor ultraviolete-B, Wanda M. Waterworth 1, Qing Jiang, Christopher E. West, M. Nikaido și Clifford M. Bray
Deteriorat în timpul biosintezei normale a ADN-ului în celulă sau ca urmare a expunerii la reactivi fizici sau chimici. Se realizează prin sisteme speciale de enzime ale celulei. O serie de boli ereditare (de exemplu, xeroderma pigmentosum) sunt asociate cu sistemele de reparare afectate.
Istoria descoperirilor
Începutul studiului de reparare a fost pus de munca lui Albert Kellner (SUA), care în 1948 a descoperit fenomenul de fotoreactivare - o scădere a daunelor obiectelor biologice cauzate de razele ultraviolete (UV), cu expunerea ulterioară la lumină vizibilă strălucitoare. ( reparatie usoara).
R. Setlow, K. Rupert (SUA) și alții au stabilit curând că fotoreactivarea este un proces fotochimic care are loc cu participarea unei enzime speciale și duce la scindarea dimerilor de timină formați în ADN la absorbția unui cuantum UV.
Mai târziu, la studierea controlului genetic al sensibilității bacteriene la lumina UV și radiațiile ionizante, a fost descoperit reparație întunecată- proprietatea celulelor de a elimina deteriorarea ADN-ului fără participarea luminii vizibile. Mecanismul de reparare a întunericului celulelor bacteriene iradiate cu lumină UV a fost prezis de A.P. Howard-Flanders și confirmat experimental în 1964 de F. Hanawalt și D. Petitjohn (SUA). S-a demonstrat că în bacterii după iradiere, secțiunile de ADN deteriorate cu nucleotide modificate sunt excizate și ADN-ul este resintetizat în golurile rezultate.
Sistemele de reparare există nu numai în microorganisme, ci și în celulele animale și umane, în care sunt studiate în culturi de țesuturi. Este cunoscută o boală ereditară a unei persoane - xeroderma pigmentosa, în care repararea este perturbată.
Surse de deteriorare a ADN-ului
Principalele tipuri de leziuni ale ADN-ului
Dispozitivul sistemului de reparare
Fiecare dintre sistemele de reparare include următoarele componente:
- ADN helicaza - o enzimă care „recunoaște” secțiunile modificate chimic din lanț și rupe lanțul în apropierea daunei;
- ADNază (dezoxiribonuclează) - enzimă care „taie” 1 lanț de ADN (o secvență de nucleotide) de-a lungul unei legături fosfodiester și îndepărtează o zonă deteriorată: exonucleaza lucrează pe nucleotidele terminale 3` sau 5`, endonucleaza lucrează pe nucleotidele altele decât cele terminale;
- ADN polimerază - o enzimă care sintetizează secțiunea corespunzătoare a lanțului ADN pentru a o înlocui pe cea șters;
- ADN ligaza este o enzimă care închide ultima legătură din lanțul polimeric și, prin urmare, îi restabilește continuitatea.
Tipuri de reparații
Reparație directă
Repararea directă este cea mai simplă modalitate de a elimina deteriorarea ADN-ului, care implică de obicei enzime specifice care pot elimina rapid (de obicei într-o singură etapă) deteriorarea corespunzătoare, restabilind structura nucleotidică inițială. Așa acționează, de exemplu, O6-metilguanină-ADN metiltransferaza, care elimină gruparea metil din baza azotată într-unul dintre propriile reziduuri de cisteină.
Reparație de excizie
Reparația excizională (excizie în engleză - tăiere) include îndepărtarea bazelor azotate deteriorate din ADN și restabilirea ulterioară a structurii normale a moleculei de-a lungul lanțului complementar. Sistemul enzimatic îndepărtează o secvență scurtă monocatenar de ADN dublu catenar care conține baze nepotrivite sau deteriorate și le înlocuiește prin sintetizarea unei secvențe care este complementară catenei rămase.
Repararea prin excizie este cea mai comună metodă de reparare a bazelor ADN modificate. Se bazează pe recunoașterea unei baze modificate de către diferite glicozilaze care scindează legătura N-glicozidică a acestei baze cu coloana vertebrală zahăr-fosfat a moleculei de ADN. În același timp, există glicozilaze care recunosc în mod specific prezența în ADN a anumitor baze modificate (oximetiluracil, hipoxantina, 5-metiluracil, 3-metiladenină, 7-metilguanină etc.). Pentru multe glicozilaze, polimorfismul asociat cu înlocuirea uneia dintre nucleotide din secvența de codificare a genei a fost descris până în prezent. Pentru o serie de izoforme ale acestor enzime, a fost stabilită o asociere cu un risc crescut de boli oncologice [Chen, 2003].