Reacții de adiție nucleofile la mecanismul grupării carbonil. Reacții de adiție nucleofilă (AN) la compuși carbonilici. Oxidarea și reducerea compușilor organici. a) Reacţii cu O-nucleofile
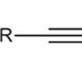
Adăugarea nucleofilă la alchine este inițiată sub influența unei particule încărcate negativ - nucleofil. În general, bazele sunt catalizatorul pentru astfel de reacții. Schema generală a primei etape a reacției de adiție nucleofilă:
Reacții de adiție nucleofile tipice
Un exemplu tipic de reacție de adiție nucleofilă este reacția Favorsky - adăugarea de alcooli în prezența alcaline pentru a forma esteri alchenil:
Aminele primare sub acțiunea bazelor se adaugă la alchine pentru a forma imine:
Prin analogie, acetilena reacționează cu amoniacul pentru a forma etilidenimină:
La temperatură ridicată în prezența unui catalizator, imina se dehidrogenează și se transformă în acetonitril:
Într-un mediu cu baze foarte puternice (de exemplu: KOH + DMSO), acetilena reacţionează cu hidrogenul sulfurat, formând sulfura de divinil:
Reacții de adiție radicală
În prezența peroxizilor sau a altor condiții care favorizează formarea de radicali liberi, adăugarea la alchine se efectuează conform unui mecanism radical - împotriva regulii Markovnikov (efectul Harash):
Conform mecanismului radicalilor liberi*, reacția alchinelor cu tiolii poate avea loc:
* - In prezenta bazelor reactia se desfasoara dupa mecanismul nucleofil.
În mod similar, are loc adăugarea carbenelor:
Reacții de etinizare
Reacțiile de etinizare se numesc reacții de creștere a scheletului de carbon al alchinelor cu păstrarea legăturii triple. Ele pot proceda atât prin mecanisme electrofile, cât și nucleofile, în funcție de mediu și de condițiile de reacție, de natura substratului și de tipul de catalizator utilizat.
Obținerea alcoolilor acetilenici
În prezența bazelor puternice, alchinele cu o legătură triplă terminală sunt capabile să adauge compuși carbonilici pentru a forma alcooli (reacția Favorsky):
Cea mai importantă reacție din acest grup este adăugarea de formaldehidă la acetilenă cu formarea de alcool propargilic și apoi butin-2-diol-1,4 *:
Obținerea de esteri și acizi acetilenici
Acizii acetilenic sau esterii lor pot fi obținuți prin reacția Zuzhi:
Catalizatori: PdCI2, CuCI.
Reacții de hidrogenare
Hidrogenare eterogenă
Hidrogenarea alchinelor cu hidrogen pe catalizatori eterogene, de regulă, duce la formarea cis- conexiuni. Catalizatorii de hidrogenare sunt Ni, Pd, Pt, precum și oxizi sau complecși de Ir, Ru, Rh și alte metale.
În prima etapă, se formează o alchenă, care este aproape imediat hidrogenată într-un alcan:
Pentru a opri reacția în etapa de producere a alchenei, se folosesc catalizatori Lindlar (Pd/PbO/CaCO3) sau borura de nichel.
Când acetilena este hidrogenată pe un catalizator de nichel-cobalt, se poate obține izobutilenă:
Hidrogenare omogenă
Hidrogenarea omogenă se realizează cu amidă de sodiu în amoniac lichid sau hidrură de litiu aluminiu în tetrahidrofuran. In timpul reactiei, transă-alchene.

Hidroborarea
Alchinele adaugă cu ușurință diboran împotriva regulii lui Markovnikov, formând cis-alchenilborani:
sau oxidează H2O2 la o aldehidă sau cetonă.
Reacții de adiție nucleofile - reacții de adiție în care atacul în stadiul inițial este efectuat de un nucleofil - o particulă care este încărcată negativ sau are o pereche de electroni liberi.
În etapa finală, carbanionul rezultat suferă un atac electrofil.
În ciuda caracterului comun al mecanismului, reacțiile de adiție se disting prin legături carbon-carbon și carbon-heteroatom.
Reacțiile de adiție nucleofile sunt mai frecvente pentru legăturile triple decât pentru legăturile duble.
Reacții de adiție nucleofile la legăturile carbon-carbon
Adăugarea nucleofilă cu legături multiple este de obicei un proces Ad N 2 în două etape - o reacție de adiție nucleofilă bimoleculară:
Adăugarea nucleofilă la legătura C=C este destul de rară și, de regulă, dacă compusul conține substituenți atrăgători de electroni. Reacția lui Michael este de cea mai mare importanță în această clasă:
Atașarea la legătura triplă este similară cu atașarea la legătura C=C:

Reacții de adiție nucleofilă la o legătură carbon-heteroatom Adăugarea nucleofilă la o legătură multiplă carbon-heteroatom are mecanismul Ad N 2

De regulă, etapa de limitare a vitezei a procesului este un atac nucleofil, adăugarea electrofilă are loc rapid.
Uneori, produsele de adiție intră într-o reacție de eliminare, dând astfel colectiv o reacție de substituție:
Adăugarea nucleofilă la legătura C=O este foarte comună, ceea ce are o mare importanță practică, industrială și de laborator.
Acilarea cetonelor nesaturate
Această metodă implică tratarea substratului cu un ion aldehidă și cianură într-un solvent aprotic polar, cum ar fi DMF sau Me2SO. Această metodă este aplicabilă cetonelor a,b-nesaturate, esterilor și nitrililor.
Condensarea esterilor cu cetone

Când esterii sunt condensați cu cetone, randamentul de α-dicetonă este scăzut, aproximativ 40%, acest lucru se datorează reacției secundare de autocondensare a esterului.
Hidroliza compușilor nitro (reacția Nef)

Reacția Nef este o reacție de hidroliză acidă a compușilor nitro cu formarea de compuși carbonilici. Descoperit în 1892 de chimistul rus M.I. Konovalov și J. Nef în 1894. Reacția Nef constă în hidroliza formelor acil ale compușilor nitro (acizi nitronici) și, prin urmare, pot intra în ea compuși nitro alifatici și aliciclici primari și secundari.
Reacția Nef face posibilă obținerea de compuși dicarbonil cu un randament de până la 80-85%. Pentru a face acest lucru, reacția se efectuează la pH=1, deoarece într-un mediu mai puțin acid, acizii nitronici izomerizează înapoi într-un compus nitro cu o scădere a conversiei compusului nitro, iar într-un mediu mai acid, formarea de crește produsele secundare. Această reacţie este efectuată la t=0-5°C.
Interacțiunea cetonelor cu clorurile acide în prezența piperidinei

Clorurile acide se reduc cu ușurință la alcooli primari sub acțiunea hidrurii de litiu-aluminiu. Dar dacă enamina obținută din cetonă sub acțiunea piperidinei reacţionează cu cloruri acide, atunci după hidroliza sării obţinute iniţial se formează b-dicetone.
Reacții de adiție nucleofile (reacție-AdN)
Legătura dublă din grupul carbonil este foarte polarizată datorită diferenței mari de electronegativitate dintre oxigen și carbon. Densitatea electronică este deplasată la atomul de oxigen, iar atomul de carbon al grupării carbonil prezintă proprietăți electrofile. Prin urmare, compușii carbonilici sunt caracterizați prin reacții de adăugare a nucleofililor la un atom de carbon cu deficit de electroni.
Etapa limitatoare de viteză a reacției este atacul particulei nucleofile a atomului de carbon electrofil al grupării carbonil, cu formarea unei legături datorită electronilor nucleofilului. În același timp, are loc o scindare heterolitică a legăturii p C=O, care duce la formarea unui ion alcoxid. În acest caz, carbonul carbonil trece în stare sp 3 hibridizare.
Ionul alcoxid este o bază puternică și, prin urmare, este protonat rapid pentru a forma un produs final de adiție neutru.

Dacă un nucleofil azotat (amine, hidroxilamină etc.) reacționează, produsul de adiție neutru rezultat suferă deshidratare pentru a forma o legătură dublă între carbonul carbonil și agentul nucleofil.

Adăugarea nucleofilă la gruparea carbonil este un proces reversibil, cu excepția reacțiilor care au loc cu formarea de alcooli și cu adăugarea de compuși organometalici.
Aldehidele sunt mai reactive în reacțiile adiționale ale reactivilor nucleofili decât cetonele. Acest lucru se datorează absenței obstacolelor sterice pentru ca aldehidele să atace agentul nucleofil. Și în cetone, două grupări alchil creează obstacole sterice pentru ca nucleofilul să atace și să formeze produsul de adiție tetraedric. Reactivitatea scăzută a cetonelor este afectată și de stabilitatea lor termodinamică mai mare în comparație cu aldehidele (căldura de formare a unei cetone este mai mică decât căldura de formare a aldehidei corespunzătoare).
formă protonată
Bazicitatea aldehidelor și cetonelor este scăzută, dar joacă un rol semnificativ în reacțiile de adiție nucleofile, deoarece electrofilitatea atomului de carbon în formă protonată este mult mai mare. Prin urmare, reacțiile AdN tipice aldehidelor și cetonelor pot fi catalizate de acizi.
2.2. Reacții de adiție nucleofile
Interacțiunea aldehidelor și cetonelor cu agenții nucleofili se realizează conform următorului mecanism general:
Nucleofilul Z–H (foarte adesea există un atom de hidrogen la centrul nucleofil) este atașat de atomul de carbon electrofil al grupării carbonil datorită perechii singure de electroni a centrului nucleofil, formând un produs în care fostul oxigen carbonil are o sarcină negativă, iar fostul centru nucleofil este încărcat pozitiv. Acest ion bipolar este stabilizat prin transferul unui proton de la atomul Z încărcat pozitiv (acidul lui Brønsted) la atomul de oxigen încărcat negativ (bază). Produsul rezultat suferă adesea transformări ulterioare, de exemplu, eliminarea apei.
Diferiți compuși pot acționa ca nucleofili, în care atomi de oxigen (O-nucleofili), atomii de sulf (S-nucleofili), azotul (N-nucleofili), atomii de carbon (C-nucleofili) acționează ca centri nucleofili.
Reactivitatea aldehidelor și cetonelor în reacțiile de adiție nucleofile depinde de electrofilitatea car-
http://mitht.ru/e-library

grupare osoasă: cu cât sarcina pozitivă parțială a atomului de carbon este mai mare, cu atât este mai ușor să atașați nucleele.
leophila. Deoarece moleculele de aldehide de la atomul de carbon carbonil conțin un singur reziduu de hidrocarbură care prezintă proprietăți de donare de electroni, iar moleculele de cetone au două astfel de resturi, este firesc să presupunem că, în cazul general, în reacțiile de adiție nucleofile, aldehidele sunt mai reactive decât cetonele. Substituenții atrăgătoare de electroni, în special în apropierea grupării carbonil, cresc electrofilia carbonului carbonil și, prin urmare, cresc reactivitatea. Factorul steric este, de asemenea, de o anumită importanță: deoarece adăugarea atomului de carbon al grupării carbonil modifică hibridizarea (sp2 → sp3), cu cât sunt mai voluminoase substituenții la atomul de carbon carbonil, cu atât dificultățile sterice care apar în timpul acestei tranziții sunt mai mari. . De exemplu, în seria: formaldehidă, acetaldehidă, acetonă, tert-butil metil cetonă, reactivitatea scade.
(CH3)3C |
||||||||||||
a) Reacţii cu O-nucleofile
Hidratarea
Când aldehidele și cetonele interacționează cu apa într-un proces reversibil, se formează un hidrat - diol geminal, care în cele mai multe cazuri este un compus foarte instabil, astfel încât acest echilibru este puternic deplasat spre stânga.
Cu toate acestea, pentru unii compuși carbonilici, acest echilibru poate fi deplasat spre dreapta. Astfel, într-o soluție apoasă, formaldehida este aproape complet în formă hidratată (spre deosebire, de exemplu, de acetonă, în care soluția apoasă are o formă hidratată extrem de mică), iar aldehida tricloracetică (cloral), atunci când interacționează cu apa, se transformă în un hidrat cloral foarte stabil chiar și sub formă cristalină.
CH2 \u003d O H 2 O CH2 (OH) 58 2
http://mitht.ru/e-library

CI3CCH=O + H2OCI3CCH(OH)2
cloral cloral hidrat
Interacțiune cu alcooli (reacție de acetalizare)
Produsul adăugării unei molecule de alcool la o moleculă de aldehidă sau cetonă, așa-numitul hemiacetal, este instabil. Când o aldehidă sau cetonă interacționează cu 2 echivalenți de alcool într-un mediu acid, se formează un produs stabil -
acetal.
Să dăm mecanismul ultimei reacții folosind exemplul interacțiunii acetaldehidei cu alcoolul metilic (1:2) în prezența unui acid Bronsted puternic.
Protonarea grupării carbonil a acetaldehidei duce la formarea unui cation în care sarcina pozitivă este delocalizată. În comparație cu acetaldehida, acest cation este mai electrofil, iar adăugarea nucleofilă a unei molecule de metanol are loc mult mai ușor. Produsul de adiție (cationul oxoniu) este un acid puternic, iar atunci când un proton este îndepărtat din acesta, se formează hemiacetal (1-metoxietanol).
CH3 CH=O H |
||||||
CH3 CH=O |
HOCH3 |
CH3CHOH |
CH3CHOH |
|||
CH3CHOH |
H O CH3 |
OCH3 |
||||
http://mitht.ru/e-library

În plus, prin forma protonată a acestui hemiacetal, apa este separată cu formarea unui carbocation, de care este atașată următoarea moleculă de metanol. La deprotonarea produsului de adiție, acetaldehidă dimetil acetal(1,1-dimetoxietan).
HOCH3 |
|||||||
CH3CHOH |
CH3 CHOH |
CH3CH |
|||||
OCH3 |
OCH3 |
OCH3 |
|||||
CH3CH |
OCH3 |
CH3 CH OCH3 |
|||||
OCH3 |
OCH3 |
||||||
Întregul proces de reacție descris, care se numește acetalizare, este reversibil, prin urmare, este posibil să se efectueze eficient interacțiunea unei aldehide sau cetone cu un alcool la un acetal numai prin deplasarea echilibrului la dreapta, de exemplu, prin îndepărtarea apa rezultată din sfera de reacție. Reacția inversă este hidroliza acidă a acetalului. În consecință, acetalii sunt instabili într-un mediu apos acid, deoarece sunt supuși hidrolizei.
OCH3 + H2O |
CH3CH=O + 2CH3OH |
||||||||
OCH3 |
|||||||||
V acetalii sunt stabili într-un mediu alcalin, de la hidroliză
v aceste condiții nu pot apărea.
b) Reacţii cu S-nucleofile
Atomul de sulf din analogii alcoolilor - tiolii (mercaptanii) - este un nucleofil mai puternic, astfel încât mercaptanii sunt mai ușor atașați de aldehide și cetone. În acest caz, se formează produse similare hemiacetalilor și acetalilor, de exemplu, când benzaldehida reacţionează cu doi echivalenţi de metantiol (metil mercaptan) într-un mediu acid, se formează benzaldehidă dimetiltioacetal.
2CH3SH |
CH(SCH3)2 |
|||||
Sunt derivați ai hidrocarburilor, în moleculele cărora doi atomi de hidrogen, situați la un atom de carbon, sunt înlocuiți cu un atom de oxigen. Gruparea >C=O obţinută în acest fel se numeşte grupare carbonil sau grupare oxo. Dacă gruparea carbonil este legată de un atom de hidrogen și un radical de hidrocarbură (sau de doi atomi de hidrogen), atunci astfel de compuși se numesc aldehide, iar gruparea se numește grupare aldehidă; dacă gruparea carbonil este legată de doi radicali de hidrocarburi, compușii se numesc cetone, iar grupul se numește grup ceto. Astfel, aldehidele și cetonele sunt o clasă de substanțe organice - compuși oxo.
Orbitalii atomici ai carbonului grupării carbonil sunt într-o stare de hibridizare sp 2. Trei orbitali hibrizi situati în același plan la un unghi de » 120 ° unul față de celălalt participă la formarea a trei s- conexiuni. Orbitalul p nehibrid al atomului de carbon, situat perpendicular pe planul în care se află s- legături, participă la formarea unei legături p cu un atom de oxigen. Legătura dublă carbon-oxigen este polară, densitatea electronică este deplasată la atomul de oxigen mai electronegativ, pe care apare o sarcină negativă parțială, iar pe atomul de carbon al grupării carbonil, o sarcină pozitivă parțială:
De aici rezultă că reacția caracteristică grupării carbonil trebuie să fie un atac nucleofil asupra atomului de carbon. În moleculele compușilor carbonilici, pe lângă centrul electrofil - atomul de carbon al grupului oxo - există și alți centre de reacție. Atomul de oxigen, datorita perechii de electroni singuratice, actioneaza ca centru principal in reactii, reactionand cu acizii. Aldehidele și cetonele sunt baze slabe, concentrația formei protonate a compusului carbonil atinge valori \u003e 0,1-1% numai în acid sulfuric 60-80%.
Ca urmare a adăugării unui proton din cauza formării s-legăturile О-Н măresc electrofilitatea atomului de carbon al grupării oxo și facilitează adăugarea unei particule nucleofile.
Hidratarea cetonelor este posibilă numai în prezența acizilor sau alcalinelor ca catalizatori.
Mecanismul reacției de hidratare în cataliză acidă:
În prima etapă, protonul este atașat de atomul de oxigen al grupării carbonil (datorită perechii singure de electroni de oxigen) cu formarea cationului oxoniu, care în etapa următoare se transformă într-un carbocation, care este ușor (datorită la întreaga sarcină pozitivă pe carbon) supusă atacului nucleofil de către o moleculă de apă. Cationul de oxoniu rezultat este stabilizat prin eliminarea protonilor (reciclarea catalizatorului).
Mecanismul reacției de hidratare în cataliză bazică:
Când hidratarea este efectuată într-un mediu alcalin, ionul hidroxid atacă atomul de carbon electrofil al grupării carbonil pentru a forma anionul oxoniu, care este stabilizat în continuare prin eliminarea unui proton dintr-o moleculă de apă.
Spre deosebire de majoritatea compușilor carbonilici, 2,2,2-tricloretanal (cloral) reacționează ușor cu apa, formând un produs stabil de hidratare - hidratul de cloral, utilizat în medicină și medicina veterinară ca sedativ și hipnotic. Reactivitatea crescută a acestui compus se explică prin efectul puternic de atragere de electroni al grupării triclorometil, care crește sarcina pozitivă efectivă asupra atomului de carbon carbonil și, de asemenea, stabilizează produsul de reacție.
Reacții de adiție cu alcool
În prezența acidului clorhidric uscat, aldehidele reacţionează cu alcoolii pentru a forma acetali. În cele mai multe cazuri, hemiacetalele formate intermediar nu pot fi izolate în formă liberă. Trebuie remarcat faptul că conversia hemiacetalilor în acetali nu are loc fără catalizatori acizi.
Conversia aldehidelor în hemiacetali are loc prin mecanismul adiției nucleofile A N , iar conversia ulterioară a hemiacetalului în acetal este o substituție nucleofilă.
Necesitatea de a utiliza cataliză acidă în conversia hemiacetalilor în acetali se datorează faptului că gruparea OH părăsește slab. Pentru a-l transforma într-o grupă scindabilă bună - molecula H 2 O - acizii sunt utilizați ca catalizatori.
În cazul reacțiilor cetonelor cu alcooli, sarcina pozitivă asupra atomului de carbon al grupării carbonil este insuficientă pentru un atac direct al moleculei de alcool, iar cetalii alcoolilor monohidroxilici nu pot fi obținuți în acest mod. Se obțin folosind ortoesteri ai acidului formic.
Reacțiile de formare a hemiacetalilor și acetalilor sunt caracteristice compușilor heteropolifuncționali naturali - carbohidrații. Monozaharidele sunt, de regulă, polihidroxi aldehide sau polihidroxi cetone, în interiorul moleculelor cărora are loc o interacțiune între grupările hidroxil și carbonil, ducând la formarea unui heterociclu:
Formele ciclice ale monozaharidelor sunt hemiacetali ciclici sau hemicetali ciclici. Formarea oligozaharidelor și polizaharidelor este o reacție de formare a acetalului care se repetă de mai multe ori:
Polizaharidele, ca și acetalii, sunt supuse hidrolizei numai în mediu acid.
Adăugarea de mercaptani RSH la aldehide și, respectiv, la cetone duce la formarea de tioacetali. Capacitatea moleculelor de mercaptan de a ataca eficient atomul de carbon al grupului carbonil al cetonelor reflectă tendința mai mare a RSH (comparativ cu ROH) de a forma nucleofili eficienți RS - , adică aciditatea mai mare a tiolilor în comparație cu alcoolii.