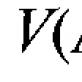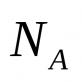Energi dalam dari gas ideal. Derajat kebebasan molekul. Hukum tentang distribusi energi yang seragam pada derajat kebebasan. Jumlah derajat kebebasan molekul. Hukum distribusi energi yang seragam pada derajat kebebasan Jumlah derajat kebebasan molekul nitrogen
Persamaan keadaan sistem termodinamika. persamaan Clapeyron-Mendeleev. Termometer gas ideal. Persamaan dasar teori molekul-kinetik. Distribusi energi yang seragam pada derajat kebebasan molekul. Energi dalam gas ideal. Diameter efektif dan jalur bebas rata-rata molekul gas. Konfirmasi eksperimental teori molekuler-kinetik.
Persamaan keadaan sistem termodinamika menggambarkan hubungan antara parameter sistem . Parameter keadaan adalah tekanan, volume, suhu, jumlah zat. Secara umum, persamaan keadaan adalah ketergantungan fungsional F (p, V, T) = 0.
Untuk sebagian besar gas, seperti yang ditunjukkan oleh pengalaman, pada suhu kamar dan tekanan sekitar 10 5 Pa, Persamaan Mendeleev-Clapeyron :
P– tekanan (Pa), V- volume yang ditempati (m 3), R\u003d 8,31 J / molK - konstanta gas universal, T - suhu (K).
mol zat
- jumlah zat yang mengandung jumlah atom atau molekul sama dengan bilangan Avogadro  (begitu banyak atom yang terkandung dalam 12 g isotop karbon 12 C). Membiarkan M 0 adalah massa satu molekul (atom), n adalah jumlah molekul, maka
(begitu banyak atom yang terkandung dalam 12 g isotop karbon 12 C). Membiarkan M 0 adalah massa satu molekul (atom), n adalah jumlah molekul, maka  - massa gas,
- massa gas,  adalah massa molar zat. Jadi, jumlah mol suatu zat adalah:
adalah massa molar zat. Jadi, jumlah mol suatu zat adalah:
 .
.
Gas yang parameternya memenuhi persamaan Clapeyron-Mendeleev adalah gas ideal. Hidrogen dan helium memiliki sifat yang paling dekat dengan ideal.
Termometer gas ideal.
Termometer gas dengan volume konstan terdiri dari benda termometrik - bagian dari gas ideal yang tertutup dalam bejana, yang dihubungkan ke pengukur tekanan melalui tabung.
Dengan bantuan termometer gas, dimungkinkan untuk secara eksperimental membangun hubungan antara suhu gas dan tekanan gas pada volume tetap tertentu. Keteguhan volume dicapai dengan fakta bahwa dengan gerakan vertikal tabung kiri pengukur tekanan, level di tabung kanannya dibawa ke tanda referensi dan perbedaan ketinggian level cairan di pengukur tekanan adalah diukur. Mempertimbangkan berbagai koreksi (misalnya, ekspansi termal bagian kaca termometer, adsorpsi gas, dll.) memungkinkan untuk mencapai akurasi pengukuran suhu dengan termometer gas volume konstan sama dengan 0,001 K.
Termometer gas memiliki keuntungan bahwa suhu ditentukan dengan bantuan mereka pada kepadatan rendah gas tidak bergantung pada sifatnya, dan skala termometer semacam itu sangat cocok dengan skala suhu absolut yang ditentukan menggunakan termometer gas ideal.
Dengan cara ini, suhu tertentu terkait dengan suhu dalam derajat Celcius dengan hubungan:  KE.
KE.
Kondisi gas normal - keadaan di mana tekanan sama dengan atmosfer normal: R\u003d 101325 Pa10 5 Pa dan suhu T \u003d 273,15 K.
Dari persamaan Mendeleev-Clapeyron berikut bahwa volume 1 mol gas dalam kondisi normal sama dengan:  m 3.
m 3.
Dasar-dasar TIK
Teori kinetik molekuler (MKT) mempertimbangkan sifat termodinamika gas dari sudut pandang struktur molekulnya.
Molekul berada dalam gerakan termal acak konstan, terus bertabrakan satu sama lain. Dengan melakukan itu, mereka bertukar momentum dan energi.
Tekanan gas.
Pertimbangkan model mekanik gas dalam kesetimbangan termodinamika dengan dinding bejana. Molekul secara elastis bertabrakan tidak hanya satu sama lain, tetapi juga dengan dinding bejana tempat gas berada.
Sebagai idealisasi model, kami mengganti atom dalam molekul dengan titik material. Kecepatan semua molekul diasumsikan sama. Kami juga berasumsi bahwa titik material tidak berinteraksi satu sama lain pada jarak tertentu, sehingga energi potensial dari interaksi semacam itu dianggap nol.
P  mulut
mulut
 adalah konsentrasi molekul gas, T adalah suhu gas, kamu adalah kecepatan rata-rata gerak translasi molekul. Kami memilih sistem koordinat sehingga dinding kapal terletak pada bidang XY, dan sumbu Z diarahkan tegak lurus ke dinding di dalam kapal.
adalah konsentrasi molekul gas, T adalah suhu gas, kamu adalah kecepatan rata-rata gerak translasi molekul. Kami memilih sistem koordinat sehingga dinding kapal terletak pada bidang XY, dan sumbu Z diarahkan tegak lurus ke dinding di dalam kapal.
Pertimbangkan dampak molekul pada dinding bejana. Karena Karena tumbukannya elastis, setelah menabrak dinding, momentum molekul berubah arah, tetapi besarnya tidak berubah.
Untuk jangka waktu tertentu T hanya molekul-molekul yang berada pada jarak dari dinding pada jarak tidak lebih dari L= kamuT. Jumlah total molekul dalam silinder dengan luas alas S dan tinggi L, yang volumenya adalah V = LS = kamuTS, sama dengan n = nV = nkamuTS.
Pada titik tertentu dalam ruang, tiga arah gerakan molekul yang berbeda dapat dibedakan secara konvensional, misalnya, sepanjang sumbu X, Y, Z. Sebuah molekul dapat bergerak sepanjang masing-masing arah "maju" dan "mundur".
Oleh karena itu, tidak semua molekul dalam volume yang dipilih akan bergerak menuju dinding, tetapi hanya seperenam dari jumlah totalnya. Oleh karena itu, jumlah molekul yang selama waktu T menabrak dinding, itu akan sama dengan:
n 1 = n/6= nkamuTS/6.
Perubahan momentum molekul saat tumbukan sama dengan impuls gaya yang bekerja pada molekul dari sisi dinding - dengan gaya yang sama, molekul bekerja di dinding:
P Z = P 2 Z – P 1 Z = FT, atau
n 1 M 0 u-( n 1 M 0 kamu)= FT,
2n 1 M 0 u=FT,
 ,
,
 .
.
Di mana kita menemukan tekanan gas di dinding:  ,
,
di mana  - energi kinetik suatu titik material (gerakan translasi molekul). Oleh karena itu, tekanan gas (mekanik) seperti itu sebanding dengan energi kinetik dari gerakan translasi molekul:
- energi kinetik suatu titik material (gerakan translasi molekul). Oleh karena itu, tekanan gas (mekanik) seperti itu sebanding dengan energi kinetik dari gerakan translasi molekul:
 .
.
Persamaan ini disebut persamaan dasar MKT .
Hukum distribusi energi yang seragam pada derajat kebebasan .
DASAR FISIK TERMODINAMIKA
1. Hukum pertama termodinamika
§satu. Energi dalam
Setiap sistem termodinamika dalam keadaan apa pun memiliki energi yang disebut energi total. Energi total sistem adalah jumlah energi kinetik dari gerak sistem secara keseluruhan, energi potensial sistem secara keseluruhan, dan energi internal.
 Energi internal sistem adalah jumlah semua jenis gerakan kacau (termal) molekul: energi potensial dari gerakan intra-atomik dan intra-nuklir. Energi dalam merupakan fungsi dari keadaan gas. Untuk keadaan gas tertentu, energi internal ditentukan secara unik, yaitu, itu adalah fungsi yang pasti.
Energi internal sistem adalah jumlah semua jenis gerakan kacau (termal) molekul: energi potensial dari gerakan intra-atomik dan intra-nuklir. Energi dalam merupakan fungsi dari keadaan gas. Untuk keadaan gas tertentu, energi internal ditentukan secara unik, yaitu, itu adalah fungsi yang pasti.
Selama transisi dari satu keadaan ke keadaan lain, energi internal sistem berubah. Tetapi pada saat yang sama, energi internal dalam keadaan baru tidak bergantung pada proses di mana sistem melewati keadaan ini.
2. Kehangatan dan pekerjaan
Ada dua cara berbeda untuk mengubah energi internal sistem termodinamika. Energi internal suatu sistem dapat berubah sebagai akibat dari melakukan pekerjaan dan sebagai akibat dari perpindahan panas ke sistem. Usaha adalah ukuran perubahan energi mekanik suatu sistem. Saat melakukan pekerjaan, ada pergerakan sistem atau bagian makroskopik individu relatif satu sama lain. Misalnya, dengan menggerakkan piston ke dalam silinder yang berisi gas, kami memampatkan gas, akibatnya suhunya naik, mis. energi internal gas berubah.
Energi internal juga dapat berubah sebagai akibat dari perpindahan panas, yaitu memberikan beberapa panas ke gasQ.
Perbedaan antara panas dan kerja adalah bahwa panas dipindahkan sebagai hasil dari sejumlah proses mikroskopis di mana energi kinetik molekul-molekul benda yang lebih panas selama tumbukan ditransfer ke molekul-molekul benda yang kurang panas.
Apa yang umum antara panas dan kerja adalah bahwa mereka adalah fungsi dari proses, yaitu, kita dapat berbicara tentang jumlah panas dan kerja ketika sistem bertransisi dari keadaan pertama ke keadaan kedua. Panas dan robot bukanlah fungsi keadaan, tidak seperti energi dalam. Tidak mungkin untuk mengatakan apa yang sama dengan kerja dan panas gas di keadaan 1, tetapi orang dapat berbicara tentang energi internal di keadaan 1.
3Sayaawal termodinamika
Mari kita asumsikan bahwa beberapa sistem (gas tertutup dalam silinder di bawah piston), memiliki energi internal, menerima sejumlah panasQ, melewati keadaan baru, yang dicirikan oleh energi internalkamu 2
,
melakukan pekerjaan itu SEBUAH atas lingkungan eksternal, yaitu melawan kekuatan eksternal. Jumlah kalor dianggap positif ketika disuplai ke sistem, dan negatif ketika diambil dari sistem. Usaha positif jika dilakukan oleh gas melawan gaya luar, dan negatif jika dilakukan pada gas.
Sayaawal termodinamika : Jumlah panas (Δ Q ), sistem yang dikomunikasikan pergi untuk meningkatkan energi internal sistem dan untuk melakukan pekerjaan (A) oleh sistem terhadap kekuatan eksternal.
Rekaman Sayaawal termodinamika dalam bentuk diferensial
dU- perubahan yang sangat kecil dalam energi internal sistem
pekerjaan dasar,- jumlah panas yang sangat kecil.
Jika sistem secara berkala kembali ke keadaan semula, maka perubahan energi internalnya adalah nol. Kemudian
yaitu mesin gerak abadiSayajenis, mesin yang beroperasi secara berkala yang akan melakukan lebih banyak pekerjaan daripada energi yang dikomunikasikan kepadanya dari luar tidak mungkin (salah satu formulasinyaSayaawal termodinamika).
2 Jumlah derajat kebebasan molekul. hukum seragam
distribusi energi pada derajat kebebasan molekul
Jumlah derajat kebebasan: sistem mekanis disebut jumlah besaran mandiri, yang dengannya posisi sistem dapat diatur. Gas monoatomik memiliki tiga derajat kebebasan translasisaya = 3, karena tiga koordinat (x, y, z ).
Koneksi yang sulitIkatan disebut ikatan yang jarak antar atomnya tidak berubah. Molekul diatomik dengan ikatan kaku (n 2 , HAI 2 , H2) memiliki 3 derajat kebebasan translasi dan 2 derajat kebebasan rotasi:Saya= Sayacepat + Sayavr=3 + 2=5.
Derajat kebebasan translasi terkait dengan pergerakan molekul secara keseluruhan di ruang angkasa, rotasi - dengan rotasi molekul secara keseluruhan. Rotasi sumbu koordinat relatifx dan z di pojok akan menyebabkan perubahan posisi molekul dalam ruang, selama rotasi terhadap sumbu pada molekul tidak mengubah posisinya, oleh karena itu, koordinat φ kamutidak diperlukan dalam kasus ini. Molekul triatomik dengan ikatan kaku memiliki 6 derajat kebebasan.
Saya= Sayacepat + Sayavr=3 + 3=6
Jika ikatan antar atom tidak kaku, maka vibrasi Dengan derajat kebebasan. Untuk molekul nonlinierSaya hitung . = 3 n - 6 , di mana nadalah jumlah atom dalam molekul.
Terlepas dari jumlah total derajat kebebasan molekul, 3 derajat kebebasan selalu translasi. Tak satu pun dari kekuatan translasi memiliki keunggulan atas yang lain, sehingga masing-masing memiliki energi yang sama rata-rata, sama dengan 1/3 dari nilainya
![]()
Boltzmann menetapkan hukum yang menurutnya untuk sistem statistik (yaitu, untuk sistem di mana jumlah molekulnya besar), yang berada dalam keadaan kesetimbangan termodinamika, untuk setiap derajat kebebasan translasi dan rotasi, ada kinematika rata-rata. energi sama dengan 1/2 kT , dan untuk setiap derajat kebebasan vibrasi - rata-rata, energinya sama dengan kT . Derajat kebebasan vibrasi "memiliki" energi dua kali lebih banyak karena ia tidak hanya memperhitungkan energi kinetik (seperti dalam kasus gerak translasi dan rotasi), tetapi juga untuk energi potensial, danjadi energi rata-rata molekul
Karakteristik penting dari sistem termodinamika adalah energi dalam U adalah energi gerak termal mikropartikel sistem (molekul, atom, elektron, inti, dll.) dan energi interaksi partikel-partikel ini.
Energi dalam - fungsi bernilai tunggal keadaan termodinamika sistem, yaitu di setiap keadaan, sistem memiliki energi internal yang terdefinisi dengan baik (tidak tergantung pada bagaimana sistem mencapai keadaan ini). Ini berarti bahwa selama transisi sistem dari satu keadaan ke keadaan lain, perubahan energi internal hanya ditentukan oleh perbedaan nilai energi internal dari keadaan ini dan tidak tergantung pada jalur transisi.
Kami memperkenalkan konsep jumlah derajat kebebasan i: ini adalah jumlah variabel bebas (koordinat) yang sepenuhnya menentukan posisi sistem dalam ruang. Dalam sejumlah masalah, molekul gas monoatomik dianggap sebagai titik material, yang diberikan tiga derajat kebebasan gerak translasi ( Saya=3). Dalam hal ini, energi gerak rotasi dapat diabaikan.
Dalam mekanika klasik, molekul gas diatomik, dalam pendekatan pertama, dianggap sebagai himpunan dari dua titik material yang dihubungkan secara kaku oleh ikatan yang tidak dapat dideformasi. . Sistem ini, selain tiga derajat kebebasan gerak translasi, memiliki dua derajat kebebasan lagi. gerakan berputar. Rotasi di sekitar sumbu ketiga (sumbu yang melewati kedua atom) tidak ada artinya. Jadi, gas diatomik memiliki lima derajat kebebasan ( Saya=5). Molekul nonlinier triatomik dan poliatomik memiliki enam derajat kebebasan: tiga translasi dan tiga rotasi ( Saya=6).
Secara alami, tidak ada ikatan kaku antara atom. Oleh karena itu, untuk molekul nyata, perlu juga memperhitungkan derajat kebebasan gerakan osilasi.
Untuk setiap derajat gerak translasi, rata-rata ada energi yang sama, sama dengan 1/3 dari nilai<w 0 >:
<w 0 >= . (7.1)
Derajat getaran "memiliki" energi dua kali lebih banyak karena ia tidak hanya menyumbang energi kinetik (seperti dalam kasus gerakan translasi dan rotasi), tetapi juga energi potensial, dan nilai rata-rata energi kinetik dan potensial adalah sama. Jadi, energi rata-rata molekul
di mana Saya adalah jumlah dari jumlah translasi, rotasi, dan dua kali jumlah derajat kebebasan vibrasi molekul.
Karena dalam gas ideal energi potensial timbal balik dari molekul adalah nol (molekul tidak berinteraksi satu sama lain), energi internal per mol gas akan sama dengan jumlah energi kinetik tidak ada molekul.
Sekarang mari kita beralih ke pertimbangan rinci tentang konsep energi internal gas ideal dan hubungan energi ini dengan jumlah derajat kebebasan molekul. Sebelumnya, dalam model gas ideal, kami hanya memperhitungkan energi gerak translasi molekul. Pendekatan ini menggambarkan dengan baik gas monoatomik. Menurut mekanika klasik, bilangan derajat kebebasan molekul monoatomik sama dengan jumlah koordinat yang diperlukan untuk mengatur posisinya dalam ruang. Dalam ruang tiga dimensi kita, jumlah koordinat dan jumlah derajat kebebasan gas monoatomik adalah tiga. Sesuai dengan (9.6), energi kinetik rata-rata dari gerakan translasi molekul, ditentukan melalui kuadrat rata-rata kecepatan v? B, sebanding dengan suhu gas
Pada saat yang sama, dari isotropi ruang (kesamaan semua arah), kuadrat rata-rata dari komponen kecepatan sama dengan v * KB = Vy KB == Vz KB , yang memungkinkan untuk membandingkan setiap koordinat dan setiap derajat kebebasan dengan sepertiga energi kinetik rata-rata dari gerakan translasi molekul. Dengan demikian, kita dapat mengasumsikan bahwa untuk setiap derajat kebebasan ada energi rata-rata
Jika molekul gas tidak monoatomik, tetapi terdiri dari: n atom, maka untuk mengatur posisinya di ruang angkasa diperlukan 3N koordinat. Jadi, sebuah molekul n atom memiliki 3N derajat kebebasan. Karena molekul poliatomik adalah satu kesatuan, akan lebih mudah untuk mempertimbangkan gerakan pusat massanya dengan tiga derajat kebebasan translasi. Dalam hal ini, derajat kebebasan yang tersisa jatuh pada gerakan rotasi dan vibrasi molekul. Mekanika teoretis menyatakan bahwa molekul nonlinier yang terdiri dari tiga atau lebih atom mampu berpartisipasi dalam tiga gerakan rotasi independen di sekitar tiga sumbu koordinat. Rotasi lainnya dapat dianggap sebagai kombinasi dari mereka. Oleh karena itu, jumlah derajat kebebasan rotasi dari molekul nonlinier adalah tiga. Untuk molekul linier dari dua atau lebih atom (berbaris sepanjang satu garis), dengan mempertimbangkan rotasi di sekitar sumbu yang menghubungkan atom, yang dianggap sebagai titik material, tidak berkontribusi pada energi. Oleh karena itu, jumlah derajat kebebasan rotasi dari molekul linier adalah dua. Derajat kebebasan yang tersisa jatuh pada gerak osilasi. Sangat mudah untuk menghitung bahwa jumlah derajat kebebasan vibrasi untuk molekul nonlinier sama dengan 3N-6, dan untuk molekul linier - 3N-5.
Dalam kasus gas poliatomik (juga untuk gas monoatomik), hukum tentang distribusi energi yang seragam pada derajat kebebasan: energi kinetik rata-rata per satu derajat kebebasan molekul pada kesetimbangan termal adalah ~kT.
Energi derajat kebebasan getaran harus diperhitungkan secara khusus. Pada suhu normal dan rendah, gerakan vibrasi molekul biasanya dijelaskan oleh hukum mekanika kuantum. Hukum-hukum ini membenarkan kekakuan molekul dan tidak adanya energi getaran - dalam hal ini, diyakini bahwa derajat kebebasan getaran membeku(hilang). Pada suhu tinggi, pada tingkat kebebasan getaran, selain energi kinetik - kT memiliki energi potensial yang sama, sehingga secara total kita mendapatkan kt.(Ini mengikuti dari model osilator harmonik bahwa energi potensial rata-rata dari gerak osilasi sama dengan energi kinetik rata-rata.)
Jadi, dalam kasus umum, energi internal rata-rata molekul sama dengan
dan energi internal satu mol gas ideal adalah
di mana Saya adalah jumlah derajat kebebasan efektif molekul.
Sebagai berikut dari alasan di atas, untuk molekul monoatomik /=3, untuk molekul linier pada suhu normal dan rendah /=5, untuk molekul nonlinier pada suhu normal dan rendah /=6. Pada suhu tinggi orde 10 3 K untuk molekul linier saya=6N-5, untuk molekul nonlinier saya =6 N-6 .
Kami mencatat bahwa pada suhu yang sangat rendah (dari urutan 10 K) derajat kebebasan rotasi juga membeku. Hal ini disebabkan oleh fakta bahwa hukum mekanika statistik klasik, yang menjadi dasar hukum distribusi energi yang seragam pada derajat kebebasan, berhenti bekerja, dan penerapan hukum mekanika kuantum diperlukan.
Sumber daya digital dapat digunakan untuk mengajar dalam kerangka program sekolah menengah (profil dan tingkat lanjutan).
Model komputer menggambarkan fitur pergerakan molekul. Molekul satu atom, diatomik dan triatomik dipertimbangkan, konsep "derajat kebebasan" diperkenalkan.
Teori singkat
Bekerja dengan model
Model ini dapat digunakan dalam mode peralihan bingkai manual dan dalam mode demonstrasi otomatis (Film).
Model ini dapat digunakan sebagai ilustrasi dalam pembelajaran mempelajari materi baru, pengulangan di kelas 10 dengan topik “Persamaan Dasar Teori Kinetik Molekuler”.
Konsep “derajat kebebasan” cukup sulit dipersepsikan siswa SMA. Model ini memungkinkan kita untuk mendemonstrasikan sifat pergerakan berbagai molekul.
Contoh perencanaan pembelajaran menggunakan model
Topik "Persamaan Dasar Teori Kinetik Molekuler"
Tujuan pelajaran: untuk memperoleh dan menganalisis persamaan dasar MKT.
|
|||||||||||||||||||||||||
|
Tabel 1. |
Contoh soal dan tugas