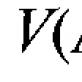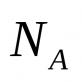Metode analisis titrimetri didasarkan pada penggunaan. Metode penetralan dalam metode analisis titrimetri. Kemajuan pekerjaan
Analisis titrimetri atau volumetrik- metode analisis kuantitatif berdasarkan pengukuran volume (atau massa) reagen T yang digunakan untuk reaksi dengan analit X. Dengan kata lain, analisis titrimetri adalah analisis berdasarkan titrasi.
Tujuan kelas laboratorium tentang metode analisis titrimetri adalah untuk mengembangkan keterampilan praktis dalam teknik melakukan analisis titrimetri dan menguasai metode pemrosesan statistik hasil analisis menggunakan contoh penentuan kuantitatif spesifik, serta untuk mengkonsolidasikan pengetahuan teoretis dengan memecahkan tipikal masalah perhitungan untuk setiap topik.
Pengetahuan tentang teori dan praktik metode analisis titrimetri diperlukan untuk studi selanjutnya tentang metode analisis instrumental, disiplin ilmu kimia dan farmasi khusus lainnya (farmasi, kimia toksikologi, farmakognosi, teknologi farmasi). Metode analisis titrimetri yang dipelajari adalah farmakope dan banyak digunakan dalam praktik apoteker untuk mengontrol kualitas obat.
Konvensi
A, X, T - masing-masing zat, analit dan titran;
m(A), m(X), t(T)- massa zat apa pun, analit dan titran, masing-masing, g;
M(A), M(X), M(T)- massa molar zat apa pun, analit dan titran, masing-masing, g/mol;
n(A), n(X), n(T) - jumlah zat, analit dan titran, masing-masing, mol;
Jumlah zat yang setara dengan zat apa pun, zat yang akan ditentukan dan titran, masing-masing, mol;
 - volume larutan zat apa pun, analit dan titran, masing-masing, l;
- volume larutan zat apa pun, analit dan titran, masing-masing, l;
 - volume alikuot analit, sama dengan kapasitas pipet, l;
- volume alikuot analit, sama dengan kapasitas pipet, l;
 - volume larutan analit yang dianalisis, sama dengan kapasitas labu, l.
- volume larutan analit yang dianalisis, sama dengan kapasitas labu, l.
1. Konsep dasar titrimetri
analisis
1.1. Titrasi- proses penentuan zat X dengan penambahan bertahap sejumlah kecil zat T, di mana, dalam beberapa cara, deteksi titik (momen) ketika semua zat X telah bereaksi disediakan. Titrasi memungkinkan Anda untuk menemukan jumlah zat X dari jumlah zat T yang diketahui ditambahkan hingga titik (momen) ini, dengan mempertimbangkan fakta bahwa rasio di mana X dan T bereaksi diketahui dari stoikiometri atau sebaliknya.
1.2. titran- larutan yang mengandung reagen aktif T, yang dengannya titrasi dilakukan. Titrasi biasanya dilakukan dengan menambahkan titran dari buret terkalibrasi ke dalam labu titrasi yang berisi larutan yang akan dianalisis. Ke dalam labu ini sebelum titrasi tambahkan alikuot solusi yang dianalisis.
1.3. Pembagian alikuot (alikuot)- bagian yang diketahui dengan tepat dari solusi yang dianalisis, diambil untuk analisis. Ini sering diambil dengan pipet yang dikalibrasi dan volumenya biasanya ditunjukkan dengan simbol V ss.
1.4. Titik ekivalen (TE)- titik (momen) titrasi di mana jumlah titran T yang ditambahkan setara dengan jumlah zat X yang dititrasi. Sinonim untuk TE: titik stoikiometri, titik akhir teoretis.
1.5. Titrasi titik akhir (KTT) - titik (momen) titrasi, di mana beberapa sifat larutan (misalnya, warnanya) menunjukkan perubahan yang nyata (tajam). LTT kurang lebih sesuai dengan TE, tetapi paling sering tidak sesuai dengannya.
1.6. Indikator- zat yang menunjukkan perubahan yang terlihat di TE atau di dekatnya. Idealnya, indikator hadir pada konsentrasi yang cukup rendah untuk interval transisi bukan biaya-
sejumlah besar titran T digunakan. Perubahan tajam yang terlihat pada indikator (misalnya, warnanya) sesuai dengan CTT.
1.7. Interval transisi indikator- area konsentrasi hidrogen, logam atau ion lain di mana mata dapat mendeteksi perubahan warna, intensitas warna, fluoresensi, atau properti lain dari indikator visual yang disebabkan oleh perubahan rasio dua bentuk yang sesuai dari indikatornya. Area ini biasanya dinyatakan sebagai logaritma negatif dari konsentrasi, misalnya:  Untuk indikator redoks, interval transisi adalah daerah potensial redoks yang sesuai.
Untuk indikator redoks, interval transisi adalah daerah potensial redoks yang sesuai.
1.8. Derajat titrasi - rasio volume V (T) dari titran yang ditambahkan ke volume V (TE) dari titran yang sesuai dengan TE. Dengan kata lain, derajat titrasi suatu larutan adalah perbandingan jumlah zat yang dititrasi dengan jumlah awalnya dalam larutan yang dianalisis:

1.9. Tingkat titrasi- memesan  konsentrasi larutan titran yang digunakan, misalnya 10 -1 , 10 -2 , 10 -3 , dst.
konsentrasi larutan titran yang digunakan, misalnya 10 -1 , 10 -2 , 10 -3 , dst.
1.10. Kurva titrasi - representasi grafis dari ketergantungan perubahan konsentrasi c (X) analit X atau beberapa properti terkait dari sistem (larutan) pada volume V (T) ditambahkan titran T. Nilai c (X) selama titrasi berubah beberapa kali lipat, sehingga kurva titrasi sering diplot dalam koordinat:  Absis menunjukkan volume titran yang ditambahkan V (T) atau derajat titrasi / . Jika konsentrasi kesetimbangan c (X) atau intensitas suatu sifat yang sebanding dengannya diplot sepanjang sumbu y, maka diperoleh kurva titrasi linier. Jika pada sumbu y kita sisihkan
Absis menunjukkan volume titran yang ditambahkan V (T) atau derajat titrasi / . Jika konsentrasi kesetimbangan c (X) atau intensitas suatu sifat yang sebanding dengannya diplot sepanjang sumbu y, maka diperoleh kurva titrasi linier. Jika pada sumbu y kita sisihkan  atau logaritma intensitas suatu sifat sebanding dengan c(X), maka diperoleh kurva titrasi logaritmik (atau monologaritmik). Untuk lebih jelas mengidentifikasi fitur dari proses titrasi dan untuk tujuan yang diterapkan, kadang-kadang mereka membangun kurva titrasi diferensial, memplot sepanjang sumbu absis volume titran yang ditambahkan V (T), dan sepanjang sumbu y - turunan pertama dari logaritma konsentrasi (atau intensitas properti yang sebanding dengannya) sehubungan dengan volume titran yang ditambahkan:
atau logaritma intensitas suatu sifat sebanding dengan c(X), maka diperoleh kurva titrasi logaritmik (atau monologaritmik). Untuk lebih jelas mengidentifikasi fitur dari proses titrasi dan untuk tujuan yang diterapkan, kadang-kadang mereka membangun kurva titrasi diferensial, memplot sepanjang sumbu absis volume titran yang ditambahkan V (T), dan sepanjang sumbu y - turunan pertama dari logaritma konsentrasi (atau intensitas properti yang sebanding dengannya) sehubungan dengan volume titran yang ditambahkan:  Kurva titrasi seperti itu biasanya digunakan dalam metode analisis fisikokimia, misalnya, dalam titrasi potensiometri.
Kurva titrasi seperti itu biasanya digunakan dalam metode analisis fisikokimia, misalnya, dalam titrasi potensiometri.
1.11. Solusi standar- larutan yang konsentrasi zat aktifnya diketahui.
1.12. Standardisasi- proses menemukan konsentrasi reagen aktif dalam larutan (paling sering dengan mentitrasinya dengan larutan standar dari zat yang sesuai).
1.13. Lompatan titrasi- interval perubahan tajam dalam setiap sifat fisik atau fisika-kimia larutan di dekat titik ekivalen, biasanya diamati ketika 99,9-100,1% titran ditambahkan dibandingkan dengan jumlah stoikiometrinya.
1.14. Titrasi kosong- titrasi larutan yang identik dengan larutan yang dianalisis dalam hal volume, keasaman, jumlah indikator, dll., tetapi tidak mengandung analit.
2. Operasi dasar analisis titrimetri
2.1. Pembersihan, pencucian, penyimpanan alat ukur.
2.2. Memeriksa kapasitas alat ukur.
2.3. Mengambil sampel dengan massa yang diketahui secara tepat dengan selisih antara hasil dua penimbangan (biasanya pada neraca analitik).
2.4. Transfer kuantitatif sampel zat ke dalam labu volumetrik dan pelarutan zat.
2.5. Mengisi peralatan volumetrik (termos, buret, pipet) dengan larutan.
2.6. Mengosongkan pipet, buret.
2.7. Pemilihan alikuot dari solusi yang dianalisis.
2.8. Titrasi dan perhitungan berdasarkan hasil titrasi.
3. Kalibrasi alat ukur
Dalam analisis titrimetri, volume larutan yang tepat diukur dengan menggunakan alat ukur, yaitu labu ukur dengan kapasitas 1000, 500, 250, 100, 50 dan 25 ml, pipet dan pipet ukur dengan kapasitas 10, 5, 3 , 2 dan 1 ml. Kapasitas labu dan pipet pada 20 °C terukir di leher labu atau di sisi pipet (volume nominal). Dalam produksi massal peralatan volumetrik, kapasitas aktual (sebenarnya) dari labu volumetrik, buret, pipet mungkin berbeda dari nilai nominal yang ditunjukkan pada peralatan. Untuk mencapai akurasi yang diperoleh diperlukan hasil analisis titrimetri
Kalibrasi gelas volumetrik didasarkan pada penentuan massa yang tepat dari air suling yang dituangkan atau dituangkan, yang ditentukan oleh hasil penimbangan gelas sebelum dan sesudah menuangkan atau menuangkan air. Volume air dalam bejana yang dikalibrasi (kapasitasnya) dan massa air dihubungkan dengan rasio:

di mana  - massa jenis air pada suhu percobaan, g/ml.
- massa jenis air pada suhu percobaan, g/ml.
Kepadatan air tergantung pada suhu, jadi saat membuat perhitungan, Anda harus menggunakan data di Tabel. 2-1.
Tabel 2-1. Nilai kepadatan air pada suhu yang sesuai

Labu volumetrik dikalibrasi untuk infus, dan buret serta pipet dikalibrasi untuk menuangkan, karena sejumlah kecil cairan selalu tertinggal di dinding cawan selama penuangan.
3.1. Pemeriksaan kapasitas labu volumetrik
Labu dicuci bersih, dikeringkan dan ditimbang di neraca analitik dengan ketelitian ± 0,002 g. Kemudian diisi dengan air (selanjutnya - suling) di sepanjang meniskus bawah, tetesan air di bagian atas leher botol labu dikeluarkan dengan kertas saring dan ditimbang kembali. Penimbangan masing-masing labu kosong dan labu berisi air dilakukan paling sedikit dua kali, sedangkan selisih dua penimbangan tidak boleh melebihi ± 0,005 g. Selisih antara massa labu dengan air dan massa labu kosong adalah sama dengan massa air yang ditampung oleh labu pada suhu tertentu. Kapasitas labu yang sebenarnya dihitung dengan membagi massa rata-rata air dengan densitasnya pada suhu uji (lihat Tabel 2-1).
Misalnya, jika sebuah labu ukur dengan volume nominal 100 ml dikalibrasi, massa rata-rata air pada 18 °C adalah 99,0350 g. Maka kapasitas labu ukur yang sebenarnya adalah:
3.2. Pemeriksaan kapasitas buret
Buret adalah silinder kaca, diameter bagian dalam dapat sedikit berbeda sepanjang buret. Pembagian yang sama pada buret di berbagai bagiannya sesuai dengan volume larutan yang tidak sama. Itulah sebabnya kalibrasi buret menghitung volume sebenarnya untuk setiap lokasi buret yang dipilih.
Buret yang bersih dan kering diisi dengan air sampai tanda nol di sepanjang meniskus bawah dan tetesan air dihilangkan dari permukaan bagian dalam buret dengan kertas saring. Kemudian, di bawah buret pengganti botol, sebelumnya ditimbang dengan tutup pada neraca analitik. Volume tertentu air (misalnya, 5 ml) perlahan-lahan dituangkan ke dalam botol dari buret. Setelah itu, botol ditutup dengan penutup dan ditimbang kembali. Selisih antara massa botol timbang dengan air dan botol timbang kosong sama dengan massa air yang terkandung dalam buret antara pembagian 0 dan 5 ml pada suhu percobaan. Kemudian buret diisi kembali dengan air sampai tanda nol di sepanjang meniskus bawah, 10 ml air dituangkan perlahan ke dalam botol kosong dan massa air yang terkandung dalam buret antara pembagian 0 dan 10 ml ditentukan dengan cara yang sama. Saat mengkalibrasi buret, misalnya, untuk 25 ml, operasi ini dilakukan 5 kali dan massa air yang sesuai dengan volume nominal yang ditunjukkan pada buret 5, 10, 15, 20 dan 25 ml dihitung. Setiap penimbangan botol kosong dan sebotol air diulang setidaknya dua kali, sedangkan perbedaan antara dua penimbangan tidak boleh melebihi ± 0,005 g.
Kemudian menurut tabel. 2-1 tentukan densitas air pada suhu percobaan dan hitung kapasitas sebenarnya dari buret untuk setiap nilai volume nominal yang tertera di atasnya.
Berdasarkan data yang diperoleh, nilai koreksi dihitung sama dengan selisih antara nilai yang dihitung dari kapasitas sebenarnya dan nilai yang sesuai dari volume nominal buret:

dan kemudian menggambar kurva kesalahan kapasitas buret dalam koordinat  (Gambar 2-1).
(Gambar 2-1).
Sebagai contoh, biarkan data eksperimen berikut diperoleh saat mengkalibrasi buret dengan kapasitas 25 ml pada suhu 20 °C, yang, bersama-sama dengan hasil perhitungan yang sesuai, disajikan pada Tabel. 2-2.
Berdasarkan data tabular yang diperoleh, kurva koreksi kapasitas untuk buret tertentu diplot, yang dengannya dimungkinkan untuk memperbaiki hasil pembacaan buret.
Tabel 2-2. Hasil kalibrasi untuk buret 25 ml


Beras. 2-1. Kurva koreksi kapasitas buret
Misalnya, 7,50 ml titran digunakan untuk titrasi alikuot analit menurut hasil penghitungan buret. Menurut grafik (lihat Gambar 2-1), nilai koreksi yang sesuai dengan volume nominal ini adalah 0,025 ml, volume titran yang sebenarnya digunakan adalah: 7,50 - 0,025 = 7,475 ml.
3.3. Memeriksa kapasitas pipet
Sebuah pipet, bersih dan ditimbang dengan neraca analitik, diisi dengan air sampai tanda nol di sepanjang meniskus bawah dan kemudian air diisi secara perlahan.
dituangkan di sepanjang dinding ke dalam botol yang telah ditimbang sebelumnya. Botol ditutup dengan penutup dan ditimbang dengan air. Setiap penimbangan botol kosong dan botol berisi air diulang minimal dua kali, sedangkan selisih dua penimbangan tidak boleh melebihi ± 0,005 g. Selisih antara massa botol dengan air dan botol kosong sama dengan massa air yang ditampung oleh pipet. Kapasitas sebenarnya dari pipet dihitung dengan membagi massa rata-rata air dengan densitas air pada suhu uji (lihat Tabel 2-1).
4. Perhitungan tipikal dalam analisis titrimetri
4.1. Cara menyatakan konsentrasi yang digunakan untuk perhitungan dalam analisis titrimetri
4.1.1. Konsentrasi molar zat c (A), mol / l - jumlah zat A dalam mol yang terkandung dalam 1 liter larutan:
 (2.1)
(2.1)
di mana  - jumlah zat A dalam mol, yang dilarutkan dalam V (A) l
- jumlah zat A dalam mol, yang dilarutkan dalam V (A) l
larutan.
4.1.2. Konsentrasi molar ekivalen suatu zat  , mol / l - jumlah zat A yang setara dalam mol yang terkandung dalam 1 liter larutan (nama sebelumnya adalah "normalitas" larutan):
, mol / l - jumlah zat A yang setara dalam mol yang terkandung dalam 1 liter larutan (nama sebelumnya adalah "normalitas" larutan):
 (2.2)
(2.2)
di mana  - jumlah zat yang setara dengan A dalam mol,
- jumlah zat yang setara dengan A dalam mol,
dilarutkan dalam V (A) l larutan;  - massa molar setara dengan ve-
- massa molar setara dengan ve-
zat A, g / mol; - faktor ekivalen zat.
4.1.3. Titer zat T(A), g / ml - massa zat terlarut A dalam gram, terkandung dalam 1 ml larutan:
4.1.4. Faktor konversi titrimetri  I, g / ml - massa analit dalam gram, berinteraksi dengan 1 ml titran:
I, g / ml - massa analit dalam gram, berinteraksi dengan 1 ml titran:
(2.4)
4.1.5. Faktor koreksi F- nilai yang menunjukkan berapa kali konsentrasi praktis titran berbeda dari nilai teoretis terkait yang ditentukan dalam metode:
 (2.5)
(2.5)
4.2. Perhitungan massa molar ekuivalen zat dalam reaksi yang digunakan dalam analisis titrimetri
Setara adalah partikel nyata atau bersyarat yang dapat menambahkan atau menyumbangkan satu ion hidrogen H + (atau setara dengannya dalam reaksi asam-basa) atau menambah atau menyumbangkan satu elektron dalam reaksi redoks.
Faktor kesetaraan  - nomor yang menunjukkan yang
- nomor yang menunjukkan yang
fraksi ekivalen berasal dari partikel nyata zat A. Faktor ekivalen dihitung berdasarkan stoikiometri reaksi ini: 
di mana Z- jumlah proton yang disumbangkan atau ditambahkan oleh satu partikel yang bereaksi (molekul atau ion) dalam reaksi asam-basa, atau jumlah elektron yang disumbangkan atau diterima oleh satu partikel yang bereaksi (molekul atau ion) dalam setengah reaksi oksidasi atau reduksi.
Massa molar ekivalen suatu zat adalah massa satu mol ekivalen suatu zat, sama dengan hasil kali faktor ekivalen dengan massa molar zat, g/mol. Itu dapat dihitung menggunakan rumus:
 (2.6)
(2.6)
4.3. Pembuatan larutan dengan mengencerkan larutan yang lebih pekat dengan konsentrasi yang diketahui
Saat melakukan analisis titrimetri, dalam beberapa kasus diperlukan untuk menyiapkan larutan zat A dengan volume  kira-kira konsentrasinya diketahui dengan mengencerkan larutan yang lebih pekat.
kira-kira konsentrasinya diketahui dengan mengencerkan larutan yang lebih pekat.
Ketika larutan diencerkan dengan air, jumlah zat A atau jumlah zat setara A tidak berubah, oleh karena itu, sesuai dengan ekspresi (2.1) dan (2.2), kita dapat menulis:
(2.7)  (2.8)
(2.8)
di mana indeks 1 dan 2 masing-masing mengacu pada larutan sebelum dan sesudah pengenceran.
Dari rasio yang diperoleh, volume larutan yang lebih pekat dihitung  , yang harus diukur untuk menyiapkan solusi yang diberikan.
, yang harus diukur untuk menyiapkan solusi yang diberikan.
4.4. Persiapan volume yang telah ditentukan larutan dengan menimbang massa yang diketahui secara tepat
4.4.1. Perhitungan Berat Sampel
Berat teoritis sampel zat standar A, yang diperlukan untuk menyiapkan volume tertentu dari larutan dengan konsentrasi yang diketahui, dihitung dari persamaan (2.1) dan (2.2). Ini sama dengan:
(2.9)
jika konsentrasi molar suatu zat dalam larutan digunakan, dan:
(2.10)
jika konsentrasi molar ekivalen zat dalam larutan digunakan.
4.4.2. Perhitungan konsentrasi yang tepat dari larutan yang disiapkan
Konsentrasi larutan zat A, yang dibuat dengan sampel akurat bermassa m (A), dihitung dari hubungan (2.1-2.3), di mana t(A)- massa praktis zat A, diambil dari selisih antara dua penimbangan pada neraca analitik.
4.5. Perhitungan konsentrasi titran selama standardisasi
Diketahui volume larutan standar  dengan konsentrasi
dengan konsentrasi  dititrasi dengan larutan titran volume V (T)(atau sebaliknya). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi
dititrasi dengan larutan titran volume V (T)(atau sebaliknya). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi  , hukum persamaan memiliki bentuk:
, hukum persamaan memiliki bentuk:
dan 
Dari sini diperoleh ekspresi untuk menghitung konsentrasi molar ekivalen titran dari hasil titrasi:
 (2.12)
(2.12)
4.6. Perhitungan massa analit dalam larutan yang dianalisis4.6.1. titrasi langsung
Zat yang akan ditentukan dalam larutan yang dianalisis dititrasi langsung dengan titran.
4.6.1.1. Perhitungan menggunakan konsentrasi molar ekivalen titran
Sebuah alikuot dari larutan analit  dititrasi
dititrasi
larutan titran dengan volume V(T). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi:

hukum persamaan memiliki bentuk:  dan
dan
(2.13)
Oleh karena itu, konsentrasi molar ekivalen analit, dihitung dari hasil titrasi, adalah sama dengan:
 (2.14)
(2.14)
Ekspresi yang dihasilkan disubstitusikan ke dalam persamaan (2.2) dan diperoleh rumus untuk menghitung massa analit dalam labu dengan volume  menurut hasil titrasi langsung :
menurut hasil titrasi langsung :
 (2.15)
(2.15)
Jika, selama titrasi, sebagian titran dikonsumsi oleh reaksi dengan indikator, "eksperimen kosong" dilakukan dan volume titran V "(T) ditentukan,
digunakan untuk titrasi indikator. Dalam perhitungan, volume ini dikurangi dari volume titran, yang digunakan untuk mentitrasi larutan analit. Perubahan tersebut dibuat selama "eksperimen kosong" di semua rumus perhitungan yang digunakan dalam analisis titrimetri. Misalnya, rumus (2.15) untuk menghitung massa analit, dengan mempertimbangkan "percobaan kosong", akan terlihat seperti:
(2.16)
4.6.1.2. Perhitungan menggunakan faktor konversi titrimetri
Kami memiliki solusi yang dianalisis dengan volume  Untuk titrasi al-
Untuk titrasi al-
bagian mil  larutan analit yang digunakan volume titran V (T) dengan faktor konversi titrimetri teoritis
larutan analit yang digunakan volume titran V (T) dengan faktor konversi titrimetri teoritis  dan faktor koreksi F. Maka massa analit dalam alikuot sama dengan:
dan faktor koreksi F. Maka massa analit dalam alikuot sama dengan:
(2.17)
dan di seluruh volume yang dianalisis 
(2.18)
4.6.2. titrasi substitusi
 kelebihan reagen A yang diketahui ditambahkan dan substituen B diisolasi dalam jumlah yang setara dengan analit:
kelebihan reagen A yang diketahui ditambahkan dan substituen B diisolasi dalam jumlah yang setara dengan analit:

Substituen B dititrasi dengan titran yang sesuai:

Hukum ekivalen untuk titrasi substitusi:

menggunakan relasi (2.8) dapat ditulis dalam bentuk:

Dari sini diperoleh rumus untuk menghitung konsentrasi molar ekivalen analit dalam larutan menurut hasil titrasi substitusi:

yang memiliki bentuk yang sama seperti pada titrasi langsung (2.14). Itulah sebabnya semua perhitungan massa analit dalam masalah yang dianalisis selama titrasi substitusi dilakukan sesuai dengan rumus (2.15-2.18) untuk titrasi langsung. 4.6.3. Titrasi kembali
Untuk alikuot analit  menambahkan terkenal kelebihan titran pertama
menambahkan terkenal kelebihan titran pertama  :
:

Kemudian kelebihan titran pertama yang tidak bereaksi dititrasi dengan titran kedua, yang menghabiskan volume  :
:

Hukum persamaan dalam hal ini dapat ditulis sebagai:

Dari sini, konsentrasi molar ekivalen zat X dalam larutan dihitung:
 (2.19)
(2.19)
Substitusikan persamaan yang dihasilkan ke dalam persamaan (2.2) dan dapatkan rumus untuk menghitung massa analit dalam larutan yang dianalisis, sama dengan volume labu, berdasarkan hasil titrasi balik:

5. Pelaksanaan dan pemberian kerja praktek analisis titrimetri
5.1. Ketentuan umum
Saat mempelajari bagian "Analisis titrimetri", direncanakan untuk melakukan pekerjaan pada topik berikut.
Tema I Metode titrasi asam basa.
Tema II. Metode titrasi redoks.
Topik III. Metode titrasi presipitasi.
Topik IV. Metode titrasi kompleksometri.
Pelajaran 1. Pembuatan larutan asam klorida dan standarisasinya.
Pelajaran 2. Penentuan massa alkali dalam larutan. Penentuan massa karbonat dalam larutan. Penentuan massa alkali dan karbonat dalam larutan di hadapan bersama.
Pelajaran 3. Penentuan massa amonia dalam larutan garam amonium.
a) Kontrol uji 1.
b) Penentuan massa amonia dalam larutan garam amonium. Pelajaran 4. Titrasi permanganometri.
A. Tes tertulis 1.
b) Penentuan massa hidrogen peroksida dalam larutan.
c) Penentuan massa besi(II) dalam larutan garam. Penentuan fraksi massa besi(II) dalam sampel garam.
Pelajaran 5. Titrasi iodometri.
a) Penentuan massa hidrogen peroksida dalam larutan.
b) Penentuan massa tembaga(II) dalam larutan. Pelajaran 6. titrasi iodimetri.
Pelajaran 7. Titrasi bromatometri. Penentuan massa arsenik (AKU AKU AKU) dalam larutan.
Pelajaran 8. titrasi bromometrik. Penentuan fraksi massa natrium salisilat dalam sediaan.
Pelajaran 9. Titrasi Nitritometri.
a) Kontrol uji 2.
b) Penentuan fraksi massa novocaine dalam sediaan. Pelajaran 10. Titrasi argentometri dan heksasianoferatom-
titrasi trik.
A. Tes tertulis2.
b) Penentuan massa kalium bromida dan kalium iodida dalam larutan dengan titrasi argentometri.
c) Penentuan massa seng dalam larutan dengan titrasi heksasianoferratometri.
Pelajaran 11. Penentuan kompleksometri massa seng dan timbal dalam larutan.
a) Kontrol uji 3.
b) Penentuan massa seng dan timbal dalam larutan.
Pelajaran 12. Penentuan kompleksometri besi(III) dan kalsium dalam larutan.
A. Tes tertulis3.
b) Penentuan massa besi(III) dan kalsium dalam larutan.
Bergantung pada situasi spesifik, diperbolehkan untuk melakukan beberapa pekerjaan selama tidak hanya satu, tetapi dua pelajaran. Dimungkinkan juga untuk menggeser waktu kontrol pengujian dan pengujian tertulis.
Di akhir setiap topik, contoh item tes untuk kontrol menengah pengetahuan siswa, isi tes tertulis akhir, contoh tiket untuk tes tertulis diberikan.
Di akhir setiap pelajaran, siswa menyusun protokol yang mencakup tanggal dan nama pekerjaan yang dilakukan, esensi metodologi, urutan pekerjaan, data eksperimen yang diperoleh, perhitungan, tabel, kesimpulan. Semua perhitungan hasil analisis (konsentrasi larutan, massa analit) dilakukan oleh siswa dengan akurasi angka penting keempat, kecuali untuk kasus yang ditentukan secara khusus dalam teks.
Kontrol menengah atas keterampilan praktis dan pengetahuan teoretis dilakukan dengan bantuan kontrol tes dan tes tertulis.
5.2. Dukungan materi untuk kelas dalam analisis titrimetri
Barang pecah belah: buret dengan kapasitas 5 ml, pipet volumetrik dengan kapasitas 2 dan 5 ml, labu ukur dengan kapasitas 25, 50, 100 dan 250 ml, labu ukur dengan kapasitas 10-25 ml, botol kaca, corong kaca dengan diameter 20-30 mm, labu kaca polos atau gelap dengan kapasitas 100, 200 dan 500 ml, silinder ukur dengan kapasitas 10, 100 ml.
Reagen: Reagen dengan kualifikasi "murni secara kimia" digunakan dalam pekerjaan dan "ch.d.a.", kertas indikator.
Perangkat: timbangan analitik dengan anak timbangan, timbangan teknis dengan anak timbangan, oven, termometer laboratorium dengan skala 20-100 °C, tripod dengan kaki untuk memasang buret dan cincin untuk jaring asbes, pembakar gas, penangas air.
Bahan pembantu dan aksesoris: deterjen (soda, bubuk pencuci, campuran kromium), sikat pencuci piring, bohlam karet, jaring asbes, lem alat tulis, pensil kaca, kertas saring.
Bibliografi
1. Kuliah untuk mahasiswa pada bagian "Analisis Titrimetri".
2.Kharitonov Yu Ya. Kimia analitik (analitik): Dalam 2 jilid - ed. 5 - M.: Sekolah Tinggi, 2010 (selanjutnya disebut "Buku Pelajaran").
3.Lurie Yu.Yu. Handbook of Analytical Chemistry.- M.: Chemistry, 1989 (selanjutnya disebut "Buku Pegangan").
4.Dzhabarov D.N. Kumpulan latihan dan tugas dalam kimia analitik.- Moskow: Dokter Rusia, 2007.
Analisis titrimetri (analisis volume) adalah metode analisis kuantitatif berdasarkan pengukuran volume atau massa reagen yang diperlukan untuk bereaksi dengan analit. Analisis titrimetri banyak digunakan di laboratorium biokimia, klinis, sanitasi dan lainnya dalam studi eksperimental dan untuk analisis klinis. Misalnya, ketika menetapkan keseimbangan asam-basa, menentukan keasaman jus lambung, keasaman dan alkalinitas urin, dll. Analisis titrimetri juga merupakan salah satu metode utama analisis kimia di laboratorium farmasi kontrol dan analitik.
Jumlah zat uji dalam analisis titrimetri ditentukan dengan titrasi: larutan zat lain dengan konsentrasi yang diketahui secara bertahap ditambahkan ke volume yang diukur secara akurat dari larutan zat uji sampai jumlahnya menjadi setara secara kimia dengan jumlah zat uji. zat. Keadaan ekivalen disebut titik ekivalen titrasi. Larutan pereaksi yang konsentrasinya diketahui yang digunakan untuk titrasi disebut larutan titrasi (larutan standar atau titran): konsentrasi yang tepat dari larutan yang dititrasi dapat dinyatakan dengan titer (g / ml), normalitas (eq / l), dll.
Persyaratan berikut dikenakan pada reaksi yang digunakan dalam analisis titrimetri: zat harus bereaksi dalam rasio kuantitatif (stoikiometri) yang ketat tanpa reaksi samping, reaksi harus berlangsung cepat dan hampir berakhir; untuk menetapkan titik ekivalen, perlu menggunakan metode yang cukup andal, pengaruh zat asing pada jalannya reaksi harus dikecualikan. Selain itu, diinginkan bahwa dalam analisis titrimetri, reaksi berlangsung pada suhu kamar.
Titik ekivalen dalam analisis titrimetri ditentukan dengan mengubah warna larutan atau indikator yang dititrasi yang dimasukkan pada awal atau selama titrasi, mengubah daya hantar listrik larutan, mengubah potensial elektroda yang direndam dalam larutan yang dititrasi, mengubah arus nilai, kerapatan optik, dll.
Salah satu metode yang banyak digunakan untuk menentukan titik ekivalen adalah metode indikator. Indikator - zat yang memungkinkan untuk menetapkan titik akhir titrasi (saat perubahan tajam dalam warna larutan titrasi). Paling sering, indikator ditambahkan ke seluruh larutan yang dititrasi (indikator internal). Saat bekerja dengan indikator eksternal, setetes larutan yang dititrasi secara berkala diambil dan dicampur dengan setetes larutan indikator atau diletakkan di atas kertas indikator (yang menyebabkan hilangnya analit).
Proses titrasi digambarkan secara grafis dalam bentuk kurva titrasi, yang memungkinkan Anda untuk memvisualisasikan seluruh jalannya titrasi dan memilih indikator yang paling cocok untuk mendapatkan hasil yang akurat, karena. kurva titrasi dapat dibandingkan dengan interval perubahan warna indikator.
Kesalahan dalam analisis titrimetri dapat bersifat metodologis dan spesifik, karena karakteristik reaksi ini. Kesalahan metodologis dikaitkan dengan kekhasan metode titrasi dan bergantung pada kesalahan alat ukur, kalibrasi gelas volumetrik, pipet, buret, drainase cairan yang tidak lengkap di sepanjang dinding gelas volumetrik.
Kesalahan spesifik disebabkan oleh karakteristik reaksi yang diberikan dan bergantung pada konstanta kesetimbangan reaksi dan keakuratan dalam menemukan titik ekivalen. analgin molekul obat farmasi
Metode analisis titrimetri, tergantung pada reaksi yang mendasarinya, dibagi menjadi beberapa kelompok utama berikut:
- 1. Metode netralisasi, atau titrasi asam-basa, didasarkan pada reaksi netralisasi, yaitu interaksi asam dan basa. Metode-metode ini termasuk asidimetri (kuantisasi basa menggunakan larutan asam yang dititrasi), alkalimetri (penentuan asam menggunakan larutan basa yang dititrasi), halometri (kuantisasi garam menggunakan basa atau asam jika mereka bereaksi dengan garam dalam rasio stoikiometri).
- 2. Metode presipitasi didasarkan pada titrasi zat yang membentuk senyawa tidak larut dalam media tertentu, misalnya garam barium, perak, timbal, seng, kadmium, merkuri (II), tembaga (III), dll. Metode ini meliputi argentometri (titrasi dengan larutan perak nitrat), mercurometry (titrasi dengan larutan besi merkuri nitrat), dll.
- 3. Metode pembentukan kompleks, atau kompleksometri (merkurimetri, fluorometri, dll.), didasarkan pada penggunaan reaksi di mana senyawa kompleks terbentuk, misalnya, Ag + + 2CN-Y Ag (CN) 2]. Metode kompleksasi terkait erat dengan metode presipitasi, karena banyak reaksi pengendapan disertai dengan pembentukan kompleks, dan pembentukan kompleks disertai dengan pengendapan senyawa yang sedikit larut.
- 4. Metode reduksi oksidasi, atau oksidimetri, termasuk permanganatometri, kromatometri (bikromatometri), iodometri, bromatometri, cerimetri, vanadometri, dll.
Kuliah 7. Metode analisis titrimetri.
1. Inti dari metode analisis titrimetri
2. Klasifikasi metode analisis titrimetri
3. Perhitungan dalam titrimetri. Solusi standar dan bekerja
4. Kesalahan metode titrimetri
5. Konstruksi kurva titrasi.
Metode analisis titrimetri didasarkan pada fakta bahwa zat bereaksi satu sama lain dalam jumlah yang setara:
di manan1 dann2 jumlah zat 1 dan 2, [ n ]= mol
di manaCkonsentrasi ekivalen molar;Vvolume larutan [V]= l
Kemudian, untuk dua zat yang bereaksi secara stoikiometri, hubungannya benar:
Analisis titrimetri adalah metode untuk menentukan jumlah suatu zat dengan mengukur secara akurat volume larutan zat yang bereaksi satu sama lain.
Titer- jumlah g zat yang terkandung dalam 1 ml larutan atau setara dengan zat yang akan ditentukan. Misalnya, jika titer H2SO4 adalah 0,0049 g/ml, ini berarti setiap ml larutan mengandung 0,0049 g asam sulfat.
Larutan yang titernya diketahui disebut larutan titrasi. Titrasi- proses penambahan ke dalam larutan uji atau alikuot sejumlah ekivalen dari larutan yang dititrasi. Dalam hal ini, larutan standar digunakan - larutan dengan konsentrasi zat yang tepat (Na2CO3, HCl).
Reaksi titrasi harus memenuhi persyaratan berikut:
1) Reaksi harus berlangsung secara kuantitatif, harus benar-benar stoikiometrik
2) Reaksi harus berlangsung dengan kecepatan tinggi;
3) Reaksi harus berlangsung sampai akhir, tidak boleh ada proses yang saling bersaing;
4) Untuk reaksi tertentu, harus ada cara yang tepat untuk menentukan akhir reaksi (titik ekivalen).
Contoh titrasi asam basa :
HCl + NaOH → NaCl + H2O (indikator jingga metil)
Klasifikasi metode analisis titrimetri.
Metode analisis titrimetri dapat diklasifikasikan menurut beberapa kriteria. Misalnya, menurut jenis reaksi utama yang terjadi selama titrasi:
1) titrasi asam basa (netralisasi): H3O + + OH - 2H2O
metode ini menentukan jumlah asam atau alkali dalam larutan yang dianalisis;
a) asidimetri
b) alkalimetri
2) titrasi redoks (redoksimetri):
Ox1 + Red2 Ox2 + Red1
a) permanganatometri (KMnO4);
b) iodometri (I2);
c) bromatometri (KBrO3);
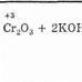
d) dikromatometri (K2Cr2O7);
e) cerimetri (Ce(SO4)2);
f) vanadometri (NH4VO3);
g) titanometri (TiCl3), dll.
3) titrasi pengendapan: Me + X MeX↓
a) argentometri Ag+ + Cl - "AgCl $
b) Merkurometri
4) titrasi kompleksometri Mem+ + nL m+
a) merkuri
b) kompleksometri (EDTA)
Tugas utama analisis titrimetri tidak hanya menggunakan larutan yang konsentrasinya diketahui secara pasti, tetapi juga menentukan titik ekivalen dengan benar. Ada beberapa cara untuk memperbaiki titik ekivalen:
1. Menurut warna ion dari unsur yang ditentukan, misalnya, ion permanganat MNO4 - memiliki warna merah
2. Dengan bantuan indikator, misalnya, indikator asam-basa digunakan dalam reaksi netralisasi: lakmus, fenolftalein, metil oranye - senyawa organik yang berubah warna ketika berpindah dari lingkungan asam ke basa.
Indikator- pewarna organik yang berubah warna ketika keasaman medium berubah. Secara skematis (menghilangkan bentuk antara), kesetimbangan indikator dapat direpresentasikan sebagai reaksi asam-basa
HIn + H2O Dalam - + H3O +
Area transisi warna indikator (posisi dan interval) dipengaruhi oleh semua faktor yang menentukan konstanta kesetimbangan (kekuatan ion, suhu, zat asing, pelarut), serta indikator.
3. Oleh saksi substansi
Contoh: Ag+ + Cl - " AgCl $
Ag+ + CrO4" Ag2CrO4$ (warna oranye terang)
Sejumlah kecil garam K2CrO4 ditambahkan ke labu di mana diperlukan untuk menentukan ion klorin (saksi). Kemudian zat uji ditambahkan secara bertahap dari buret, sedangkan ion klorida yang pertama bereaksi dan terbentuk endapan putih (AgCl) yaitu PR AgCl<< ПР Ag2Cr O4.
Jadi, setetes perak nitrat ekstra akan memberikan warna oranye terang, karena semua klorin telah bereaksi.
Metode titrasi.
1. titrasi langsung, pada titrasi langsung titran langsung ditambahkan ke zat yang akan dititrasi. Metode ini hanya berlaku jika semua persyaratan yang tercantum di atas terpenuhi.
2. titrasi kembali(dengan kelebihan), digunakan dalam reaksi lambat. Jika laju reaksi rendah, atau tidak mungkin untuk menemukan indikator, atau efek samping yang diamati, misalnya, hilangnya analit karena volatilitas, Anda dapat menggunakan teknik titrasi kembali: tambahkan kelebihan titran T1 yang diketahui ke zat yang akan ditentukan, akhiri reaksi, lalu cari jumlah titran yang tidak bereaksi dengan mentitrasinya dengan reagen T2 lain dengan konsentrasi C2. jelas bahwa jumlah titran T1, sama dengan perbedaan CT1VT1 = CT2VT2, dihabiskan untuk analit.
3. titrasi tidak langsung (dengan substitusi), digunakan dalam analisis senyawa organik. Jika reaksi non-stoikiometrik atau berlangsung lambat, maka titrasi substituen digunakan, yang untuk itu reaksi kimia analit dengan reagen tambahan dilakukan, dan produk yang diperoleh dalam jumlah yang setara dititrasi dengan titran yang sesuai.
Metode untuk menyatakan konsentrasi larutan.
Konsentrasi molar - mol / l
1M - 1 liter mengandung 1 g / mol zat
Konsentrasi molar ekivalen (larutan normal) (larutan harus mengandung sejumlah massa ekivalen dalam 1 liter).
Setara kimia adalah jumlah zat yang setara dengan satu g atom hidrogen.
Titer solusi T
Titer untuk zat yang berfungsi: https://pandia.ru/text/79/035/images/image004_113.gif" width="133" height="48 src="> [g/ml]
Titer zat kerja harus diubah menjadi titer analit menggunakan faktor konversi: Tonp = Trab F
Contoh: https://pandia.ru/text/79/035/images/image006_73.gif" width="72" height="46 src=">
![]()
a - sampel zat yang dianalisis
Solusi standar dan bekerja
Sebuah titran dengan konsentrasi yang diketahui disebut larutan standar. Menurut metode persiapan, larutan standar primer dan sekunder dibedakan. Larutan standar primer dibuat dengan melarutkan sejumlah zat kimia murni dengan komposisi stoikiometrik yang diketahui dalam volume tertentu pelarut. Larutan standar sekunder disiapkan sebagai berikut: siapkan larutan dengan konsentrasi perkiraan dan tentukan konsentrasinya (standarisasi) terhadap standar primer yang sesuai.
Zat referensi primer harus memenuhi sejumlah persyaratan:
1. Komposisi zat harus benar-benar sesuai dengan rumus kimia. Konten pengotor kurang dari 0,05%
2. Zat harus stabil pada suhu kamar, tidak higroskopis, tidak teroksidasi oleh oksigen atmosfer, tidak menyerap karbon dioksida, tidak mudah menguap.
3. Bahan harus memiliki berat molekul yang cukup tinggi untuk mengurangi kesalahan penimbangan.
Untuk persiapan larutan standar primer, Anda dapat menggunakan fixanal - ampul di mana sejumlah zat atau larutan standar disegel.
Metode analisis titrimetri (titrasi) memungkinkan untuk analisis kuantitatif volumetrik dan banyak digunakan dalam kimia. Keuntungan utamanya adalah berbagai cara dan metode, karena itu dapat digunakan untuk menyelesaikan berbagai masalah analitis.
Prinsip analisis
Metode analisis titrimetri didasarkan pada pengukuran volume larutan yang konsentrasinya diketahui (titran) yang telah bereaksi dengan zat uji.
Untuk analisis, Anda memerlukan peralatan khusus, yaitu buret - tabung kaca tipis dengan gradasi yang diterapkan. Ujung atas tabung ini terbuka, dan di ujung bawah ada stopcock. Buret yang telah terkalibrasi diisi dengan titran sampai tanda nol menggunakan corong. Analisis dilakukan sampai titik akhir titrasi (CTT) dengan menambahkan sedikit larutan dari buret ke zat yang diteliti. Titik akhir titrasi diidentifikasi dengan perubahan warna indikator atau beberapa sifat fisika-kimia.
Hasil akhir dihitung dari jumlah titran yang digunakan dan dinyatakan dalam titer (T) - massa zat per 1 ml larutan (g/ml).
Pembenaran Proses
Metode analisis kuantitatif titrimetri memberikan hasil yang akurat karena zat bereaksi satu sama lain dalam jumlah yang setara. Ini berarti bahwa hasil kali volume dan kuantitasnya identik satu sama lain: C 1 V 1 = C 2 V 2 . Dari persamaan ini, mudah untuk menemukan nilai C 2 yang tidak diketahui jika parameter yang tersisa ditetapkan secara independen (C 1 , V 2) dan ditetapkan selama analisis (V 1).
Deteksi titrasi titik akhir
Karena fiksasi akhir titrasi yang tepat waktu adalah bagian terpenting dari analisis, perlu untuk memilih metodenya dengan benar. Yang paling nyaman adalah penggunaan indikator berwarna atau fluoresen, tetapi metode instrumental juga dapat digunakan - potensiometri, amperometri, fotometri.

Pilihan akhir dari metode deteksi LTT tergantung pada akurasi dan selektivitas penentuan yang diperlukan, serta kecepatannya dan kemungkinan otomatisasi. Hal ini terutama berlaku untuk solusi berawan dan berwarna, serta lingkungan yang agresif.
Persyaratan untuk reaksi titrasi
Agar metode analisis titrimetri memberikan hasil yang benar, perlu dipilih reaksi yang tepat yang akan mendasarinya. Persyaratannya adalah sebagai berikut:
- stoikiometri;
- laju aliran tinggi;
- konstanta kesetimbangan tinggi;
- adanya metode yang dapat diandalkan untuk memperbaiki akhir percobaan titrasi.
Reaksi yang cocok dapat dari jenis apa pun.
Jenis analisis
Klasifikasi metode analisis titrimetri didasarkan pada jenis reaksi. Atas dasar ini, metode titrasi berikut dibedakan:
- asam basa;
- redoks;
- kompleksometrik;
- pengendapan.
Setiap jenis didasarkan pada jenis reaksinya sendiri, titran spesifik dipilih, tergantung pada subkelompok metode mana yang dibedakan dalam analisis.
Titrasi asam basa
Metode analisis titrimetri menggunakan reaksi interaksi hidroksonium dengan ion hidroksida (H 3 O + + OH - \u003d H 2 O) disebut asam basa. Jika zat yang diketahui dalam larutan membentuk proton, yang khas untuk asam, metode ini termasuk dalam subkelompok asidimetri. Di sini, asam klorida HCl yang stabil biasanya digunakan sebagai titran.
Jika titran membentuk ion hidroksida, metode ini disebut alkalimetri. Zat yang digunakan adalah basa seperti NaOH, atau garam yang diperoleh dengan mereaksikan basa kuat dengan asam lemah seperti Na 2 CO 3 .
Dalam hal ini, indikator warna digunakan. Mereka adalah senyawa organik lemah - asam dan basa, yang berbeda dalam struktur dan warna bentuk terprotonasi dan non-protonasi. Indikator yang paling umum digunakan dalam titrasi asam-basa adalah fenolftalein, indikator warna tunggal (larutan bening berubah menjadi merah tua dalam lingkungan basa) dan indikator jingga metil dua warna (zat merah menjadi kuning dalam lingkungan asam).

Penggunaannya yang luas dikaitkan dengan penyerapan cahaya yang tinggi, yang karenanya warnanya terlihat jelas dengan mata telanjang, dan kontras dan wilayah transisi warna yang sempit.
Titrasi Redoks
Analisis titrimetri redoks adalah metode analisis kuantitatif berdasarkan perubahan rasio konsentrasi bentuk teroksidasi dan tereduksi: aOx 1 + bRed 2 = aRed 1 + bOx 2.
Metode ini dibagi menjadi beberapa subkelompok berikut:
- permanganatometri (titran - KMnO 4);
- iodometri (I 2);
- dikromatometri (K 2 Cr 2 O 7);
- bromatometri (KBrO 3);
- iodatometri (KIO 3);
- cerimetri (Ce(SO 4) 2);
- vanadatometri (NH 4 VO 3);
- titanometri (TiCl 3);
- kromometri (CrCl 2);
- askorbinometri (C 6 H 8 OH).
Dalam beberapa kasus, peran indikator dapat dimainkan oleh reagen yang berpartisipasi dalam reaksi dan mengubah warnanya dengan perolehan bentuk teroksidasi atau tereduksi. Tetapi mereka juga menggunakan indikator tertentu, misalnya:
- saat menentukan yodium, pati digunakan, yang membentuk senyawa biru tua dengan ion I 3 -;
- dalam titrasi besi besi, ion tiosianat digunakan, yang membentuk kompleks merah terang dengan logam.

Selain itu, ada indikator redoks khusus - senyawa organik yang memiliki warna berbeda dari bentuk teroksidasi dan tereduksi.
Titrasi kompleksometri
Singkatnya, metode analisis titrimetri, yang disebut kompleksometri, didasarkan pada interaksi dua zat dengan pembentukan kompleks: M + L = ML. Jika garam merkuri digunakan, misalnya, Hg(NO 3) 2, metode ini disebut merkurimetri, jika asam etilendiamintetraasetat (EDTA) - kompleksometri. Secara khusus, dengan bantuan metode terakhir, metode titrimetri untuk menganalisis air dilakukan, yaitu kekerasannya.
Dalam kompleksometri, indikator logam transparan digunakan, yang memperoleh warna ketika kompleks dibentuk dengan ion logam. Misalnya, ketika mentitrasi garam besi dengan EDTA, asam sulfosalisilat transparan digunakan sebagai indikator. Itu mengubah larutan menjadi merah ketika dikomplekskan dengan besi.

Namun, lebih sering indikator logam memiliki warnanya sendiri, yang berubah tergantung pada konsentrasi ion logam. Sebagai indikator seperti itu, asam polibasa digunakan, yang membentuk kompleks yang cukup stabil dengan logam, yang cepat hancur bila terkena EDTA dengan perubahan warna yang kontras.
Titrasi curah hujan
Metode analisis titrimetri, yang didasarkan pada reaksi interaksi dua zat dengan pembentukan senyawa padat yang mengendap (M + X = MX ), adalah pengendapan. Nilainya terbatas, karena biasanya proses pengendapan berlangsung secara non-kuantitatif dan non-stoikiometri. Namun terkadang masih digunakan dan memiliki dua subkelompok. Jika metode tersebut menggunakan garam perak, misalnya AgNO 3 disebut argentometri, jika garam merkuri Hg 2 (NO 3) 2 maka merkurimetri.
Metode berikut digunakan untuk mendeteksi titik akhir titrasi:
- Metode Mohr, di mana indikatornya adalah ion kromat, yang membentuk endapan bata merah dengan perak;
- metode Volhard, berdasarkan titrasi larutan ion perak dengan kalium tiosianat dengan adanya besi besi, yang membentuk kompleks merah dengan titran dalam media asam;
- metode Faience, yang melibatkan titrasi dengan indikator adsorpsi;
- metode Gay-Lussac, di mana CTT ditentukan oleh pencerahan atau kekeruhan larutan.

Metode terakhir belum praktis digunakan baru-baru ini.
Metode titrasi
Titrasi diklasifikasikan tidak hanya oleh reaksi yang mendasari, tetapi juga dengan cara mereka dilakukan. Atas dasar ini, jenis berikut dibedakan:
- langsung;
- balik;
- titrasi substituen.
Kasus pertama hanya digunakan di bawah kondisi reaksi yang ideal. Titran ditambahkan langsung ke analit. Jadi dengan bantuan EDTA, magnesium, kalsium, tembaga, besi dan sekitar 25 logam lainnya ditentukan. Tetapi dalam kasus lain, metode yang lebih kompleks lebih sering digunakan.
Titrasi kembali
Tidak selalu mungkin untuk menemukan respons yang ideal. Paling sering, itu berlangsung lambat, atau sulit untuk menemukan cara untuk memperbaiki titik akhir titrasi untuk itu, atau senyawa volatil terbentuk di antara produk, yang menyebabkan sebagian analit hilang. Kekurangan tersebut dapat diatasi dengan menggunakan metode titrasi balik. Untuk melakukan ini, sejumlah besar titran ditambahkan ke zat yang akan ditentukan sehingga reaksi berlangsung sempurna, dan kemudian ditentukan berapa banyak larutan yang tetap tidak bereaksi. Untuk melakukan ini, residu titran dari reaksi pertama (T 1) dititrasi dengan larutan lain (T 2), dan jumlahnya ditentukan oleh perbedaan produk volume dan konsentrasi dalam dua reaksi: C T1 VT 1 -CT 2 VT 2.
Penggunaan metode analisis titrimetri terbalik mendasari penentuan mangan dioksida. Interaksinya dengan besi sulfat berlangsung sangat lambat, sehingga garam diambil secara berlebihan dan reaksi dipercepat dengan pemanasan. Jumlah ion besi yang tidak bereaksi dititrasi dengan kalium dikromat.

Titrasi pengganti
Titrasi substituen digunakan dalam kasus non-stoikiometrik atau reaksi lambat. Esensinya adalah bahwa reaksi stoikiometrik dengan senyawa tambahan dipilih untuk zat yang akan ditentukan, setelah itu produk interaksi dikenai titrasi.
Inilah yang dilakukan ketika menentukan dikromat. Kalium iodida ditambahkan ke dalamnya, sebagai akibatnya sejumlah yodium yang setara dengan analit dilepaskan, yang kemudian dititrasi dengan natrium tiosulfat.
Dengan demikian, analisis titrimetri memungkinkan untuk menentukan kandungan kuantitatif berbagai zat. Mengetahui sifat dan fitur jalannya reaksi, dimungkinkan untuk memilih metode dan metode titrasi yang optimal, yang akan memberikan hasil dengan tingkat akurasi yang tinggi.
Diisi dengan titran sampai tanda nol. Titrasi mulai dari tanda lain tidak dianjurkan, karena skala buret mungkin tidak merata. Buret diisi dengan solusi kerja melalui corong atau dengan bantuan perangkat khusus jika buret semi-otomatis. Titik akhir titrasi (titik ekivalen) ditentukan oleh indikator atau dengan metode fisikokimia (dengan konduktivitas listrik, transmisi cahaya, potensi elektroda indikator, dll.). Hasil analisis dihitung dengan jumlah larutan kerja yang digunakan untuk titrasi.
Jenis analisis titrimetri
Analisis titrimetri dapat didasarkan pada berbagai jenis reaksi kimia:
- titrasi asam-basa - reaksi netralisasi;
- titrasi redoks (permanganatometri, iodometri, kromatometri) - reaksi redoks;
- titrasi pengendapan (argentometri) - reaksi yang terjadi dengan pembentukan senyawa yang sukar larut, sambil mengubah konsentrasi ion yang diendapkan dalam larutan;
- titrasi kompleksometri - reaksi berdasarkan pembentukan senyawa kompleks yang kuat dari ion logam dengan kompleks (biasanya EDTA), sambil mengubah konsentrasi ion logam dalam larutan yang dititrasi.
Jenis titrasi
Perbedaan dibuat antara titrasi langsung, balik, dan substituen.
- Pada titrasi langsung ke dalam larutan analit (suatu alikuot atau sampel, zat yang dapat dititrasi) tambahkan larutan titran (larutan kerja) dalam porsi kecil.
- Pada titrasi kembali pertama, kelebihan reagen khusus yang diketahui ditambahkan ke larutan analit, dan kemudian residunya, yang belum masuk ke dalam reaksi, dititrasi.
- Pada titrasi substitusi pertama, kelebihan tertentu dari reagen khusus ditambahkan ke larutan analit, dan kemudian salah satu produk reaksi antara analit dan reagen yang ditambahkan dititrasi.
Lihat juga
Tautan
Yayasan Wikimedia. 2010 .