Katalisis dalam reaksi kimia. Reaksi katalitik: definisi, deskripsi, contoh Katalis reaksi kimia
Sebagian besar proses yang mendasari teknologi kimia adalah reaksi katalitik. Ini disebabkan oleh fakta bahwa dengan pengenalan katalis, laju interaksi zat meningkat secara signifikan. Dalam hal ini, produsen dapat mengurangi biaya atau memperoleh lebih banyak produk reaksi dalam periode waktu yang sama. Itulah sebabnya banyak perhatian diberikan pada studi katalisis dalam pelatihan teknologi. Namun, fenomena ini juga memainkan peran penting di alam. Jadi, zat khusus mengatur jalannya reaksi biokimia dalam organisme hidup, sehingga mempengaruhi metabolisme.
Konsep katalisis
Inti dari fenomena kimia ini adalah untuk mengatur laju transformasi zat menggunakan reagen khusus yang dapat memperlambat atau mempercepat proses ini. Dalam hal ini, seseorang berbicara tentang katalisis positif atau negatif. Ada juga fenomena autokatalisis, ketika salah satu produk antara reaksi kimia mempengaruhi laju reaksi. Proses katalitik beragam, mereka berbeda dalam mekanisme, keadaan agregasi senyawa dan arah.
Zat yang memperlambat interaksi kimia disebut inhibitor, dan zat yang mempercepat reaksi katalitik disebut katalis. Keduanya dan lainnya mengubah laju reaksi melalui interaksi perantara berulang dengan satu atau lebih partisipannya. Pada saat yang sama, mereka tidak termasuk dalam komposisi produk dan dipulihkan setelah akhir siklus transformasi zat. Oleh karena itu, partisipasi katalis tidak tercermin dalam persamaan reaksi secara stoikiometri, tetapi hanya diindikasikan sebagai syarat terjadinya interaksi zat.
Jenis-jenis reaksi katalitik
Menurut keadaan agregasi zat yang mengambil bagian dalam reaksi kimia, ada:
- reaksi homogen - reaktan, produk dan katalis berada dalam keadaan agregasi (fase) yang sama, sedangkan molekul zat terdistribusi secara merata di seluruh volume;
- reaksi katalitik antarmuka - terjadi pada antarmuka cairan yang tidak dapat bercampur, dan peran katalis dikurangi menjadi transfer reagen melaluinya;
- reaksi katalitik heterogen - di dalamnya, katalis memiliki keadaan agregasi yang berbeda dari reagen, dan itu sendiri dilakukan pada antarmuka;
- reaksi heterogen-homogen - dimulai pada antarmuka dengan katalis, dan berlanjut dalam volume reaksi;
- reaksi mikroheterogen - partikel kecil dari katalis padat membentuk misel di seluruh volume fase cair.
Ada juga katalisis redoks, disertai dengan perubahan keadaan oksidasi katalis pada interaksi dengan reagen. Transformasi semacam itu disebut reaksi oksidasi dan reduksi katalitik. Yang paling umum dalam produksi kimia adalah oksidasi sulfur dioksida menjadi trioksida dalam produksi asam sulfat.

Jenis katalis
Menurut keadaan agregasi, katalis adalah cair (H 2 SO 4, H 3 RO 4), padat (Pt, V 2 O 5, Al 2 O 3) dan gas (BF 3).
Menurut jenis zat, katalis diklasifikasikan menjadi:
- logam - bisa murni, paduan, padat atau diendapkan pada dasar berpori (Fe, Pt, Ni, Cu);
- senyawa logam tipe M m E n - oksida yang paling umum adalah MgO, Al 2 O 3, MoO 3, dll.;
- asam dan basa - digunakan untuk reaksi katalitik asam-basa, ini bisa berupa asam Lewis, Bronsted, dll.;
- kompleks logam - kelompok ini juga mencakup garam dari logam transisi, seperti PdCl 2 , Ni(CO) 4 ;
- enzim (mereka juga enzim) adalah biokatalis yang mempercepat reaksi yang terjadi pada organisme hidup.
Menurut spesifikasi struktur elektronik, katalis d dibedakan, memiliki elektron d dan orbital d, serta katalis s, p, yang pusatnya adalah elemen dengan valensi s dan elektron p.

Sifat katalis
Agar dapat digunakan secara efektif, daftar persyaratan yang cukup luas diterapkan padanya, yang bervariasi untuk proses tertentu. Tetapi yang paling signifikan adalah dua sifat katalis berikut:
- Spesifisitas terletak pada kemampuan katalis untuk mempengaruhi hanya satu reaksi atau serangkaian transformasi serupa dan tidak mempengaruhi laju reaksi lainnya. Jadi, platinum paling sering digunakan dalam reaksi hidrogenasi organik.
- Selektivitas dicirikan oleh kemampuan untuk mempercepat salah satu dari beberapa kemungkinan reaksi paralel, sehingga meningkatkan hasil produk yang paling penting.
Laju reaksi katalitik
Alasan percepatan interaksi zat adalah pembentukan kompleks aktif dengan katalis, yang menyebabkan penurunan energi aktivasi.

Menurut postulat dasar kinetika kimia, laju reaksi kimia apa pun berbanding lurus dengan produk konsentrasi zat awal, yang diambil dalam pangkat yang sesuai dengan koefisien stoikiometrinya:
v = k C A x C B y C D z ,
di mana k adalah konstanta laju reaksi kimia, yang secara numerik sama dengan laju reaksi yang sama, asalkan konsentrasi senyawa awal adalah 1 mol/l.
Menurut persamaan Arrhenius, k tergantung pada energi aktivasi:
k \u003d A exp ^ (-E A / RT).
Keteraturan ini juga berlaku untuk reaksi katalitik. Ini dikonfirmasi oleh persamaan untuk rasio konstanta laju:
k K / k = A K /A exp^((E A -E AK)/RT),
di mana variabel dengan indeks K mengacu pada reaksi katalitik.
Tahapan reaksi katalitik
Untuk reaksi katalitik homogen, dua langkah utama sudah cukup:
- Pembentukan kompleks teraktivasi: A + K -> AA.
- Interaksi kompleks teraktivasi dengan zat awal lainnya: AA + B > C + K.
Dalam bentuk umum, persamaan bentuk A + B -> C ditulis.
Mekanisme reaksi katalitik heterogen sangat kompleks. Enam tahap berikut dibedakan:
- Membawa senyawa awal ke permukaan katalis.
- Adsorpsi reagen awal oleh permukaan katalis dan pembentukan kompleks antara: A + B + K > AVK.
- Aktivasi kompleks yang dihasilkan: VC > VC * .
- Penguraian senyawa kompleks, sedangkan produk yang terbentuk diadsorpsi oleh katalis: * > CDK.
- Desorpsi produk yang dihasilkan oleh permukaan katalis: CDK > C + D + K.
- Penghapusan produk dari katalis.

Contoh reaksi katalitik
Katalis digunakan tidak hanya dalam industri kimia. Setiap orang dalam kehidupan sehari-harinya dihadapkan pada berbagai reaksi katalitik. Ini, misalnya, penggunaan hidrogen peroksida dalam perawatan luka. Hidrogen peroksida, ketika berinteraksi dengan darah, mulai terurai di bawah pengaruh:
2H2O2 -> O2 + 2H2O.

Di mobil modern, dilengkapi dengan ruang katalitik khusus yang berkontribusi pada penguraian zat gas berbahaya. Misalnya, platinum atau rhodium membantu mengurangi polusi nitrogen oksida, yang terurai menjadi O 2 dan N 2 yang tidak berbahaya.
Beberapa pasta gigi mengandung enzim yang memecah plak dan sisa makanan.
Pada artikel ini, reaksi katalitik akan dipertimbangkan. Pembaca akan diperkenalkan dengan ide umum katalis dan efeknya pada sistem, dan jenis reaksi, fitur jalannya, dan banyak lagi akan dijelaskan.
Pengantar katalisis
Sebelum berkenalan dengan reaksi katalitik, ada baiknya mengetahui apa itu katalisis.
Ini adalah proses selektif untuk mempercepat arah reaksi tertentu yang diizinkan secara termodinamika yang terpapar katalis. Ini berulang kali termasuk dalam interaksi yang bersifat kimia, dan memiliki efek pada peserta dalam reaksi. Pada akhir setiap siklus yang bersifat peralihan, katalis melanjutkan bentuk aslinya. Konsep katalis diperkenalkan ke dalam sirkulasi oleh J. Barzelius dan Jens pada tahun 1835.

Informasi Umum
Katalisis tersebar luas di alam dan digunakan secara luas oleh manusia dalam industri teknologi. Jumlah dominan dari semua reaksi yang digunakan dalam industri adalah katalitik. Ada konsep autocatalysis - sebuah fenomena di mana akselerator bertindak sebagai produk reaksi atau merupakan bagian dari senyawa awal.
Semua jenis interaksi kimia zat yang bereaksi dibagi menjadi reaksi katalitik dan non-katalitik. Percepatan reaksi yang melibatkan katalis disebut katalisis positif. Perlambatan laju interaksi berlanjut dengan partisipasi inhibitor. Reaksi bersifat katalitik negatif.
Reaksi katalitik tidak hanya merupakan cara untuk meningkatkan produktivitas, tetapi juga merupakan peluang yang meningkatkan kualitas produk yang dihasilkan. Ini karena kemampuan zat yang dipilih secara khusus untuk mempercepat reaksi utama dan memperlambat kecepatan reaksi paralel.
Reaksi katalitik juga mengurangi biaya energi, yang menghabiskan peralatan. Hal ini disebabkan oleh fakta bahwa percepatan memungkinkan proses untuk berlangsung pada suhu yang lebih rendah, yang akan diperlukan tanpa itu.
Contoh reaksi katalitik adalah produksi hal-hal berharga seperti: asam nitrat, hidrogen, amonia, dll. Proses ini paling banyak digunakan dalam produksi aldehida, fenol, berbagai plastik, resin dan karet, dll.
Berbagai reaksi

Inti dari katalisis terletak pada transfer mekanisme reaksi ke opsi yang paling menguntungkan. Ini menjadi mungkin karena penurunan energi aktivasi.
Katalis membentuk ikatan kimia yang lemah dengan molekul reaktan tertentu. Hal ini memungkinkan untuk memfasilitasi reaksi dengan reagen lain. Zat-zat yang bersifat katalitik tidak mempengaruhi pergeseran kesetimbangan kimia, karena zat-zat tersebut bekerja secara reversibel di kedua arah.
Katalisis dibagi menjadi dua jenis utama: homogen dan heterogen. Ciri umum dari semua interaksi tipe pertama adalah adanya katalis dalam fase yang sama dengan reaktan dari reaksi itu sendiri. Tipe kedua berbeda dalam hal ini.
Reaksi katalitik homogen menunjukkan kepada kita bahwa akselerator, berinteraksi dengan zat tertentu, membentuk senyawa antara. Ini selanjutnya akan mengurangi jumlah energi yang dibutuhkan untuk aktivasi.
Katalisis heterogen mempercepat proses. Sebagai aturan, itu mengalir di permukaan benda padat. Akibatnya, kemampuan katalis dan aktivitasnya ditentukan oleh ukuran permukaan dan sifat individu. Reaksi katalitik heterogen memiliki mekanisme operasi yang lebih kompleks daripada reaksi homogen. Mekanismenya mencakup 5 tahap, yang masing-masing dapat dibalik.
Pada tahap pertama, difusi reagen yang berinteraksi ke area padatan dimulai, kemudian terjadi adsorpsi yang bersifat fisik, diikuti oleh kemisorpsi. Akibatnya, tahap ketiga terjadi, di mana reaksi mulai berlangsung antara molekul-molekul zat yang bereaksi. Pada tahap keempat, desorpsi produk diamati. Pada tahap kelima, terjadi difusi zat akhir ke dalam aliran umum dari bidang katalis.
bahan katalitik
Ada konsep pembawa katalis. Ini adalah bahan dari jenis inert atau aktif rendah, yang diperlukan untuk membawa partikel yang berpartisipasi dalam fase katalisis ke keadaan stabil.
Akselerasi heterogen diperlukan untuk mencegah terjadinya proses sintering dan aglomerasi komponen aktif. Dalam jumlah kasus yang berlaku, jumlah pembawa melebihi keberadaan komponen yang disimpan dari jenis aktif. Daftar utama persyaratan yang harus dimiliki pembawa mencakup luas permukaan dan porositas yang besar, stabilitas termal, kelembaman dan ketahanan terhadap tekanan mekanis.
Basis kimia. Kimia percepatan aliran interaksi antar zat memungkinkan kita untuk membedakan dua jenis zat, yaitu katalis dan inhibitor. Yang terakhir, pada gilirannya, memperlambat laju reaksi. Salah satu jenis katalis adalah enzim.
Katalis tidak berinteraksi secara stoikiometri dengan produk reaksi itu sendiri dan selalu diregenerasi pada akhirnya. Di zaman modern, ada banyak cara untuk mempengaruhi proses aktivasi molekuler. Namun, katalisis adalah dasar dari produksi kimia.
Sifat katalis memungkinkan mereka untuk dibagi menjadi homogen, heterogen, antarmuka, enzimatik, dan misel. Reaksi kimia dengan partisipasi katalis akan mengurangi energi yang dibutuhkan untuk aktivasinya. Misalnya, dekomposisi non-katalitik NH3 menjadi nitrogen dan hidrogen akan membutuhkan sekitar 320 kJ/mol. Reaksi yang sama, tetapi di bawah pengaruh platina, akan mengurangi angka ini menjadi 150 kJ/mol.
Proses hidrogenasi

Jumlah dominan reaksi yang melibatkan katalis didasarkan pada aktivasi atom hidrogen dan molekul tertentu, yang kemudian mengarah pada interaksi yang bersifat kimia. Fenomena ini disebut hidrogenasi. Ini mendasari sebagian besar tahapan penyulingan minyak dan pembuatan bahan bakar cair dari batu bara. Produksi yang terakhir dibuka di Jerman, karena kurangnya cadangan minyak di negara itu. Penciptaan bahan bakar semacam itu disebut proses Bergius. Ini terdiri dari kombinasi langsung hidrogen dan batu bara. Batubara mengalami pemanasan di bawah kondisi tekanan tertentu dan adanya hidrogen. Akibatnya, produk jenis cair terbentuk. Katalisnya adalah oksida besi. Namun terkadang zat yang berbahan dasar logam seperti molibdenum dan timah juga digunakan.
Ada cara lain untuk mendapatkan bahan bakar yang sama, yang disebut proses Fischer-Tropsch. Ini terdiri dari dua tahap. Pada tahap pertama, batubara mengalami gasifikasi dengan memperlakukannya dengan interaksi uap air dan O 2 . Reaksi ini mengarah pada pembentukan campuran hidrogen dan karbon monoksida. Selanjutnya, dengan bantuan katalis, campuran yang dihasilkan dipindahkan ke keadaan bahan bakar cair.
Hubungan antara keasaman dan kapasitas katalitik

Reaksi katalitik adalah fenomena yang bergantung pada sifat asam dari katalis itu sendiri. Sesuai dengan definisi J. Bronsted, asam adalah zat yang dapat menyumbangkan proton. Asam kuat akan dengan mudah mendonorkan protonnya ke basa. G. Lewis mendefinisikan asam sebagai zat yang mampu menerima pasangan elektron dari zat donor dan, sebagai hasilnya, membentuk ikatan kovalen. Kedua ide ini memungkinkan manusia untuk menentukan esensi dari mekanisme katalisis.
Kekuatan asam ditentukan dengan menggunakan set basa yang dapat berubah warna karena penambahan proton. Beberapa agen katalitik yang digunakan dalam industri dapat berperilaku seperti asam yang sangat kuat. Kekuatan mereka menentukan laju protonasi, dan karena itu merupakan karakteristik yang sangat penting.
Aktivitas asam katalis disebabkan oleh kemampuannya untuk bereaksi dengan hidrokarbon, sehingga membentuk produk antara - ion karbenium.
Proses dehidrogenasi
Dehidrogenasi juga merupakan reaksi katalitik. Ini sering digunakan di berbagai industri. Terlepas dari kenyataan bahwa proses katalitik berdasarkan dehidrogenasi digunakan lebih jarang daripada reaksi hidrogenasi, mereka tetap menempati tempat penting dalam aktivitas manusia. Contoh dari jenis reaksi katalitik ini adalah produksi stirena, monomer penting. Pertama-tama, dehidrogenasi etilbenzena terjadi dengan partisipasi zat yang mengandung oksida besi. Manusia sering menggunakan fenomena ini untuk mendehidrogenasi banyak alkana.
aksi ganda

Ada katalis kerja ganda yang mampu mempercepat dua jenis reaksi sekaligus. Akibatnya, mereka menghasilkan hasil yang lebih baik, dibandingkan dengan melewatkan reaktan secara bergantian melalui 2 reaktor yang hanya berisi satu jenis katalis. Ini disebabkan oleh fakta bahwa situs aktif dari akselerator aksi ganda berada dalam posisi dekat dengan situs serupa lainnya, serta dengan produk antara. Hasil yang baik dicapai, misalnya, dengan menggabungkan katalis yang mengaktifkan hidrogen dengan zat yang memungkinkan proses isomerisasi hidrokarbon berlangsung. Aktivasi sering dilakukan oleh logam, dan isomerisasi berlangsung dengan partisipasi asam.
Spesifisitas reaksi katalitik utama
Kemampuan dan efisiensi katalis juga ditentukan oleh sifat dasarnya. Contoh mencolok adalah natrium hidroksida, yang digunakan selama hidrolisis lemak untuk menghasilkan sabun. Jenis katalis ini juga digunakan dalam produksi lembaran busa dan poliuretan. Uretan diperoleh selama interaksi alkohol dan isosianat. Percepatan reaksi terjadi ketika terkena amina dasar tertentu. Basa melekat pada atom karbon yang terkandung dalam molekul isosianat. Akibatnya, atom nitrogen menjadi bermuatan negatif. Hal ini menyebabkan peningkatan aktivitas dalam kaitannya dengan alkohol.
Polimerisasi stereospesifik

Sejarah penting yang besar dalam sejarah studi katalisis adalah penemuan polimerisasi olefin diikuti oleh produksi zat polimer stereoregular. Penemuan katalis, yang ditandai dengan polimerisasi stereospesifik, milik K. Ziegler. Karya Ziegler pada produksi polimer menarik minat J. Natta, yang menyarankan bahwa keunikan polimer harus ditentukan oleh stereoregularitasnya. Sejumlah besar percobaan yang melibatkan sinar-X yang mengalami difraksi telah membuktikan bahwa polimer yang diperoleh dari propilena di bawah pengaruh katalis Ziegler sangat kristalin. Efek dari tindakan tersebut bersifat stereoreguler.
Reaksi jenis ini berlangsung pada bidang katalis padat yang mengandung logam transisi, seperti Ti, Cr, V, Zr. Mereka harus dalam oksidasi tidak lengkap. Persamaan untuk reaksi katalitik antara TiCl 4 yang berinteraksi dan Al (C 2 H 5) 3 , di mana endapan terbentuk, adalah contoh nyata dari hal ini. Di sini, titanium direduksi menjadi keadaan 3-valent. Jenis sistem aktif ini memungkinkan untuk mempolimerisasi propilena dalam kondisi suhu dan tekanan normal.
Oksidasi dalam reaksi katalitik
Reaksi oksidasi katalitik banyak digunakan oleh manusia, karena kemampuan zat tertentu untuk mengatur laju reaksi itu sendiri. Beberapa aplikasi memerlukan oksidasi lengkap, seperti netralisasi CO dan kontaminan yang mengandung hidrokarbon. Namun, sebagian besar reaksi membutuhkan oksidasi tidak lengkap. Ini diperlukan untuk mendapatkan produk antara yang bernilai industri, tetapi mungkin mengandung kelompok perantara yang spesifik dan penting: COOH, CN, CHO, C-CO. Dalam hal ini, seseorang menggunakan jenis katalis heterogen dan monogenik.
Di antara semua zat yang mampu mempercepat jalannya reaksi kimia, tempat penting diberikan kepada oksida. Sebagian besar dalam keadaan padat. Proses oksidasi dibagi menjadi 2 tahap. Pada tahap pertama, oksida oksigen ditangkap oleh molekul hidrokarbon dari oksida yang teradsorpsi. Akibatnya, oksida berkurang dan hidrokarbon teroksidasi. Oksida yang diperbarui berinteraksi dengan O2 dan kembali ke keadaan semula.
Sejumlah besar enzim sudah pada awal abad ke-20 mengajukan pertanyaan kepada para peneliti tentang nomenklatur dan klasifikasi enzim. Ciri khas enzim pada awal abad ke-20 adalah akhiran "aza", yang digunakan dengan menambahkannya terlebih dahulu ke nama substrat (amilum - pati - amilase), dan kemudian ke nama reaksi ( dehidrogenasi - dehidrogenase). Commission on Enzymes (EC), yang dibentuk oleh International Union of Chemists and Biochemists, mengembangkan prinsip dasar untuk klasifikasi dan tata nama enzim, yang diadopsi pada tahun 1961. Klasifikasi ini didasarkan pada jenis reaksi yang dikatalisis oleh enzim. Semua enzim atas dasar ini dibagi menjadi 6 kelas yang masing-masing memiliki beberapa subkelas.
1. Oksidoreduktase - enzim yang mengkatalisis reaksi reduksi atau oksidasi. Contohnya adalah alkohol dehidrogenase, enzim yang mengoksidasi etil alkohol menjadi asetaldehida. Enzim kedua yang dikenal sebagai aldehid dehidrogenase kemudian mengubah asetaldehida menjadi asetil KoA. Oksidoreduktase sering membutuhkan partisipasi kofaktor yang bertindak sebagai akseptor hidrogen perantara dalam contoh di bawah ini, ini adalah NAD + .
 Oksidase - jenis oksidoreduktase. Ini adalah nama yang diberikan untuk enzim yang menggunakan oksigen sebagai akseptor hidrogen terakhir. Contohnya adalah glukosa oksidase, yang mengoksidasi glukosa menjadi asam glukonat. .
FAD berfungsi sebagai akseptor hidrogen perantara.
Oksidase - jenis oksidoreduktase. Ini adalah nama yang diberikan untuk enzim yang menggunakan oksigen sebagai akseptor hidrogen terakhir. Contohnya adalah glukosa oksidase, yang mengoksidasi glukosa menjadi asam glukonat. .
FAD berfungsi sebagai akseptor hidrogen perantara.
2. Transferase - enzim yang mentransfer gugus fungsi dari molekul donor ke molekul akseptor. Contohnya adalah metiltransferase, yang mentransfer gugus metil dari S-adenosilmetionin ke akseptor. Diperlihatkan di bawah ini adalah reaksi yang dikatalisis oleh katekol-O-metiltransferase, suatu enzim yang terlibat dalam metabolisme neurotransmiter epinefrin dan norepinefrin. .

Contoh lain yang sangat penting dari transferase adalah enzim yang mengkatalisis transfer gugus amino dari -transaminase.
Transaminase menggunakan asam amino sebagai donor gugus amino, yang mereka transfer ke asam -keto, mengubah asam amino donor menjadi asam -keto dan asam keto akseptor menjadi asam amino, masing-masing. Ini digunakan untuk mengubah asam amino tertentu dan memungkinkan asam amino masuk ke jalur karbohidrat atau lipid.
Transferase yang akan sering disebutkan dalam biokimia adalah kinase yang mengkatalisis transfer fosfat dari molekul ATP berenergi tinggi ke substrat. Ada banyak kinase yang memainkan peran penting dalam metabolisme sel.
3. Hidrolase-enzim yang mengkatalisis reaksi biologis hidrolisis. Mereka memutuskan ikatan kovalen. menempelkan elemen air pada titik pecahnya. Lipase, fosfatase, asetilkolinesterase, dan protease adalah contoh enzim hidrolitik.
4. Liase (desmolase)- enzim yang mengkatalisis pemecahan ikatan C-C, C-O dan C-N secara non-hidrolitik dengan pembentukan ikatan rangkap. Contohnya adalah enzim DOPA dekarboksilase, yang merupakan enzim kunci dalam sintesis amina biogenik epinefrin dan norepinefrin.

5. Isomerase- enzim yang mengkatalisis penataan ulang intramolekul. Dalam hal ini, interkonversi isomer geometris optik dan posisi terjadi. Epimerase dan racemase adalah contoh dari kelas enzim ini.
6. Ligase mengkatalisis pembentukan ikatan C-O, C-S, C-N atau C-C menggunakan energi hidrolisis ATP. Fosfat mungkin atau mungkin tidak terikat secara kovalen dengan produk reaksi.
Komisi Enzim juga mengusulkan prinsip-prinsip tata nama enzim. Disarankan untuk menggunakan tata nama yang sistematis dan bekerja. Tatanama sistematis didasarkan pada prinsip yang sama seperti untuk klasifikasi - jenis reaksi yang dikatalisis. Sepintas, namanya menjadi rumit, tetapi dari namanya menjadi jelas apa yang dilakukan enzim. Nama terdiri dari dua bagian: nama peserta dalam reaksi (tergantung pada kelas, ini dapat berupa substrat, akseptor perantara) dan jenis reaksi yang dikatalisis dengan akhiran "aza".
Setiap enzim menerima nomor kode enzim tertentu, yang mencerminkan posisinya dalam klasifikasi: digit pertama mencirikan kelas enzim, yang kedua subkelas a, dan subkelas ketiga. Setiap sub-subclass adalah daftar enzim. Nomor urut enzim dalam daftar ini adalah digit keempat dari kode. Gambar 1-1 menunjukkan kode untuk creatine phosphokinase - CP.2.7.3.2. Enzim ini mengkatalisis reaksi fosforilasi kreatin. Nama sistematis untuk enzim ATP adalah creatine phosphotransferase. Nama kerja enzim ini adalah creatine kinase atau creatine phokinase.
R  adalah 2-1. Kode creatine phosphokinase dan tempat enzim dalam klasifikasi enzim
adalah 2-1. Kode creatine phosphokinase dan tempat enzim dalam klasifikasi enzim
Laju reaksi kimia dapat meningkat secara dramatis dengan adanya berbagai zat yang bukan reaktan dan bukan bagian dari produk reaksi. Fenomena luar biasa ini disebut katalisis(dari bahasa Yunani "katalisis" - penghancuran). Zat yang mempercepat laju reaksi dalam campuran disebut katalisator. Jumlahnya sebelum dan sesudah reaksi tetap tidak berubah. Katalis tidak mewakili kelas khusus zat apa pun. Dalam berbagai reaksi, logam, oksida, asam, garam, dan senyawa kompleks dapat menunjukkan efek katalitik. Reaksi kimia dalam sel hidup berlangsung di bawah kendali protein katalitik yang disebut enzim. Katalisis harus dianggap sebagai faktor kimia sejati dalam meningkatkan laju reaksi kimia, karena katalis terlibat langsung dalam reaksi. Katalisis seringkali lebih kuat dan kurang berisiko dalam mempercepat reaksi daripada menaikkan suhu. Ini jelas dimanifestasikan dalam contoh reaksi kimia pada organisme hidup. Reaksi-reaksi, seperti hidrolisis protein, yang di laboratorium harus dilakukan dengan pemanasan berkepanjangan sampai titik didih, dalam proses pencernaan berlangsung tanpa pemanasan pada suhu tubuh.
Untuk pertama kalinya, fenomena katalisis diamati oleh ahli kimia Prancis L. J. Tenard (1777-1857) pada tahun 1818. Ia menemukan bahwa oksida logam tertentu, ketika hidrogen peroksida ditambahkan ke larutan, menyebabkan dekomposisi. Pengalaman seperti itu mudah direproduksi dengan menambahkan kristal kalium permanganat ke dalam larutan hidrogen peroksida 3%. Garam KMp0 4 berubah menjadi Mn0 2, dan oksigen dengan cepat dilepaskan dari larutan di bawah aksi oksida:
Efek langsung katalis pada laju reaksi dikaitkan dengan penurunan energi aktivasi. Pada penurunan suhu normal? dan sebesar 20 kJ/mol meningkatkan konstanta laju sekitar 3000 kali. menurunkan E L mungkin jauh lebih kuat. Namun, penurunan energi aktivasi merupakan manifestasi eksternal dari aksi katalis. Reaksi ditandai dengan nilai tertentu E. v yang hanya dapat berubah jika reaksi itu sendiri berubah. Memberikan produk yang sama, reaksi dengan partisipasi zat yang ditambahkan berlangsung di sepanjang jalur yang berbeda, melalui tahap yang berbeda dan dengan energi aktivasi yang berbeda. Jika energi aktivasi lebih rendah pada jalur baru ini dan reaksi lebih cepat, maka kita mengatakan bahwa zat ini adalah katalis.
Katalis berinteraksi dengan salah satu reaktan, membentuk beberapa senyawa antara. Pada salah satu tahap reaksi selanjutnya, katalis diregenerasi - ia meninggalkan reaksi dalam bentuk aslinya. Reagen, berpartisipasi dalam reaksi katalitik, terus berinteraksi satu sama lain dan sepanjang jalur lambat tanpa partisipasi katalis. Oleh karena itu, reaksi katalitik termasuk dalam berbagai reaksi kompleks yang disebut seri-paralel. pada gambar. 11.8 menunjukkan ketergantungan konstanta laju pada konsentrasi katalis. Grafik ketergantungan tidak melewati nol, karena tanpa adanya katalis, reaksi tidak berhenti.

Beras. 11.8.
konstanta yang dapat diamati k dinyatakan sebagai jumlah k u+ & k c(k)
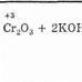
Contoh 11.5. Pada suhu -500 °C, reaksi oksidasi sulfur oksida (IV)
yang merupakan salah satu tahapan produksi industri asam sulfat, sangat lambat. Peningkatan suhu lebih lanjut tidak dapat diterima, karena kesetimbangan bergeser ke kiri (reaksi eksotermik) dan hasil produk turun terlalu banyak. Tetapi reaksi ini dipercepat oleh berbagai katalis, salah satunya mungkin nitrat oksida (II). Pertama, katalis bereaksi dengan oksigen: ![]()
dan kemudian mentransfer atom oksigen ke sulfur oksida (IV):
Dengan demikian, produk akhir reaksi terbentuk dan katalis diregenerasi. Untuk reaksi, kemungkinan mengalir di sepanjang jalur baru dibuka, di mana konstanta laju meningkat secara signifikan:

Diagram di bawah menunjukkan kedua jalur proses oksidasi S0 2. Dengan tidak adanya katalis, reaksi hanya berlangsung sepanjang jalur lambat, dan dengan adanya katalis, di sepanjang keduanya.
Ada dua jenis katalisis - homogen dan heterogen. Dalam kasus pertama, katalis dan reagen membentuk sistem homogen dalam bentuk campuran gas atau larutan. Contoh oksidasi sulfur oksida adalah katalisis homogen. Laju reaksi katalitik homogen bergantung pada konsentrasi reaktan dan konsentrasi katalis.
Dalam katalisis heterogen, katalis adalah padatan dalam bentuk murni atau didukung pada pembawa. Misalnya, platinum sebagai katalis dapat diperbaiki pada asbes, alumina, dll. Molekul reagen diadsorpsi (diserap) dari gas atau larutan pada titik-titik tertentu pada permukaan katalis - pusat aktif dan diaktifkan pada saat yang bersamaan. Setelah transformasi kimia, molekul produk yang dihasilkan didesorbsi dari permukaan katalis. Tindakan transformasi partikel diulang di pusat aktif. Di antara faktor-faktor lain, laju reaksi katalitik heterogen tergantung pada luas permukaan bahan katalitik.
Katalisis heterogen sangat banyak digunakan dalam industri. Hal ini disebabkan kemudahan melakukan proses katalitik kontinyu dengan melewatkan campuran reaktan melalui peralatan kontak dengan katalis.
Katalis bertindak secara selektif, mempercepat jenis reaksi yang sangat spesifik atau bahkan satu reaksi tanpa mempengaruhi yang lain. Hal ini memungkinkan penggunaan katalis tidak hanya untuk mempercepat reaksi, tetapi juga untuk secara sengaja mengubah bahan awal menjadi produk yang diinginkan. Metana dan air pada 450 ° C pada katalis Fe 2 0 3 diubah menjadi karbon dioksida dan hidrogen:
Zat yang sama pada 850 °C bereaksi pada permukaan nikel untuk membentuk karbon monoksida (II) dan hidrogen:

Katalisis termasuk dalam bidang kimia yang belum memungkinkan untuk membuat prediksi teoretis yang akurat. Semua katalis industri untuk pemrosesan produk minyak bumi, gas alam, produksi amonia dan banyak lainnya telah dikembangkan berdasarkan studi eksperimental yang melelahkan dan panjang.
Kemampuan untuk mengontrol kecepatan proses kimia sangat penting dalam kegiatan ekonomi manusia. Dalam produksi industri produk kimia, biasanya diperlukan untuk meningkatkan laju proses kimia teknologi, dan dalam penyimpanan produk, diperlukan untuk mengurangi laju dekomposisi atau paparan oksigen, air, dll. Diketahui zat yang dapat memperlambat reaksi kimia. Mereka disebut penghambat, atau katalis negatif. Inhibitor berbeda secara mendasar dari katalis nyata dalam hal mereka bereaksi dengan spesies aktif (radikal bebas) yang, karena satu dan lain alasan, muncul dalam suatu zat atau lingkungannya dan menyebabkan dekomposisi dan reaksi oksidasi yang berharga. Inhibitor dikonsumsi secara bertahap, mengakhiri tindakan perlindungannya. Jenis inhibitor yang paling penting adalah antioksidan, yang melindungi berbagai bahan dari efek oksigen.
Itu juga harus diingatkan tentang apa yang tidak dapat dicapai dengan bantuan katalis. Mereka hanya mampu mempercepat reaksi spontan. Jika reaksi tidak berlangsung secara spontan, maka katalis tidak akan dapat mempercepatnya. Misalnya, tidak ada katalis yang dapat menyebabkan air terurai menjadi hidrogen dan oksigen. Proses ini hanya dapat dilakukan dengan elektrolisis, sambil menghabiskan pekerjaan listrik.
Katalis juga dapat mengaktifkan proses yang tidak diinginkan. Dalam beberapa dekade terakhir, telah terjadi perusakan lapisan ozon atmosfer secara bertahap pada ketinggian 20-25 km. Diasumsikan bahwa beberapa zat terlibat dalam peluruhan ozon, misalnya, hidrokarbon terhalogenasi yang dipancarkan ke atmosfer oleh perusahaan industri, serta digunakan untuk keperluan rumah tangga.
S.I. LEVCHENKOV
KIMIA FISIKA DAN KOLOID
Abstrak kuliah untuk mahasiswa Fakultas Biologi Universitas Federal Selatan (RSU)
2.3 PROSES KATALITIK
Laju reaksi kimia pada suhu tertentu ditentukan oleh laju pembentukan kompleks teraktivasi, yang bergantung pada nilai energi aktivasi. Dalam banyak reaksi kimia, struktur kompleks teraktivasi dapat mencakup zat yang secara stoikiometri bukan reaktan; Jelas, dalam hal ini, nilai energi aktivasi proses juga berubah. Dalam kasus adanya beberapa keadaan transisi, reaksi akan berlangsung terutama di sepanjang jalur dengan penghalang aktivasi terendah.
Katalisis adalah fenomena perubahan laju reaksi kimia dengan adanya zat yang keadaan dan kuantitasnya tetap tidak berubah setelah reaksi.
Membedakan positif dan negatif katalisis (masing-masing, peningkatan dan penurunan laju reaksi), meskipun seringkali istilah "katalisis" hanya berarti katalisis positif; katalisis negatif disebut inhibisi.
Suatu zat yang merupakan bagian dari struktur kompleks teraktivasi, tetapi secara stoikiometri bukan merupakan reaktan, disebut katalis. Semua katalis dicirikan oleh sifat umum seperti spesifisitas dan selektivitas aksi.
Kekhususan Katalis terletak pada kemampuannya untuk mempercepat hanya satu reaksi atau sekelompok reaksi yang sejenis dan tidak mempengaruhi laju reaksi lainnya. Misalnya, banyak logam transisi (platinum, tembaga, nikel, besi, dll.) merupakan katalis untuk proses hidrogenasi; aluminium oksida mengkatalisis reaksi hidrasi, dll.
Selektivitas katalis - kemampuan untuk mempercepat salah satu reaksi paralel yang mungkin terjadi dalam kondisi tertentu. Karena itu, dimungkinkan, dengan menggunakan katalis yang berbeda, untuk mendapatkan produk yang berbeda dari bahan awal yang sama:
|
: CO + H2 ––> CH3OH |
: C 2 H 5 OH --> C 2 H 4 + H 2 O |
|
: CO + H 2 --> CH 4 + H 2 O |
: C 2 H 5 OH --> CH 3 CHO + H 2 |
Alasan peningkatan laju reaksi dengan katalisis positif adalah penurunan energi aktivasi ketika reaksi berlangsung melalui kompleks teraktivasi dengan partisipasi katalis (Gbr. 2.8).
Karena, menurut persamaan Arrhenius, konstanta laju reaksi kimia bergantung secara eksponensial pada energi aktivasi, penurunan energi aktivasi menyebabkan peningkatan yang signifikan dalam konstanta laju. Memang, jika kita mengasumsikan bahwa faktor pra-eksponensial dalam persamaan Arrhenius (II.32) untuk reaksi katalitik dan non-katalitik adalah dekat, maka untuk rasio konstanta laju kita dapat menulis:
Jika E A = –50 kJ/mol, maka rasio konstanta laju akan menjadi 2,7·10 6 kali (memang, dalam praktiknya, penurunan E A seperti itu meningkatkan laju reaksi sekitar 105 kali).
Perlu dicatat bahwa keberadaan katalis tidak mempengaruhi besarnya perubahan potensial termodinamika sebagai akibat dari proses dan, oleh karena itu, tidak ada katalis yang dapat membuat proses yang tidak mungkin secara termodinamika menjadi spontan (dari proses yang G (ΔF) lebih besar dari nol). Katalis tidak mengubah nilai konstanta kesetimbangan untuk reaksi reversibel; efek katalis dalam hal ini hanya terdiri dari percepatan pencapaian keadaan setimbang.
Tergantung pada keadaan fase reaktan dan katalis, katalisis homogen dan heterogen dibedakan.

Beras. 2.8 Diagram energi reaksi kimia tanpa katalis (1)
dan dengan adanya katalis (2).
2.3.1 Katalisis homogen.
Katalisis homogen adalah reaksi katalitik di mana reaktan dan katalis berada dalam fase yang sama. Dalam kasus proses katalitik homogen, katalis membentuk produk reaktif antara dengan reagen. Pertimbangkan beberapa reaksi
A + B ––> C
Dengan adanya katalis, dua langkah cepat dilakukan, menghasilkan pembentukan partikel senyawa antara AA dan kemudian (melalui kompleks teraktivasi AVK #) produk reaksi akhir dengan regenerasi katalis:
A + K ––> AK
AK + V --> C + K
Contoh dari proses tersebut adalah penguraian asetaldehida, yang energi aktivasinya adalah E A = 190 kJ/mol:
CH 3 CHO --> CH 4 + CO
Dengan adanya uap yodium, proses ini berlangsung dalam dua tahap:
CH 3 CHO + I 2 ––> CH 3 I + HI + CO
CH 3 I + HI --> CH 4 + I 2
Penurunan energi aktivasi reaksi ini dengan adanya katalis adalah 54 kJ/mol; dalam hal ini, konstanta laju reaksi meningkat kira-kira dengan faktor 105. Jenis katalisis homogen yang paling umum adalah katalisis asam, di mana ion hidrogen H + bertindak sebagai katalis.
2.3.2 Autokatalisis.
Autokatalisis- proses percepatan katalitik reaksi kimia oleh salah satu produknya. Contohnya adalah hidrolisis ester yang dikatalisis oleh ion hidrogen. Asam yang terbentuk selama hidrolisis berdisosiasi dengan pembentukan proton, yang mempercepat reaksi hidrolisis. Ciri reaksi autokatalitik adalah bahwa reaksi ini berlangsung dengan peningkatan konstan dalam konsentrasi katalis. Oleh karena itu, pada periode awal reaksi, lajunya meningkat, dan pada tahap selanjutnya, sebagai akibat dari penurunan konsentrasi reagen, laju mulai menurun; kurva kinetik dari produk reaksi autokatalitik memiliki karakteristik berbentuk S (Gbr. 2.9).

Beras. 2.9 Kurva kinetik produk reaksi autokatalitik
2.3.3 Katalisis heterogen.
katalisis heterogen - reaksi katalitik yang terjadi pada antarmuka antara fase yang dibentuk oleh katalis dan reaktan. Mekanisme proses katalitik heterogen jauh lebih rumit daripada dalam kasus katalisis homogen. Dalam setiap reaksi katalitik heterogen, setidaknya enam tahap dapat dibedakan:
1. Difusi bahan awal ke permukaan katalis.
2. Adsorpsi bahan awal pada permukaan dengan pembentukan beberapa senyawa antara:
A + B + K --> AVK
3. Aktivasi keadaan teradsorpsi (energi yang dibutuhkan untuk ini adalah energi aktivasi sebenarnya dari proses):
AVK ––> AVK#
4. Dekomposisi kompleks teraktivasi dengan pembentukan produk reaksi teradsorpsi:
ABK# ––> CDK
5. Desorpsi produk reaksi dari permukaan katalis.
DК ––> + D +
6. Difusi produk reaksi dari permukaan katalis.
Fitur khusus dari proses heterokatalitik adalah kemampuan katalis untuk dipromosikan dan diracuni.
Promosi– peningkatan aktivitas katalis dengan adanya zat yang bukan katalis dari proses ini (promotor). Misalnya, untuk reaksi yang dikatalisis oleh logam nikel
CO + H2 --> CH4 + H2O
pengenalan sedikit pengotor serium ke dalam katalis nikel menyebabkan peningkatan tajam dalam aktivitas katalis.
Peracunan- penurunan tajam dalam aktivitas katalis dengan adanya zat tertentu (disebut racun katalitik). Misalnya, untuk reaksi sintesis amonia (katalis - besi spons), adanya senyawa oksigen atau belerang dalam campuran reaksi menyebabkan penurunan tajam aktivitas katalis besi; pada saat yang sama, kemampuan katalis untuk mengadsorbsi zat awal menurun sangat sedikit.
Untuk menjelaskan fitur-fitur proses katalitik heterogen ini, G. Taylor membuat asumsi berikut: tidak seluruh permukaan katalis aktif secara katalitik, tetapi hanya beberapa bagiannya - yang disebut. pusat aktif , yang dapat berupa berbagai cacat pada struktur kristal katalis (misalnya, tonjolan atau lekukan pada permukaan katalis). Saat ini, tidak ada teori terpadu tentang katalisis heterogen. Untuk katalis logam, a teori multiplet . Ketentuan utama dari teori multiplet adalah sebagai berikut:
1. Pusat aktif katalis adalah himpunan sejumlah pusat adsorpsi yang terletak pada permukaan katalis secara geometrik sesuai dengan struktur molekul yang mengalami transformasi.
2. Ketika molekul yang bereaksi diadsorpsi pada pusat aktif, kompleks multiplet terbentuk, sebagai akibatnya ikatan didistribusikan kembali, yang mengarah pada pembentukan produk reaksi.
Teori kelipatan kadang-kadang disebut teori kesamaan geometris antara pusat aktif dan molekul yang bereaksi. Untuk reaksi yang berbeda, jumlah pusat adsorpsi (masing-masing diidentifikasi dengan atom logam) di pusat aktif berbeda - 2, 3, 4, dll. Pusat aktif semacam itu disebut masing-masing doublet, triplet, quadruplet, dll. (dalam kasus umum, sebuah multiplet, yang teori berutang namanya).
Misalnya, menurut teori kelipatan, dehidrogenasi alkohol monohidrat jenuh terjadi pada doublet, dan dehidrogenasi sikloheksana - pada sextet (Gbr. 2.10 - 2.11); Teori multiplet memungkinkan untuk menghubungkan aktivitas katalitik logam dengan jari-jari atomnya.
 Beras. 2.10 Dehidrogenasi alkohol pada doublet
Beras. 2.10 Dehidrogenasi alkohol pada doublet
 Beras. 2.11 Dehidrogenasi sikloheksana pada sextet
Beras. 2.11 Dehidrogenasi sikloheksana pada sextet
2.3.4 Katalisis enzimatik.
Katalisis enzimatik - reaksi katalitik yang terjadi dengan partisipasi enzim - katalis biologis dari sifat protein. Katalisis enzimatik memiliki dua fitur karakteristik:
1. aktivitas tinggi , yang beberapa kali lipat lebih tinggi daripada aktivitas katalis anorganik, yang dijelaskan oleh penurunan yang sangat signifikan dalam energi aktivasi proses oleh enzim. Jadi, konstanta laju reaksi penguraian hidrogen peroksida yang dikatalisis oleh ion Fe 2+ adalah 56 s -1 ; konstanta laju reaksi yang sama yang dikatalisis oleh enzim katalase adalah 3,5·10 7 , yaitu reaksi dengan adanya enzim berlangsung satu juta kali lebih cepat (energi aktivasi proses masing-masing adalah 42 dan 7,1 kJ/mol). Konstanta laju hidrolisis urea dengan adanya asam dan urease berbeda tiga belas kali lipat, sebesar 7,4·10 -7 dan 5·10 6 s -1 (energi aktivasi masing-masing adalah 103 dan 28 kJ/mol).
2. Spesifisitas tinggi . Misalnya, amilase mengkatalisis pemecahan pati, yang merupakan rantai unit glukosa yang identik, tetapi tidak mengkatalisis hidrolisis sukrosa, yang molekulnya terdiri dari fragmen glukosa dan fruktosa.
Menurut gagasan yang diterima secara umum tentang mekanisme katalisis enzimatik, substrat S dan enzim F berada dalam kesetimbangan dengan kompleks enzim-substrat FS yang terbentuk sangat cepat, yang terurai relatif lambat menjadi produk reaksi P dengan pelepasan enzim bebas; dengan demikian, tahap penguraian kompleks enzim-substrat menjadi produk reaksi adalah penentu laju (limiting).
F+S<––>FS ––> F+P
Studi tentang ketergantungan laju reaksi enzimatik pada konsentrasi substrat pada konsentrasi konstan enzim menunjukkan bahwa dengan peningkatan konsentrasi substrat, laju reaksi pertama meningkat dan kemudian berhenti berubah (Gbr. 1). 2.12) dan ketergantungan laju reaksi pada konsentrasi substrat dijelaskan oleh persamaan berikut:
 (II.45)
(II.45)