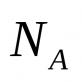Titrasi kimia. Analisis titrimetri. Persyaratan untuk reaksi titrasi
Kuliah 7. Metode analisis titrimetri.
1. Inti dari metode analisis titrimetri
2. Klasifikasi metode analisis titrimetri
3. Perhitungan dalam titrimetri. Solusi standar dan bekerja
4. Kesalahan metode titrimetri
5. Konstruksi kurva titrasi.
Metode analisis titrimetri didasarkan pada fakta bahwa zat bereaksi satu sama lain dalam jumlah yang setara:
di manan1 dann2 jumlah zat 1 dan 2, [ n ]= mol
di manaCkonsentrasi ekivalen molar;Vvolume larutan [V]= l
Kemudian, untuk dua zat yang bereaksi secara stoikiometri, hubungannya benar:
Analisis titrimetri adalah metode untuk menentukan jumlah suatu zat dengan mengukur secara akurat volume larutan zat yang bereaksi satu sama lain.
Titer- jumlah g zat yang terkandung dalam 1 ml larutan atau setara dengan zat yang akan ditentukan. Misalnya, jika titer H2SO4 adalah 0,0049 g/ml, ini berarti setiap ml larutan mengandung 0,0049 g asam sulfat.
Larutan yang titernya diketahui disebut larutan titrasi. Titrasi- proses penambahan ke dalam larutan uji atau alikuot sejumlah ekivalen dari larutan yang dititrasi. Dalam hal ini, larutan standar digunakan - larutan dengan konsentrasi zat yang tepat (Na2CO3, HCl).
Reaksi titrasi harus memenuhi persyaratan berikut:
1) Reaksi harus berlangsung secara kuantitatif, harus benar-benar stoikiometrik
2) Reaksi harus berlangsung dengan kecepatan tinggi;
3) Reaksi harus berlangsung sampai akhir, tidak boleh ada proses yang saling bersaing;
4) Untuk reaksi tertentu, harus ada cara yang tepat untuk menentukan akhir reaksi (titik ekivalen).
Contoh titrasi asam basa :
HCl + NaOH → NaCl + H2O (indikator jingga metil)
Klasifikasi metode analisis titrimetri.
Metode analisis titrimetri dapat diklasifikasikan menurut beberapa kriteria. Misalnya, menurut jenis reaksi utama yang terjadi selama titrasi:
1) titrasi asam basa (netralisasi): H3O + + OH - 2H2O
metode ini menentukan jumlah asam atau alkali dalam larutan yang dianalisis;
a) asidimetri
b) alkalimetri
2) titrasi redoks (redoksimetri):
Ox1 + Red2 Ox2 + Red1
a) permanganatometri (KMnO4);
b) iodometri (I2);
c) bromatometri (KBrO3);
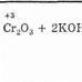
d) dikromatometri (K2Cr2O7);
e) cerimetri (Ce(SO4)2);
f) vanadometri (NH4VO3);
g) titanometri (TiCl3), dll.
3) titrasi pengendapan: Me + X MeX↓
a) argentometri Ag+ + Cl - "AgCl $
b) Merkurometri
4) titrasi kompleksometri Mem+ + nL m+
a) merkuri
b) kompleksometri (EDTA)
Tugas utama analisis titrimetri tidak hanya menggunakan larutan yang konsentrasinya diketahui secara pasti, tetapi juga menentukan titik ekivalen dengan benar. Ada beberapa cara untuk memperbaiki titik ekivalen:
1. Menurut warna ion dari unsur yang ditentukan, misalnya, ion permanganat MNO4 - memiliki warna merah
2. Dengan bantuan indikator, misalnya, indikator asam-basa digunakan dalam reaksi netralisasi: lakmus, fenolftalein, metil oranye - senyawa organik yang berubah warna ketika berpindah dari lingkungan asam ke basa.
Indikator- pewarna organik yang berubah warna ketika keasaman medium berubah. Secara skematis (menghilangkan bentuk antara), kesetimbangan indikator dapat direpresentasikan sebagai reaksi asam-basa
HIn + H2O Dalam - + H3O +
Area transisi warna indikator (posisi dan interval) dipengaruhi oleh semua faktor yang menentukan konstanta kesetimbangan (kekuatan ion, suhu, zat asing, pelarut), serta indikator.
3. Dengan saksi substansi
Contoh: Ag+ + Cl - " AgCl $
Ag+ + CrO4" Ag2CrO4$ (warna oranye terang)
Sejumlah kecil garam K2CrO4 ditambahkan ke labu di mana diperlukan untuk menentukan ion klorin (saksi). Kemudian, zat uji ditambahkan secara bertahap dari buret, sedangkan ion klorida yang pertama bereaksi dan terbentuk endapan putih (AgCl), yaitu PR AgCl<< ПР Ag2Cr O4.
Jadi, setetes perak nitrat ekstra akan memberikan warna oranye terang, karena semua klorin telah bereaksi.
Metode titrasi.
1. titrasi langsung, pada titrasi langsung titran langsung ditambahkan ke zat yang akan dititrasi. Metode ini hanya berlaku jika semua persyaratan yang tercantum di atas terpenuhi.
2. titrasi kembali(dengan kelebihan), digunakan dalam reaksi lambat. Jika laju reaksi rendah, atau tidak mungkin menemukan indikator, atau efek samping diamati, misalnya, hilangnya analit karena volatilitas, Anda dapat menggunakan teknik titrasi kembali: tambahkan kelebihan titran T1 yang diketahui ke zat yang akan ditentukan, akhiri reaksi, lalu cari jumlah titran yang tidak bereaksi dengan mentitrasinya dengan reagen T2 lain dengan konsentrasi C2. jelas bahwa jumlah titran T1, sama dengan perbedaan CT1VT1 = CT2VT2, dihabiskan untuk analit.
3. titrasi tidak langsung (dengan substitusi), digunakan dalam analisis senyawa organik. Jika reaksi non-stoikiometrik atau berlangsung lambat, maka digunakan titrasi substituen, di mana reaksi kimia analit dengan reagen tambahan dilakukan, dan produk yang diperoleh dalam jumlah yang setara dititrasi dengan titran yang sesuai.
Metode untuk menyatakan konsentrasi larutan.
Konsentrasi molar - mol / l
1M - 1 liter mengandung 1 g / mol zat
Konsentrasi molar ekivalen (larutan normal) (larutan harus mengandung sejumlah massa ekivalen dalam 1 liter).
Setara kimia adalah jumlah zat yang setara dengan satu g atom hidrogen.
Titer solusi T
Titer untuk zat yang berfungsi: https://pandia.ru/text/79/035/images/image004_113.gif" width="133" height="48 src="> [g/ml]
Titer zat kerja harus diubah menjadi titer analit menggunakan faktor konversi: Tonp = Trab F
Contoh: https://pandia.ru/text/79/035/images/image006_73.gif" width="72" height="46 src=">
![]()
a - sampel zat yang dianalisis
Solusi standar dan bekerja
Sebuah titran dengan konsentrasi yang diketahui disebut larutan standar. Menurut metode persiapan, larutan standar primer dan sekunder dibedakan. Larutan standar primer dibuat dengan melarutkan sejumlah zat kimia murni dengan komposisi stoikiometrik yang diketahui dalam volume tertentu pelarut. Larutan standar sekunder disiapkan sebagai berikut: siapkan larutan dengan konsentrasi perkiraan dan tentukan konsentrasinya (standarisasi) terhadap standar primer yang sesuai.
Zat referensi primer harus memenuhi sejumlah persyaratan:
1. Komposisi zat harus benar-benar sesuai dengan rumus kimia. Konten pengotor kurang dari 0,05%
2. Zat harus stabil pada suhu kamar, tidak higroskopis, tidak teroksidasi oleh oksigen atmosfer, tidak menyerap karbon dioksida, tidak mudah menguap.
3. Bahan harus memiliki berat molekul yang cukup tinggi untuk mengurangi kesalahan penimbangan.
Untuk persiapan larutan standar primer, Anda dapat menggunakan fixanal - ampul di mana sejumlah zat atau larutan standar disegel.
pengantar
Workshop laboratorium dilaksanakan setelah mempelajari mata kuliah teoritik “Kimia Analitik dan FHMA” dan berfungsi untuk memantapkan dan memperdalam ilmu yang diperoleh.
Tugas analisis kuantitatif adalah menentukan jumlah (kandungan) unsur (ion), radikal, gugus fungsi, senyawa atau fasa pada objek yang dianalisis. Kursus ini mencakup metode dasar analisis titrimetri (volumetrik), metode titrasi dan aplikasi praktisnya.
Sebelum memulai lokakarya laboratorium, siswa diinstruksikan tentang tindakan pencegahan keselamatan. Sebelum melakukan setiap pekerjaan, siswa harus melewati kolokium tentang bagian yang ditunjukkan oleh guru, serta tentang metodologi untuk melakukan analisis. Untuk ini, Anda perlu:
1) ulangi bagian kursus yang relevan;
2) berkenalan secara rinci dengan metodologi pekerjaan;
3) menyusun persamaan reaksi kimia yang mendasari analisis kimia yang sedang berlangsung;
4) untuk mempelajari fitur analisis dalam hal keamanan.
Berdasarkan hasil pekerjaan, siswa membuat laporan, yang harus menunjukkan:
· judul pekerjaan;
· tujuan pekerjaan;
· landasan teori metode: esensi metode, persamaan dasar, perhitungan dan konstruksi kurva titrasi, pemilihan indikator;
reagen dan peralatan yang digunakan selama pekerjaan;
teknik analisis:
Penyusunan standar primer;
Persiapan dan standarisasi larutan kerja;
penentuan kandungan zat uji dalam larutan;
data eksperimental;
· pengolahan statistik hasil analisis;
· kesimpulan.
METODE ANALISIS TITRIMETRI
Metode analisis titrimetri didasarkan pada pengukuran volume reagen yang konsentrasinya diketahui secara pasti (titran) yang dihabiskan untuk reaksi kimia dengan zat yang ditentukan.
Prosedur penentuan (titrasi) terdiri dari fakta bahwa titran ditambahkan tetes demi tetes dari buret ke volume larutan analit yang diketahui secara tepat dengan konsentrasi yang tidak diketahui sampai titik ekivalen tercapai.
di mana x– zat yang ditentukan; R- titran, P adalah produk reaksi.
Titik ekivalen (yaitu)- ini adalah keadaan teoritis larutan, yang terjadi pada saat penambahan jumlah titran yang setara R ke analit x. Dalam prakteknya, titran ditambahkan ke zat yang akan ditentukan sampai titik akhir titrasi (ktt) tercapai, yang dipahami sebagai indikasi visual dari titik ekivalen, momen perubahan warna indikator ditambahkan ke larutan. . Selain indikasi visual, titik ekivalen dapat didaftarkan dengan metode instrumental. Dalam hal ini, titik akhir titrasi (ctt) dipahami sebagai momen perubahan tajam dalam kuantitas fisik yang diukur selama proses titrasi (kuat arus, potensial, konduktivitas listrik, dll.).
Jenis reaksi kimia berikut digunakan dalam metode analisis titrimetri: reaksi netralisasi, reaksi redoks, reaksi pengendapan, dan reaksi pembentukan kompleks.
Tergantung pada jenis reaksi kimia yang digunakan, berikut ini dibedakan: metode analisis titrimetri:
– titrasi asam basa;
– titrasi presipitasi;
– titrasi kompleksometri atau kompleksometri;
– titrasi redoks atau titrasi redoks.
Reaksi yang digunakan dalam metode analisis titrimetri adalah sebagai berikut: persyaratan:
Reaksi harus berlangsung dalam rasio stoikiometri, tanpa reaksi samping;
reaksi harus berlangsung hampir ireversibel (≥ 99,9%), konstanta kesetimbangan reaksi K p > 10 6, endapan yang terbentuk harus memiliki kelarutan S < 10 -5 моль/дм 3 , а образующиеся комплексы – К уст > 10 -6 ;
Reaksi harus berjalan pada tingkat yang cukup tinggi;
Reaksi harus berlangsung pada suhu kamar;
Titik ekivalen harus ditetapkan dengan jelas dan andal dalam beberapa cara.
Metode titrasi
Dalam setiap metode analisis titrimetri, ada beberapa metode titrasi. Membedakan titrasi maju, titrasi balik dan titrasi substitusi .
titrasi langsung– titran ditambahkan tetes demi tetes ke dalam larutan analit sampai titik ekivalen tercapai.
Skema titrasi: X+R=P.
Hukum ekivalen untuk titrasi langsung:
C (1/ z) X V X = C (1/ z) R V R . (2)
Jumlah (massa) analit yang terkandung dalam larutan uji dihitung menggunakan hukum ekivalen (untuk titrasi langsung)
m X = C (1/z)R V R M (1/z) X٠10 -3 , (3)
di mana C (1/z) R– konsentrasi molar ekivalen titran, mol/dm 3 ;
V R adalah volume titran, cm3;
M( 1/ z) x adalah massa molar ekivalen analit;
C (1/z) X– konsentrasi molar ekuivalen analit, mol/dm 3 ;
V X adalah volume analit, cm3.
Titrasi kembali- dua titran digunakan. Pertama
volume yang tepat dari titran pertama ditambahkan ke larutan yang dianalisis ( R1) diambil secara berlebihan. Sisa titran R 1 yang tidak bereaksi dititrasi dengan titran kedua ( R2). Jumlah titran R1, dihabiskan
pada interaksi dengan zat yang dianalisis ( x) ditentukan oleh perbedaan antara volume titran yang ditambahkan R1 (V 1) dan volume titran R2 (V2) dari residu titran yang dihabiskan untuk titrasi R1.
Skema titrasi: x + R1 kelebihan tetap = P1 (R1 sisa).
R1 sisa + R2 = P2.
Saat menggunakan titrasi balik, hukum ekivalen ditulis sebagai berikut:
Massa analit dalam kasus titrasi balik dihitung dengan rumus
Metode titrasi balik digunakan dalam kasus di mana tidak mungkin untuk memilih indikator yang cocok untuk reaksi langsung atau prosesnya dengan kesulitan kinetik (laju reaksi kimia rendah).
Titrasi substitusi (titrasi tidak langsung)- digunakan dalam kasus di mana titrasi analit langsung atau balik tidak mungkin atau sulit, atau tidak ada indikator yang sesuai.
Untuk analit x tambahkan reagen apa saja SEBUAH berlebihan, pada interaksi dengan jumlah yang setara dari suatu zat yang dilepaskan R. Maka produk reaksi R dititrasi dengan titran yang sesuai R.
Skema titrasi: x + SEBUAH kelebihan = P1.
P1 + R = P2.
Hukum ekivalen untuk titrasi substitusi ditulis sebagai berikut:
Karena jumlah ekivalen analit x dan produk reaksi R adalah sama, perhitungan massa analit dalam kasus titrasi tidak langsung dihitung dengan rumus
m X = C (1/z) R V R M (1/z) X٠10 -3 . (7)
Reagen
1. Asam suksinat H 2 C 4 H 4 O 4 (murni secara kimiawi) - standar primer.
2. Larutan natrium hidroksida NaOH dengan konsentrasi molar
~2,5 mol / dm 3
3. H2O suling.
Peralatan siswa menggambarkan diri mereka sendiri.
Kemajuan pekerjaan:
1. Pembuatan standar primer asam suksinat HOOCCH 2 CH 2 COOH.
Asam suksinat dibuat dengan volume 200,00 cm3 dengan konsentrasi ekivalen molar ![]() mol / dm3.
mol / dm3.
![]() g/mol.
g/mol.
persamaan reaksi:
Mengambil sampel (menimbang):
![]()
Berat sampel
Engsel secara kuantitatif dipindahkan ke labu ukur ![]() cm 3), tambahkan 50 - 70 cm 3 air suling, aduk sampai asam suksinat larut sepenuhnya, didihkan dengan air suling
cm 3), tambahkan 50 - 70 cm 3 air suling, aduk sampai asam suksinat larut sepenuhnya, didihkan dengan air suling
dan aduk rata.
menghitung
sesuai dengan rumus

Reagen
1. Natrium karbonat Na 2 CO 3 (murni secara kimia) - standar primer.
2. H2O suling.
3. Konsentrasi HCl asam klorida 1:1 (r=1,095 g/cm3).
4. Indikator asam-basa (dipilih dari kurva titrasi).
5. Indikator campuran - jingga metil dan biru metilen.
Kemajuan pekerjaan:
1. Pembuatan standar utama natrium karbonat (Na 2 CO 3).
Suatu larutan natrium karbonat dibuat dengan volume 200,00 cm3 dengan konsentrasi ekivalen molar ![]() mol / dm3.
mol / dm3.
Perhitungan massa sampel, g: (massa diambil dengan akurasi tempat desimal keempat).
persamaan reaksi:
1) Na 2 CO 3 + HCl = NaHCO 3 + NaCl
2) NaHCO 3 + HCl \u003d NaCl + H 2 O + CO 2
_____________________________________
Na 2 CO 3 + 2HCl \u003d 2NaCl + H 2 O + CO 2
H 2 CO 3 adalah asam lemah ( K a1= 10 -6,35, K a2 = 10 -10,32).
Mengambil sampel (menimbang):
Berat kaca arloji (kaca)
Berat kaca arloji (kaca) dengan engsel ![]()
Berat sampel
Engsel secara kuantitatif dipindahkan ke labu ukur ![]() cm 3), tambahkan 50 - 70 cm 3 air suling, aduk sampai natrium karbonat larut sempurna, didihkan dengan air suling
cm 3), tambahkan 50 - 70 cm 3 air suling, aduk sampai natrium karbonat larut sempurna, didihkan dengan air suling
dan aduk rata.
Konsentrasi sebenarnya dari standar primer menghitung
sesuai dengan rumus

2. Pembuatan dan standarisasi titran (larutan HCl)
Suatu larutan asam klorida dibuat dengan volume kira-kira 500 cm3
dengan konsentrasi setara molar sekitar 0,05÷0,06 mol / dm 3)
Titran - larutan asam klorida dengan konsentrasi perkiraan 0,05 mol / dm 3 dibuat dari asam klorida yang diencerkan 1:1 (r = 1,095 g / cm 3).
Standarisasi solusi HCl dilakukan menurut standar primer Na 2 CO 3 dengan titrasi langsung, metode pemipetan.
Indikator dipilih sesuai dengan kurva titrasi natrium karbonat dengan asam klorida (Gbr. 4).

Beras. 4. Kurva titrasi larutan Na 2 CO 3 100,00 cm3 dengan DENGAN\u003d 0,1000 mol / dm 3 dengan larutan HCl dengan C 1/z\u003d 0,1000 mol / dm 3
Saat titrasi ke titik ekivalen kedua, gunakan indikator jingga metil, larutan berair 0,1% (pT = 4,0). Perubahan warna dari kuning menjadi jingga (warna mawar teh). Interval transisi
(pH = 3,1 - 4,4).
Skema 3. Standarisasi larutan HCl

Dalam labu titrasi berbentuk kerucut 250 cm3, masukkan alikuot 25,00 cm3 larutan standar Na2CO3 (dengan pipet), tambahkan 2-3 tetes metil jingga, encerkan dengan air hingga 50–75 cm3, dan titrasi dengan asam klorida sampai terjadi perubahan warna dari kuning menjadi warna “tea rose” dari satu tetes titran. Titrasi dilakukan dengan adanya "saksi" (larutan asli Na 2 CO 3 dengan indikator). Hasil titrasi dimasukkan ke dalam tabel. 4. Konsentrasi asam klorida ditentukan oleh hukum ekivalen: .
Tabel 4
Hasil standarisasi larutan asam klorida
tugas
1. Merumuskan konsep ekuivalen dalam reaksi asam basa. Hitung ekuivalen soda dan asam fosfat dalam reaksi berikut:
Na 2 CO 3 + HCl \u003d NaHCO 3 + NaCl
Na 2 CO 3 + 2HCl \u003d 2NaCl + CO 2 + H 2 O
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
H 3 PO 4 + 2NaOH \u003d Na 2 HPO 4 + H 2 O
H 3 PO 4 + 3NaOH \u003d Na 3 PO 4 + 3H 2 O
2. Tulis persamaan reaksi antara asam klorida, asam sulfat, natrium hidroksida, aluminium hidroksida, natrium karbonat, kalium bikarbonat dan hitung massa ekivalen zat-zat tersebut.
3. Buat kurva titrasi untuk 100,00 cm 3 asam klorida dengan konsentrasi molar yang setara dengan 0,1 mol/dm 3 dengan natrium hidroksida dengan konsentrasi molar yang setara dengan 0,1 mol/dm 3 . Pilih Kemungkinan Indikator
4. Buat kurva titrasi untuk 100,00 cm 3 asam akrilat (CH 2 =CHCOOH, pKa sebuah= 4.26) dengan konsentrasi ekivalen molar
0,1 mol / dm 3 natrium hidroksida dengan konsentrasi setara molar
0,1 mol/dm3. Bagaimana komposisi larutan berubah selama titrasi? Pilih indikator yang memungkinkan dan hitung kesalahan titrasi indikator.
5. Gambarkan kurva titrasi untuk hidrazin (N 2 H 4 +H 2 O, pKa B= 6,03)
dengan konsentrasi molar setara dengan 0,1 mol / dm 3 asam klorida
dengan konsentrasi molar setara dengan 0,1 mol/dm 3. Apa persamaannya?
dan perbedaan antara perhitungan pH dan kurva titrasi dibandingkan dengan kurva titrasi asam lemah dengan basa? Pilih Kemungkinan Indikator
dan menghitung kesalahan titrasi indikator.
6. Hitung koefisien aktivitas dan konsentrasi aktif ion
dalam 0,001 M larutan aluminium sulfat, 0,05 M natrium karbonat, 0,1 M kalium klorida.
7. Hitung pH larutan metilamin 0,20 M jika ionisasinya dalam larutan berair dijelaskan oleh persamaan
B + H 2 O \u003d VN + + OH -, K B\u003d 4,6 × 10 - 3, di mana B adalah basisnya.
8. Hitung konstanta disosiasi asam hipoklorit HOCl jika larutan 1,99 × 10 - 2 M memiliki pH = 4,5.
9. Hitung pH larutan yang mengandung 6,1 g/mol asam glikolat (CH2(OH)COOH, K sebuah= 1,5 × 10 - 4).
10. Hitung pH larutan yang diperoleh dengan mencampurkan 40 ml larutan asam klorida 0,015 M dengan:
a) 40 ml air;
b) 20 ml larutan natrium hidroksida 0,02 M;
c) 20 ml larutan barium hidroksida 0,02 M;
d) 40 ml larutan 0,01 M asam hipoklorit, K sebuah=5,0 × 10 - 8 .
11. Hitung konsentrasi ion asetat dalam larutan asam asetat
dengan fraksi massa 0,1%.
12. Hitung konsentrasi ion amonium dalam larutan amonia dengan fraksi massa 0,1%.
13. Hitung massa sampel natrium karbonat yang diperlukan untuk menyiapkan 250,00 ml larutan 0,5000 M.
14. Hitung volume larutan asam klorida dengan konsentrasi ekivalen molar 11 mol/l dan volume air yang harus diambil untuk membuat 500 ml larutan asam klorida 0,5 M.
15. 0,15 g magnesium logam dilarutkan dalam 300 ml larutan asam klorida 0,3%. Hitung konsentrasi molar ion hidrogen, magnesium dan klor dalam larutan yang dihasilkan.
16. Ketika mencampur 25,00 ml larutan asam sulfat dengan larutan barium klorida, diperoleh 0,2917 g barium sulfat. Tentukan titer larutan asam sulfat
17. Hitung massa kalsium karbonat yang bereaksi
dengan asam klorida 80,5 mmol.
18. Berapa gram natrium fosfat monobasa yang harus ditambahkan?
25,0 ml larutan natrium hidroksida 0,15 M untuk mendapatkan larutan dengan pH = 7? Untuk asam fosfat pKa a1= 2.15; pK a2= 7,21; pK a3 = 12,36.
19. Titrasi 1.0000 g asam sulfat berasap, yang diencerkan dengan hati-hati dengan air, menggunakan 43,70 ml larutan natrium hidroksida 0,4982 M. Diketahui bahwa asam sulfat yang berasap mengandung anhidrida sulfat yang dilarutkan dalam asam sulfat anhidrat. Hitung fraksi massa anhidrida sulfat dalam asam sulfat berasap.
20. Kesalahan mutlak pengukuran volume dengan buret adalah 0,05 ml. Hitung kesalahan relatif dalam mengukur volume dalam 1; 10 dan 20ml.
21. Larutan disiapkan dalam labu takar dengan kapasitas 500,00 ml.
dari sampel 2.5000 g natrium karbonat. Menghitung:
a) konsentrasi molar larutan;
b) konsentrasi molar ekivalen (½ Na 2 CO 3);
c) titer larutan;
d) titer asam klorida.
22. Berapa volume larutan natrium karbonat 10% dengan massa jenis?
1.105 g / cm 3 yang perlu Anda ambil untuk memasak:
a) 1 liter larutan dengan titer Na 2 CO 3 = 0,005.000 g/cm 3 ;
b) 1 liter larutan dengan Na 2 CO 3 /HCl = 0,003000 g/cm 3?
23. Berapa volume asam klorida dengan fraksi massa 38,32% dan massa jenis 1,19 g / cm3 yang harus diambil untuk membuat 1500 ml larutan 0,2 M?
24. Berapa volume air yang harus ditambahkan ke 1,2 liter HCl 0,25 M untuk membuat larutan 0,2 M?
25. Dari 100 g natrium hidroksida teknis yang mengandung 3% natrium karbonat dan 7% pengotor biasa, 1 liter larutan disiapkan. Hitung konsentrasi molar dan titer asam klorida dari larutan basa yang dihasilkan, dengan asumsi bahwa natrium karbonat dititrasi menjadi asam karbonat.
26. Ada sampel yang mungkin mengandung NaOH, Na 2 CO 3 , NaHCO 3 atau campuran senyawa tersebut seberat 0,2800 g. Sampel dilarutkan dalam air.
Titrasi larutan yang dihasilkan dengan adanya fenolftalein mengkonsumsi 5,15 ml, dan dengan adanya metil oranye - 21,45 ml asam klorida dengan konsentrasi setara molar 0,1520 mol / l. Tentukan komposisi sampel dan fraksi massa komponen dalam sampel.
27. Gambarkan kurva titrasi 100,00 cm3 larutan amonia 0,1000 M dengan larutan asam klorida 0,1000 M, tentukan pilihan indikatornya.
28. Hitung pH titik ekivalen, awal dan akhir titrasi 100,00 cm 3 0,1000 M larutan asam malonat (HOOCCH 2 COOH) 0,1000 M larutan natrium hidroksida (pK sebuah 1=1,38; RK sebuah 2=5,68).
29. Untuk titrasi 25,00 cm 3 larutan natrium karbonat dengan konsentrasi molar setara dengan 0,05123 mol / dm 3, 32,10 cm 3 asam klorida pergi. Hitung konsentrasi molar ekivalen asam klorida.
30. Berapa ml larutan amonium klorida 0,1 M yang harus ditambahkan?
ke 50,00 ml larutan amonia 0,1 M untuk membuat larutan buffer
dengan pH=9,3.
31. Campuran asam sulfat dan asam fosfat dipindahkan ke dalam labu takar yang bervolume 250,00 cm3. Untuk titrasi diambil dua sampel berukuran 20,00 cm3, yang satu dititrasi dengan larutan natrium hidroksida dengan konsentrasi molar setara
0,09940 mol/dm 3 dengan indikator methyl orange, dan yang kedua dengan phenolphthalein. Konsumsi natrium hidroksida pada kasus pertama adalah 20,50 cm 3 dan pada kasus kedua 36,85 cm 3 . Tentukan massa asam sulfat dan asam fosfat dalam campuran.
Dalam kompleksometri
Sampai titik ekivalen =( C M V M- C EDTA V EDTA)/( V M+ V EDTA). (21)
Pada titik ekivalen = ![]() . (22)
. (22)
Setelah titik ekivalen =  . (23)
. (23)
pada gambar. Gambar 9 menunjukkan kurva titrasi ion kalsium dalam larutan buffer dengan nilai pH yang berbeda. Dapat dilihat bahwa titrasi Ca 2+ hanya dimungkinkan pada pH 8.
Reagen
2. H2O suling.
3. Larutan standar Mg (II) dengan konsentrasi molar
0,0250 mol/dm3.
4. pH buffer amoniak = 9,5.
5. Larutan kalium hidroksida KOH dengan fraksi massa 5%.
6. Eriochrome black T, campuran indikator.
7. Calcon, campuran indikator.
Landasan teoretis dari metode ini:
Metode ini didasarkan pada interaksi ion Ca 2+ dan Mg 2+ dengan garam dinatrium asam etilendiamintetraasetat (Na 2 H 2 Y 2 atau Na-EDTA) dengan pembentukan kompleks yang stabil dengan rasio molar M:L=1 :1 dalam kisaran pH tertentu.
Untuk menetapkan titik ekivalen dalam penentuan Ca 2+ dan Mg 2+, digunakan calcon dan eriochrome black T.
Penentuan Ca 2+ dilakukan pada pH 12, sedangkan Mg 2+ adalah
dalam larutan sebagai endapan magnesium hidroksida dan tidak dititrasi dengan EDTA.
Mg 2+ + 2OH - \u003d Mg (OH) 2
Ca 2+ + Y 4- " CaY 2-
Pada pH 10 (larutan buffer amonia), Mg 2+ dan Ca 2+ adalah
dalam larutan dalam bentuk ion dan dengan penambahan EDTA dititrasi bersama.
Ca 2+ + HY 3- « CaY 2- + H +
Mg 2+ + HY 3- « MgY 2- + H +
Untuk menentukan volume EDTA yang digunakan untuk titrasi Mg2+,
dari total volume yang digunakan untuk mentitrasi campuran pada pH 10, kurangi volume yang digunakan untuk titrasi Ca 2+ pada pH 12.
Untuk membuat pH 12, larutan KOH 5% digunakan, untuk membuat
pH 10 menggunakan larutan buffer amonia (NH 3 ×H 2 O + NH 4 Cl).
Kemajuan pekerjaan:
1. Standarisasi titran - larutan EDTA (Na 2 H 2 Y)
Larutan EDTA disiapkan dengan perkiraan konsentrasi 0,025 M
dari 0,05 M larutan, encerkan dengan air suling 2 kali. Untuk standarisasi EDTA, digunakan larutan standar MgSO4.
dengan konsentrasi 0,02500 mol/dm 3.
Skema 5. Standarisasi titran - larutan EDTA
 Dalam labu berbentuk kerucut untuk titrasi dengan kapasitas 250 cm 3, 20,00 cm 3 larutan standar MgSO 4 dengan konsentrasi 0,02500 mol / dm 3 ditempatkan, ~ 70 cm 3 air suling, ~ 10 cm 3 larutan ditambahkan larutan buffer amoniak dengan pH ~9,5 - 10 dan ditambahkan indikator eriochrome black T sebanyak 0,05 g
Dalam labu berbentuk kerucut untuk titrasi dengan kapasitas 250 cm 3, 20,00 cm 3 larutan standar MgSO 4 dengan konsentrasi 0,02500 mol / dm 3 ditempatkan, ~ 70 cm 3 air suling, ~ 10 cm 3 larutan ditambahkan larutan buffer amoniak dengan pH ~9,5 - 10 dan ditambahkan indikator eriochrome black T sebanyak 0,05 g
(di ujung spatula). Dalam hal ini, solusinya berubah menjadi merah anggur. Larutan dalam labu dititrasi secara perlahan dengan larutan EDTA sampai terjadi perubahan warna dari merah anggur menjadi hijau. Hasil titrasi dimasukkan ke dalam tabel. 6. Konsentrasi EDTA ditentukan oleh hukum ekivalen: ![]() .
.
Tabel 6
Hasil standarisasi larutan EDTA
2. Penentuan kandungan Ca 2+
Kurva titrasi larutan Ca 2+ EDTA pada pH=10 dan pH=12 terbentuk secara bebas.
Solusi masalah dalam labu volumetrik dibawa ke tanda dengan air suling dan dicampur secara menyeluruh.
Skema 6. Penentuan kandungan Ca 2+ dalam larutan
 Sebuah alikuot dari larutan uji 25,00 cm 3 yang mengandung kalsium dan magnesium ditempatkan ke dalam labu berbentuk kerucut untuk titrasi dengan kapasitas 250 cm 3, ~ 60 cm 3 air, ~ 10 cm 3 dari larutan KOH 5% ditambahkan. Setelah pengendapan endapan amorf Mg(OH) 2 , indikator calcon sekitar 0,05 g (di ujung spatula) ditambahkan ke dalam larutan dan dititrasi secara perlahan dengan larutan EDTA sampai warna berubah dari merah muda menjadi biru pucat. Hasil titrasi ( V 1) dimasukkan dalam tabel.7.
Sebuah alikuot dari larutan uji 25,00 cm 3 yang mengandung kalsium dan magnesium ditempatkan ke dalam labu berbentuk kerucut untuk titrasi dengan kapasitas 250 cm 3, ~ 60 cm 3 air, ~ 10 cm 3 dari larutan KOH 5% ditambahkan. Setelah pengendapan endapan amorf Mg(OH) 2 , indikator calcon sekitar 0,05 g (di ujung spatula) ditambahkan ke dalam larutan dan dititrasi secara perlahan dengan larutan EDTA sampai warna berubah dari merah muda menjadi biru pucat. Hasil titrasi ( V 1) dimasukkan dalam tabel.7.
Tabel 7
| nomor pengalaman | Volume EDTA, cm3 | Kandungan Ca 2+ dalam larutan, g | |
| 25,00 | |
||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
3. Penentuan kandungan Mg2+
Kurva titrasi larutan Mg 2+ EDTA pada pH=10 terbentuk secara bebas.
Skema 7. Penentuan kandungan Mg 2+ dalam larutan

Sebuah alikuot dari 25,00 cm 3 larutan uji yang mengandung kalsium dan magnesium ditempatkan ke dalam labu berbentuk kerucut untuk titrasi dengan kapasitas 250 cm 3, ~ 60 cm 3 air suling, ~ 10 cm 3 larutan buffer amonia dengan pH dari ~ 9,5–10 ditambahkan, dan indikator ditambahkan eriochrome black T kira-kira 0,05 g
(di ujung spatula). Dalam hal ini, solusinya berubah menjadi merah anggur. Larutan dalam labu dititrasi secara perlahan dengan larutan EDTA sampai terjadi perubahan warna dari merah anggur menjadi hijau. Hasil titrasi ( V 2) dimasukkan ke dalam tabel. delapan.
Tabel 8
Hasil titrasi larutan yang mengandung kalsium dan magnesium
| nomor pengalaman | Volume larutan yang diselidiki, cm3 | volume EDTA, V, cm3 | Kandungan Mg 2+ dalam larutan, g |
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
Reagen
1. Larutan EDTA dengan konsentrasi molar ~ 0,05 mol/dm 3.
2. Larutan standar Cu(II) dengan titer 2,00×10 -3 g/dm 3 .
3. H2O suling.
4. Buffer Amoniak dengan pH ~ 8 - 8.5.
5. Murexide, campuran indikator.
tugas
1. Hitung 4 untuk EDTA pada pH=5 jika konstanta ionisasi EDTA adalah sebagai berikut: K 1 =1.0 10 -2 , K 2 =2.1 10 -3 , K 3 =6.9 10 -7 , K 4 \u003d 5.5 10 -11.
2. Buat kurva titrasi untuk 25,00 ml larutan nikel 0,020 M dengan larutan EDTA 0,010 M pada pH=10 jika konstanta stabilitasnya adalah
K NiY = 10 18,62 . Hitung p setelah menambahkan 0,00; 10.00; 25.00; 40.00; 50,00 dan 55,00 ml titran.
3. Untuk titrasi 50,00 ml larutan yang mengandung ion kalsium
dan magnesium, dibutuhkan 13,70 ml larutan EDTA 0,12 M pada pH=12 dan 29,60 ml pada pH=10. Nyatakan konsentrasi kalsium dan magnesium dalam larutan dalam mg/ml.
4. Ketika dianalisis, ditemukan 0,2173 g kalsium oksida dan 0,0927 g magnesium oksida dalam 1 liter air. Hitung volume 0,0500 mol/l EDTA yang digunakan untuk titrasi.
5. Untuk titrasi 25,00 ml larutan standar yang mengandung 0,3840 g magnesium sulfat, digunakan 21,40 ml larutan Trilon B. Hitung titer larutan ini dengan kalsium karbonat dan konsentrasi molarnya.
6. Berdasarkan konstanta pembentukan (stabilitas) kompleksonat logam yang diberikan di bawah ini, evaluasi kemungkinan titrasi kompleksometri ion logam pada pH = 2; 5; 10; 12.
7. Saat mentitrasi larutan 0,01 M Ca2+ dengan larutan EDTA 0,01 M pada pH=10, konstanta stabilitas K CaY = 10 10.6. Hitung apa yang seharusnya menjadi konstanta stabilitas bersyarat kompleks logam dengan indikator pada pH=10, jika pada titik akhir titrasi =.
8. Konstanta ionisasi asam dari indikator yang digunakan dalam titrasi kompleksometri adalah 4,8·10 -6 . Hitung kandungan indikator dalam bentuk asam dan basa pada pH = 4,9, jika konsentrasi totalnya dalam larutan adalah 8,0·10 -5 mol/l. Tentukan kemungkinan penggunaan indikator ini saat mentitrasi larutan
dengan pH=4,9 jika warna bentuk asamnya sesuai dengan warna kompleksnya.
9. Untuk menentukan kandungan aluminium dalam sampel, 550 mg bagian sampel dilarutkan dan 50,00 ml larutan komplekson III 0,05100 M ditambahkan. Kelebihan yang terakhir dititrasi dengan 14,40 ml larutan seng (II) 0,04800 M. Hitung fraksi massa aluminium dalam sampel.
10. Ketika kompleks yang mengandung ion bismut dan iodida dihancurkan, yang terakhir dititrasi dengan larutan Ag(I), dan bismut dengan komplekson III.
Titrasi larutan yang mengandung 550 mg sampel membutuhkan 14,50 ml larutan komplekson III 0,05000 M, dan titrasi ion iodida yang terkandung dalam 440 mg sampel membutuhkan 23,25 ml larutan Ag(I) 0,1000 M. Hitung bilangan koordinasi bismut dalam kompleks jika ion iodida adalah ligan.
11.
Sampel seberat 0,3280 g yang mengandung Pb, Zn, Cu dilarutkan
dan dipindahkan ke labu ukur 500,00 cm3. Penetapan dilakukan dalam tiga tahap:
a) titrasi bagian pertama larutan dengan volume 10,00 cm3 yang mengandung Pb, Zn, Cu, menggunakan larutan EDTA 37,50 cm3 0,0025 M; b) Cu ditutup pada bagian kedua dari 25,00 cm 3 , dan 27,60 cm 3 EDTA digunakan untuk titrasi Pb dan Zn; c) di bagian ketiga dari 100,00 cm 3 Zn . bertopeng
dan Cu, 10,80 cm3 EDTA dihabiskan untuk titrasi Pb. Tentukan fraksi massa Pb, Zn, Cu dalam sampel.
Kurva titrasi
Dalam redoksmetri, kurva titrasi diplot dalam koordinat E = f(C R),
mereka menggambarkan perubahan grafis dalam potensi sistem selama titrasi. Sebelum titik ekivalen, potensial sistem dihitung dari rasio konsentrasi bentuk analit yang teroksidasi dan tereduksi (karena hingga titik ekivalen, salah satu bentuk titran praktis tidak ada), setelah ekivalen titik, dari rasio konsentrasi bentuk teroksidasi dan tereduksi dari titran (karena setelah titik ekivalen, analit dititrasi hampir sepenuhnya).
Potensial pada titik ekivalen ditentukan oleh rumus
 , (26)
, (26)
di mana jumlah elektron yang berpartisipasi dalam setengah-reaksi;
adalah potensial elektroda standar dari setengah reaksi.
pada gambar. Gambar 10 menunjukkan kurva titrasi larutan asam oksalat H 2 C 2 O 4 dengan larutan kalium permanganat KMnO 4 dalam suasana asam
(= 1 mol / dm 3).

Beras. 10. Kurva titrasi larutan oksalat 100,00 cm3
asam H 2 C 2 O 4 s C 1/z\u003d 0,1000 mol / dm 3 dengan larutan permanganat
kalium KMnO 4 s C 1/z\u003d 0,1000 mol / dm 3 pada \u003d 1 mol / dm 3
Potensial setengah reaksi MnO 4 - + 5 e+ 8H + → Mn 2+ + 4H 2 O tergantung pada pH medium, karena ion hidrogen berpartisipasi dalam setengah reaksi.
permanganatometri
Titran adalah larutan kalium permanganat KMnO 4 , yang merupakan oksidator kuat. Persamaan Dasar:
MnO 4 - + 8H + + 5e \u003d Mn 2+ + 4H 2 O, ![]() = +1,51V.
= +1,51V.
M 1 / z (KMnO 4) \u003d ![]() g/mol.
g/mol.
Dalam lingkungan yang sedikit asam, netral dan sedikit basa, karena potensi redoks yang lebih rendah, ion permanganat direduksi menjadi Mn +4.
MnO 4 - + 2H 2 O + 3e \u003d MnO 2 + 4OH -, ![]() = +0,60V.
= +0,60V.
M 1 / z (KMnO 4) \u003d 158.03 / 3 \u003d 52,68 g / mol.
Dalam lingkungan basa, larutan kalium permanganat direduksi
hingga Mn+6.
MnO 4 - + 1e \u003d MnO 4 2-, ![]() = +0,558 V.
= +0,558 V.
M 1 / z (KMnO 4) \u003d 158.03 g / mol.
Untuk menghindari reaksi samping, titrasi dengan kalium permanganat dilakukan dalam media asam, yang dibuat dengan asam sulfat. Tidak disarankan menggunakan asam klorida untuk membuat media, karena kalium permanganat mampu mengoksidasi ion klorida.
2Cl - - 2e \u003d Cl 2, \u003d +1,359 V.
Paling sering, kalium permanganat digunakan sebagai solusi
dengan konsentrasi molar setara ~ 0,05 - 0,1 mol / dm 3. Ini bukan standar utama karena fakta bahwa larutan kalium permanganat dalam air mampu mengoksidasi air dan kotoran organik di dalamnya:
4MnO 4- + 2H 2 O \u003d 4MnO 2 + 3O 2 + 4OH -
Penguraian larutan kalium permanganat dipercepat dengan adanya mangan dioksida. Karena mangan dioksida adalah produk dekomposisi permanganat, endapan ini memiliki: efek autokatalitik ke proses dekomposisi.
Kalium permanganat padat yang digunakan untuk menyiapkan larutan terkontaminasi dengan mangan dioksida, sehingga tidak mungkin untuk menyiapkan larutan dari sampel yang akurat. Untuk mendapatkan larutan kalium permanganat yang cukup stabil, setelah melarutkan sampel KMnO 4 dalam air, dibiarkan dalam botol gelap selama beberapa hari (atau direbus), dan kemudian MnO 2 dipisahkan dengan penyaringan melalui kaca filter (jangan gunakan filter kertas, karena bereaksi dengan kalium permanganat, membentuk mangan dioksida).
Warna larutan kalium permanganat sangat pekat sehingga
bahwa indikator dalam metode ini tidak diperlukan. Untuk memberikan warna merah muda yang nyata pada 100 cm 3 air, 0,02 - 0,05 cm 3 larutan KMnO 4 sudah cukup
dengan konsentrasi molar ekuivalen 0,1 mol/dm 3 (0,02 M). Warna kalium permanganat pada titik akhir titrasi tidak stabil dan berangsur-angsur berubah warna akibat interaksi kelebihan permanganat
dengan ion mangan (II) yang ada di titik akhir dalam jumlah yang relatif besar:
2MnO 4 - + 3Mn 2+ + 2H 2 O « 5MnО 2 + 4H +
Standarisasi solusi kerja KMnO 4 dihabiskan untuk natrium oksalat atau asam oksalat (baru direkristalisasi dan dikeringkan pada 105 °C).
Gunakan larutan standar primer dengan konsentrasi ekivalen molar DENGAN(½ Na 2 C 2 O 4) \u003d 0,1000 atau 0,05000 mol / l.
C 2 O 4 2- - 2e ® 2CO 2, \u003d -0,49 V
Analisis titrimetri atau volumetrik- metode analisis kuantitatif berdasarkan pengukuran volume (atau massa) reagen T yang digunakan untuk reaksi dengan analit X. Dengan kata lain, analisis titrimetri adalah analisis berdasarkan titrasi.
Tujuan kelas laboratorium tentang metode analisis titrimetri adalah untuk mengembangkan keterampilan praktis dalam teknik melakukan analisis titrimetri dan menguasai metode pemrosesan statistik hasil analisis menggunakan contoh penentuan kuantitatif spesifik, serta untuk mengkonsolidasikan pengetahuan teoretis dengan memecahkan tipikal masalah perhitungan untuk setiap topik.
Pengetahuan tentang teori dan praktik metode analisis titrimetri diperlukan untuk studi selanjutnya tentang metode analisis instrumental, disiplin ilmu kimia dan farmasi khusus lainnya (farmasi, kimia toksikologi, farmakognosi, teknologi farmasi). Metode analisis titrimetri yang dipelajari adalah farmakope dan banyak digunakan dalam praktik apoteker untuk mengontrol kualitas obat.
Konvensi
A, X, T - masing-masing zat, analit dan titran;
m(A), m(X), t(T)- massa zat apa pun, analit dan titran, masing-masing, g;
M(A), M(X), M(T)- massa molar zat apa pun, analit dan titran, masing-masing, g/mol;
n(A), n(X), n(T) - jumlah zat, analit dan titran, masing-masing, mol;
Jumlah zat yang setara dengan zat apa pun, zat yang akan ditentukan dan titran, masing-masing, mol;
 - volume larutan zat apa pun, analit dan titran, masing-masing, l;
- volume larutan zat apa pun, analit dan titran, masing-masing, l;
 - volume alikuot analit, sama dengan kapasitas pipet, l;
- volume alikuot analit, sama dengan kapasitas pipet, l;
 - volume larutan analit yang dianalisis, sama dengan kapasitas labu, l.
- volume larutan analit yang dianalisis, sama dengan kapasitas labu, l.
1. Konsep dasar titrimetri
analisis
1.1. Titrasi- proses penentuan zat X dengan penambahan bertahap sejumlah kecil zat T, di mana, dalam beberapa cara, deteksi titik (momen) ketika semua zat X telah bereaksi disediakan. Titrasi memungkinkan Anda untuk menemukan jumlah zat X dari jumlah zat T yang diketahui ditambahkan hingga titik (momen) ini, dengan mempertimbangkan fakta bahwa rasio di mana X dan T bereaksi diketahui dari stoikiometri atau sebaliknya.
1.2. titran- larutan yang mengandung reagen aktif T, yang dengannya titrasi dilakukan. Titrasi biasanya dilakukan dengan menambahkan titran dari buret terkalibrasi ke dalam labu titrasi yang berisi larutan yang akan dianalisis. Ke dalam labu ini sebelum titrasi tambahkan alikuot solusi yang dianalisis.
1.3. Pembagian alikuot (alikuot)- bagian yang diketahui dengan tepat dari solusi yang dianalisis, diambil untuk analisis. Ini sering diambil dengan pipet yang dikalibrasi dan volumenya biasanya ditunjukkan dengan simbol V ss.
1.4. Titik ekivalen (TE)- titik (momen) titrasi di mana jumlah titran T yang ditambahkan setara dengan jumlah zat yang dititrasi X. Sinonim untuk TE: titik stoikiometri, titik akhir teoretis.
1.5. Titrasi titik akhir (KTT) - titik (momen) titrasi, di mana beberapa sifat larutan (misalnya, warnanya) menunjukkan perubahan yang nyata (tajam). LTT kurang lebih sesuai dengan TE, tetapi paling sering tidak sesuai dengannya.
1.6. Indikator- zat yang menunjukkan perubahan yang terlihat di TE atau di dekatnya. Idealnya, indikator hadir pada konsentrasi yang cukup rendah untuk interval transisi bukan biaya-
sejumlah besar titran T digunakan. Perubahan tajam yang terlihat pada indikator (misalnya, warnanya) sesuai dengan CTT.
1.7. Interval transisi indikator- area konsentrasi hidrogen, logam, atau ion lain di mana mata dapat mendeteksi perubahan rona, intensitas warna, fluoresensi, atau properti lain dari indikator visual yang disebabkan oleh perubahan rasio dua bentuk yang sesuai. indikatornya. Area ini biasanya dinyatakan sebagai logaritma negatif dari konsentrasi, misalnya:  Untuk indikator redoks, interval transisi adalah daerah potensial redoks yang sesuai.
Untuk indikator redoks, interval transisi adalah daerah potensial redoks yang sesuai.
1.8. Derajat titrasi - rasio volume V (T) dari titran yang ditambahkan ke volume V (TE) dari titran yang sesuai dengan TE. Dengan kata lain, derajat titrasi suatu larutan adalah perbandingan jumlah zat yang dititrasi dengan jumlah awalnya dalam larutan yang dianalisis:

1.9. Tingkat titrasi- memesan  konsentrasi larutan titran yang digunakan, misalnya 10 -1 , 10 -2 , 10 -3 , dst.
konsentrasi larutan titran yang digunakan, misalnya 10 -1 , 10 -2 , 10 -3 , dst.
1.10. Kurva titrasi - representasi grafis dari ketergantungan perubahan konsentrasi c (X) analit X atau beberapa properti terkait dari sistem (larutan) pada volume V (T) ditambahkan titran T. Nilai c (X) selama titrasi berubah beberapa kali lipat, sehingga kurva titrasi sering diplot dalam koordinat:  Absis menunjukkan volume titran yang ditambahkan V (T) atau derajat titrasi / . Jika konsentrasi kesetimbangan c (X) atau intensitas suatu sifat yang sebanding dengannya diplot sepanjang sumbu y, maka diperoleh kurva titrasi linier. Jika pada sumbu y kita sisihkan
Absis menunjukkan volume titran yang ditambahkan V (T) atau derajat titrasi / . Jika konsentrasi kesetimbangan c (X) atau intensitas suatu sifat yang sebanding dengannya diplot sepanjang sumbu y, maka diperoleh kurva titrasi linier. Jika pada sumbu y kita sisihkan  atau logaritma intensitas suatu sifat sebanding dengan c(X), maka diperoleh kurva titrasi logaritmik (atau monologaritmik). Untuk lebih jelas mengidentifikasi fitur dari proses titrasi dan untuk tujuan yang diterapkan, kadang-kadang mereka membangun kurva titrasi diferensial, memplot sepanjang sumbu absis volume titran yang ditambahkan V (T), dan sepanjang sumbu y - turunan pertama dari logaritma konsentrasi (atau intensitas sifat yang sebanding dengannya) sehubungan dengan volume titran yang ditambahkan:
atau logaritma intensitas suatu sifat sebanding dengan c(X), maka diperoleh kurva titrasi logaritmik (atau monologaritmik). Untuk lebih jelas mengidentifikasi fitur dari proses titrasi dan untuk tujuan yang diterapkan, kadang-kadang mereka membangun kurva titrasi diferensial, memplot sepanjang sumbu absis volume titran yang ditambahkan V (T), dan sepanjang sumbu y - turunan pertama dari logaritma konsentrasi (atau intensitas sifat yang sebanding dengannya) sehubungan dengan volume titran yang ditambahkan:  Kurva titrasi seperti itu biasanya digunakan dalam metode analisis fisikokimia, misalnya, dalam titrasi potensiometri.
Kurva titrasi seperti itu biasanya digunakan dalam metode analisis fisikokimia, misalnya, dalam titrasi potensiometri.
1.11. Solusi standar- larutan yang konsentrasi zat aktifnya diketahui.
1.12. Standardisasi- proses menemukan konsentrasi reagen aktif dalam larutan (paling sering dengan mentitrasinya dengan larutan standar dari zat yang sesuai).
1.13. Lompatan titrasi- interval perubahan tajam dalam setiap sifat fisik atau fisika-kimia larutan di dekat titik ekivalen, biasanya diamati ketika 99,9-100,1% titran ditambahkan dibandingkan dengan jumlah stoikiometrinya.
1.14. Titrasi kosong- titrasi larutan yang identik dengan larutan yang dianalisis dalam hal volume, keasaman, jumlah indikator, dll., tetapi tidak mengandung analit.
2. Operasi dasar analisis titrimetri
2.1. Pembersihan, pencucian, penyimpanan alat ukur.
2.2. Memeriksa kapasitas alat ukur.
2.3. Mengambil sampel dengan massa yang diketahui secara tepat dengan selisih antara hasil dua penimbangan (biasanya pada neraca analitik).
2.4. Transfer kuantitatif sampel zat ke dalam labu volumetrik dan pelarutan zat.
2.5. Mengisi peralatan volumetrik (termos, buret, pipet) dengan larutan.
2.6. Mengosongkan pipet, buret.
2.7. Pemilihan alikuot dari solusi yang dianalisis.
2.8. Titrasi dan perhitungan berdasarkan hasil titrasi.
3. Kalibrasi alat ukur
Dalam analisis titrimetri, volume larutan yang tepat diukur dengan menggunakan alat ukur, yaitu labu ukur berkapasitas 1000, 500, 250, 100, 50 dan 25 ml, pipet tetes dan pipet ukur kapasitas 10, 5, 3 , 2 dan 1 ml. Kapasitas labu dan pipet pada 20 °C terukir di leher labu atau di sisi pipet (volume nominal). Dalam produksi massal peralatan volumetrik, kapasitas aktual (sebenarnya) dari labu volumetrik, buret, pipet mungkin berbeda dari nilai nominal yang ditunjukkan pada peralatan. Untuk mencapai akurasi diperlukan hasil analisis titrimetri yang diperoleh
Kalibrasi alat gelas volumetrik didasarkan pada penentuan massa yang tepat dari air suling yang dituangkan atau dituangkan, yang ditentukan oleh hasil penimbangan gelas sebelum dan sesudah menuangkan atau menuangkan air. Volume air dalam bejana yang dikalibrasi (kapasitasnya) dan massa air dihubungkan dengan rasio:

di mana  - massa jenis air pada suhu percobaan, g/ml.
- massa jenis air pada suhu percobaan, g/ml.
Kepadatan air tergantung pada suhu, jadi saat membuat perhitungan, Anda harus menggunakan data di Tabel. 2-1.
Tabel 2-1. Nilai kepadatan air pada suhu yang sesuai

Labu volumetrik dikalibrasi untuk infus, dan buret serta pipet dikalibrasi untuk menuangkan, karena sejumlah kecil cairan selalu tertinggal di dinding cawan selama penuangan.
3.1. Pemeriksaan kapasitas labu volumetrik
Labu dicuci bersih, dikeringkan dan ditimbang di neraca analitik dengan ketelitian ± 0,002 g. Kemudian diisi dengan air (selanjutnya - suling) di sepanjang meniskus bawah, tetesan air di bagian atas leher botol labu dikeluarkan dengan kertas saring dan ditimbang kembali. Setiap penimbangan labu kosong dan labu air dilakukan minimal dua kali, sedangkan selisih dua penimbangan tidak boleh melebihi ± 0,005 g. Selisih antara massa labu dengan air dan massa labu kosong adalah sama dengan massa air yang ditampung oleh labu pada suhu tertentu. Kapasitas labu yang sebenarnya dihitung dengan membagi massa rata-rata air dengan densitasnya pada suhu uji (lihat Tabel 2-1).
Misalnya, jika sebuah labu ukur dengan volume nominal 100 ml dikalibrasi, massa rata-rata air pada 18 °C adalah 99,0350 g. Maka kapasitas labu ukur yang sebenarnya adalah:
3.2. Pemeriksaan kapasitas buret
Buret adalah silinder kaca, diameter bagian dalam yang dapat sedikit berbeda sepanjang buret. Pembagian yang sama pada buret di berbagai bagiannya sesuai dengan volume larutan yang tidak sama. Itulah sebabnya kalibrasi buret menghitung volume sebenarnya untuk setiap lokasi buret yang dipilih.
Sebuah buret bersih dan kering diisi dengan air sampai tanda nol di sepanjang meniskus bawah dan tetesan air dihilangkan dari permukaan bagian dalam buret dengan kertas saring. Kemudian, di bawah buret pengganti botol, yang sebelumnya ditimbang dengan tutup pada neraca analitik. Volume tertentu air (misalnya, 5 ml) perlahan-lahan dituangkan ke dalam botol dari buret. Setelah itu, botol ditutup dengan penutup dan ditimbang kembali. Selisih antara massa botol timbang dengan air dan botol timbang kosong sama dengan massa air yang terkandung dalam buret antara pembagian 0 dan 5 ml pada suhu percobaan. Kemudian buret diisi lagi dengan air sampai tanda nol di sepanjang meniskus bawah, 10 ml air dituangkan perlahan ke dalam labu kosong dan massa air yang terkandung dalam buret antara pembagian 0 dan 10 ml ditentukan dengan cara yang sama. Saat mengkalibrasi buret, misalnya, untuk 25 ml, operasi ini dilakukan 5 kali dan massa air yang sesuai dengan volume nominal yang ditunjukkan pada buret 5, 10, 15, 20 dan 25 ml dihitung. Setiap penimbangan botol kosong dan sebotol air diulang setidaknya dua kali, sedangkan perbedaan antara dua penimbangan tidak boleh melebihi ± 0,005 g.
Kemudian menurut tabel. 2-1 tentukan densitas air pada suhu percobaan dan hitung kapasitas sebenarnya dari buret untuk setiap nilai volume nominal yang tertera di atasnya.
Berdasarkan data yang diperoleh, nilai koreksi dihitung sama dengan perbedaan antara nilai yang dihitung dari kapasitas sebenarnya dan nilai yang sesuai dari volume nominal buret:

dan kemudian menggambar kurva kesalahan kapasitas buret dalam koordinat  (Gambar 2-1).
(Gambar 2-1).
Sebagai contoh, mari kita peroleh data eksperimen berikut saat mengkalibrasi buret dengan kapasitas 25 ml pada suhu 20 °C, yang, bersama-sama dengan hasil perhitungan yang sesuai, disajikan pada Tabel. 2-2.
Berdasarkan data tabular yang diperoleh, kurva koreksi kapasitas untuk buret tertentu diplot, yang dengannya dimungkinkan untuk memperbaiki hasil pembacaan buret.
Tabel 2-2. Hasil kalibrasi untuk buret 25 ml


Beras. 2-1. Kurva koreksi kapasitas buret
Misalnya, 7,50 ml titran digunakan untuk titrasi alikuot analit menurut hasil penghitungan pada buret. Berdasarkan grafik (lihat Gbr. 2-1), nilai koreksi yang sesuai dengan volume nominal ini adalah 0,025 ml, volume titran sebenarnya yang digunakan adalah: 7,50 - 0,025 = 7,475 ml.
3.3. Memeriksa kapasitas pipet
Sebuah pipet, bersih dan ditimbang dengan neraca analitik, diisi dengan air sampai tanda nol di sepanjang meniskus bawah dan kemudian air diisi secara perlahan.
dituangkan di sepanjang dinding ke dalam botol yang telah ditimbang sebelumnya. Botol ditutup dengan penutup dan ditimbang dengan air. Setiap penimbangan botol kosong dan botol berisi air diulang minimal dua kali, sedangkan selisih dua penimbangan tidak boleh melebihi ± 0,005 g. Selisih antara massa botol dengan air dan botol kosong sama dengan massa air yang ditampung oleh pipet. Kapasitas sebenarnya dari pipet dihitung dengan membagi massa rata-rata air dengan densitas air pada suhu uji (lihat Tabel 2-1).
4. Perhitungan tipikal dalam analisis titrimetri
4.1. Cara menyatakan konsentrasi yang digunakan untuk perhitungan dalam analisis titrimetri
4.1.1. Konsentrasi molar zat c (A), mol / l - jumlah zat A dalam mol yang terkandung dalam 1 liter larutan:
 (2.1)
(2.1)
di mana  - jumlah zat A dalam mol, yang dilarutkan dalam V (A) l
- jumlah zat A dalam mol, yang dilarutkan dalam V (A) l
larutan.
4.1.2. Konsentrasi molar ekivalen suatu zat  , mol / l - jumlah zat A yang setara dalam mol yang terkandung dalam 1 liter larutan (nama sebelumnya adalah "normalitas" larutan):
, mol / l - jumlah zat A yang setara dalam mol yang terkandung dalam 1 liter larutan (nama sebelumnya adalah "normalitas" larutan):
 (2.2)
(2.2)
di mana  - jumlah zat yang setara dengan A dalam mol,
- jumlah zat yang setara dengan A dalam mol,
dilarutkan dalam V (A) l larutan;  - massa molar setara dengan ve-
- massa molar setara dengan ve-
zat A, g / mol; - faktor ekivalen zat.
4.1.3. Titer zat T(A), g / ml - massa zat terlarut A dalam gram, terkandung dalam 1 ml larutan:
4.1.4. Faktor konversi titrimetri  I, g / ml - massa analit dalam gram, berinteraksi dengan 1 ml titran:
I, g / ml - massa analit dalam gram, berinteraksi dengan 1 ml titran:
(2.4)
4.1.5. Faktor koreksi F- nilai yang menunjukkan berapa kali konsentrasi praktis titran berbeda dari nilai teoretis terkait yang ditentukan dalam metode:
 (2.5)
(2.5)
4.2. Perhitungan massa molar ekuivalen zat dalam reaksi yang digunakan dalam analisis titrimetri
Setara adalah partikel nyata atau bersyarat yang dapat menambahkan atau menyumbangkan satu ion hidrogen H + (atau setara dengannya dalam reaksi asam-basa) atau menambah atau menyumbangkan satu elektron dalam reaksi redoks.
Faktor kesetaraan  - nomor yang menunjukkan yang
- nomor yang menunjukkan yang
fraksi ekivalen berasal dari partikel nyata zat A. Faktor ekivalen dihitung berdasarkan stoikiometri reaksi ini: 
di mana Z- jumlah proton yang disumbangkan atau ditambahkan oleh satu partikel yang bereaksi (molekul atau ion) dalam reaksi asam-basa, atau jumlah elektron yang disumbangkan atau diterima oleh satu partikel yang bereaksi (molekul atau ion) dalam setengah reaksi oksidasi atau reduksi.
Massa molar ekivalen suatu zat adalah massa satu mol ekivalen suatu zat, sama dengan produk faktor ekivalen dengan massa molar zat, g / mol. Itu dapat dihitung menggunakan rumus:
 (2.6)
(2.6)
4.3. Pembuatan larutan dengan mengencerkan larutan yang lebih pekat dengan konsentrasi yang diketahui
Saat melakukan analisis titrimetri, dalam beberapa kasus diperlukan untuk menyiapkan larutan zat A dengan volume  kira-kira konsentrasinya diketahui dengan mengencerkan larutan yang lebih pekat.
kira-kira konsentrasinya diketahui dengan mengencerkan larutan yang lebih pekat.
Ketika larutan diencerkan dengan air, jumlah zat A atau jumlah zat setara A tidak berubah, oleh karena itu, sesuai dengan ekspresi (2.1) dan (2.2), kita dapat menulis:
(2.7)  (2.8)
(2.8)
di mana indeks 1 dan 2 masing-masing mengacu pada larutan sebelum dan sesudah pengenceran.
Dari rasio yang diperoleh, volume larutan yang lebih pekat dihitung  , yang harus diukur untuk menyiapkan solusi yang diberikan.
, yang harus diukur untuk menyiapkan solusi yang diberikan.
4.4. Persiapan volume yang telah ditentukan larutan dengan menimbang massa yang diketahui secara tepat
4.4.1. Perhitungan Berat Sampel
Berat teoritis sampel zat standar A, yang diperlukan untuk menyiapkan volume tertentu dari larutan dengan konsentrasi yang diketahui, dihitung dari persamaan (2.1) dan (2.2). Ini sama dengan:
(2.9)
jika konsentrasi molar suatu zat dalam larutan digunakan, dan:
(2.10)
jika konsentrasi molar ekivalen zat dalam larutan digunakan.
4.4.2. Perhitungan konsentrasi yang tepat dari larutan yang disiapkan
Konsentrasi larutan zat A, yang dibuat dengan sampel akurat bermassa m (A), dihitung dari hubungan (2.1-2.3), di mana t(A)- massa praktis zat A, diambil dari selisih antara dua penimbangan pada neraca analitik.
4.5. Perhitungan konsentrasi titran selama standardisasi
Diketahui volume larutan standar  dengan konsentrasi
dengan konsentrasi  dititrasi dengan larutan titran volume V (T)(atau sebaliknya). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi
dititrasi dengan larutan titran volume V (T)(atau sebaliknya). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi  , hukum persamaan memiliki bentuk:
, hukum persamaan memiliki bentuk:
dan 
Dari sini diperoleh ekspresi untuk menghitung konsentrasi molar ekivalen titran dari hasil titrasi:
 (2.12)
(2.12)
4.6. Perhitungan massa analit dalam larutan yang dianalisis4.6.1. titrasi langsung
Zat yang akan ditentukan dalam larutan yang dianalisis dititrasi langsung dengan titran.
4.6.1.1. Perhitungan menggunakan konsentrasi molar ekivalen titran
Sebuah alikuot dari larutan analit  dititrasi
dititrasi
larutan titran dengan volume V(T). Dalam hal ini, untuk reaksi yang terjadi dalam larutan selama proses titrasi:

hukum persamaan memiliki bentuk:  dan
dan
(2.13)
Oleh karena itu, konsentrasi molar ekivalen analit yang dihitung dari hasil titrasi adalah sama dengan:
 (2.14)
(2.14)
Ekspresi yang dihasilkan disubstitusikan ke dalam persamaan (2.2) dan diperoleh rumus untuk menghitung massa analit dalam labu dengan volume  menurut hasil titrasi langsung :
menurut hasil titrasi langsung :
 (2.15)
(2.15)
Jika, selama titrasi, sebagian titran dikonsumsi oleh reaksi dengan indikator, "eksperimen kosong" dilakukan dan volume titran V "(T) ditentukan,
digunakan untuk titrasi indikator. Dalam perhitungan, volume ini dikurangi dari volume titran, yang digunakan untuk mentitrasi larutan analit. Perubahan tersebut dibuat selama "eksperimen kosong" di semua rumus perhitungan yang digunakan dalam analisis titrimetri. Misalnya, rumus (2.15) untuk menghitung massa analit, dengan mempertimbangkan "percobaan kosong", akan terlihat seperti:
(2.16)
4.6.1.2. Perhitungan menggunakan faktor konversi titrimetri
Kami memiliki solusi yang dianalisis dengan volume  Untuk titrasi al-
Untuk titrasi al-
bagian mil  larutan analit yang digunakan volume titran V (T) dengan faktor konversi titrimetri teoritis
larutan analit yang digunakan volume titran V (T) dengan faktor konversi titrimetri teoritis  dan faktor koreksi F. Maka massa analit dalam alikuot sama dengan:
dan faktor koreksi F. Maka massa analit dalam alikuot sama dengan:
(2.17)
dan di seluruh volume yang dianalisis 
(2.18)
4.6.2. titrasi substitusi
 kelebihan reagen A yang diketahui ditambahkan dan substituen B diisolasi dalam jumlah yang setara dengan analit:
kelebihan reagen A yang diketahui ditambahkan dan substituen B diisolasi dalam jumlah yang setara dengan analit:

Substituen B dititrasi dengan titran yang sesuai:

Hukum ekivalen untuk titrasi substitusi:

menggunakan relasi (2.8) dapat ditulis dalam bentuk:

Dari sini diperoleh rumus untuk menghitung konsentrasi molar ekivalen analit dalam larutan menurut hasil titrasi substitusi:

yang memiliki bentuk yang sama seperti pada titrasi langsung (2.14). Itulah sebabnya semua perhitungan massa analit dalam masalah yang dianalisis selama titrasi substitusi dilakukan sesuai dengan rumus (2.15-2.18) untuk titrasi langsung. 4.6.3. Titrasi kembali
Untuk alikuot analit  menambahkan terkenal kelebihan titran pertama
menambahkan terkenal kelebihan titran pertama  :
:

Kemudian kelebihan titran pertama yang tidak bereaksi dititrasi dengan titran kedua, yang menghabiskan volume  :
:

Hukum persamaan dalam hal ini dapat ditulis sebagai:

Dari sini, konsentrasi molar ekivalen zat X dalam larutan dihitung:
 (2.19)
(2.19)
Substitusikan persamaan yang dihasilkan ke dalam persamaan (2.2) dan dapatkan rumus untuk menghitung massa analit dalam larutan yang dianalisis, sama dengan volume labu, berdasarkan hasil titrasi balik:

5. Pelaksanaan dan pemberian kerja praktek analisis titrimetri
5.1. Ketentuan umum
Saat mempelajari bagian "Analisis titrimetri", direncanakan untuk melakukan pekerjaan pada topik berikut.
Tema I Metode titrasi asam basa.
Tema II. Metode titrasi redoks.
Topik III. Metode titrasi presipitasi.
Topik IV. Metode titrasi kompleksometri.
Pelajaran 1. Pembuatan larutan asam klorida dan standarisasinya.
Pelajaran 2. Penentuan massa alkali dalam larutan. Penentuan massa karbonat dalam larutan. Penentuan massa alkali dan karbonat dalam larutan di hadapan bersama.
Pelajaran 3. Penentuan massa amonia dalam larutan garam amonium.
a) Kontrol uji 1.
b) Penentuan massa amonia dalam larutan garam amonium. Pelajaran 4. Titrasi permanganometri.
A. Tes tertulis 1.
b) Penentuan massa hidrogen peroksida dalam larutan.
c) Penentuan massa besi(II) dalam larutan garam. Penentuan fraksi massa besi(II) dalam sampel garam.
Pelajaran 5. Titrasi iodometri.
a) Penentuan massa hidrogen peroksida dalam larutan.
b) Penentuan massa tembaga(II) dalam larutan. Pelajaran 6. titrasi iodimetri.
Pelajaran 7. Titrasi bromatometri. Penentuan massa arsenik (AKU AKU AKU) dalam larutan.
Pelajaran 8. titrasi bromometrik. Penentuan fraksi massa natrium salisilat dalam sediaan.
Pelajaran 9. Titrasi Nitritometri.
a) Kontrol uji 2.
b) Penentuan fraksi massa novocaine dalam sediaan. Pelajaran 10. Titrasi argentometri dan heksasianoferatom-
titrasi trik.
A. Tes tertulis2.
b) Penentuan massa kalium bromida dan kalium iodida dalam larutan dengan titrasi argentometri.
c) Penentuan massa seng dalam larutan dengan titrasi heksasianoferratometri.
Pelajaran 11. Penentuan kompleksometri massa seng dan timbal dalam larutan.
a) Kontrol uji 3.
b) Penentuan massa seng dan timbal dalam larutan.
Pelajaran 12. Penentuan kompleksometri besi(III) dan kalsium dalam larutan.
A. Tes tertulis3.
b) Penentuan massa besi(III) dan kalsium dalam larutan.
Bergantung pada situasi spesifik, diperbolehkan untuk melakukan beberapa pekerjaan selama tidak hanya satu, tetapi dua pelajaran. Dimungkinkan juga untuk menggeser waktu kontrol pengujian dan pengujian tertulis.
Di akhir setiap topik, contoh item tes untuk kontrol menengah pengetahuan siswa, isi tes tertulis akhir, contoh tiket untuk tes tertulis diberikan.
Di akhir setiap pelajaran, siswa menyusun protokol yang mencakup tanggal dan nama pekerjaan yang dilakukan, esensi metodologi, urutan pekerjaan, data eksperimen yang diperoleh, perhitungan, tabel, kesimpulan. Semua perhitungan hasil analisis (konsentrasi larutan, massa analit) dilakukan oleh siswa dengan akurasi angka penting keempat, kecuali untuk kasus yang ditentukan secara khusus dalam teks.
Kontrol menengah atas keterampilan praktis dan pengetahuan teoretis dilakukan dengan bantuan kontrol tes dan tes tertulis.
5.2. Dukungan materi untuk kelas dalam analisis titrimetri
Barang pecah belah: buret dengan kapasitas 5 ml, pipet volumetrik dengan kapasitas 2 dan 5 ml, labu ukur dengan kapasitas 25, 50, 100 dan 250 ml, labu ukur dengan kapasitas 10-25 ml, botol kaca, corong kaca dengan diameter 20-30 mm, labu kaca polos atau gelap dengan kapasitas 100, 200 dan 500 ml, silinder ukur dengan kapasitas 10, 100 ml.
Reagen: Reagen dengan kualifikasi "murni secara kimia" digunakan dalam pekerjaan dan "ch.d.a.", kertas indikator.
Perangkat: timbangan analitik dengan anak timbangan, timbangan teknis dengan anak timbangan, oven, termometer laboratorium dengan skala 20-100 °C, tripod dengan kaki untuk memasang buret dan cincin untuk jaring asbes, pembakar gas, penangas air.
Bahan pembantu dan aksesoris: deterjen (soda, bubuk pencuci, campuran kromium), sikat pencuci piring, bohlam karet, jaring asbes, lem alat tulis, pensil kaca, kertas saring.
Bibliografi
1. Kuliah untuk mahasiswa pada bagian "Analisis Titrimetri".
2.Kharitonov Yu Ya. Kimia analitik (analitik): Dalam 2 jilid - ed. 5 - M.: Sekolah Tinggi, 2010 (selanjutnya disebut "Buku Pelajaran").
3.Lurie Yu.Yu. Handbook of Analytical Chemistry.- M.: Chemistry, 1989 (selanjutnya disebut "Buku Pegangan").
4.Dzhabarov D.N. Kumpulan latihan dan tugas dalam kimia analitik.- Moskow: Dokter Rusia, 2007.
Kirim karya bagus Anda di basis pengetahuan sederhana. Gunakan formulir di bawah ini
Mahasiswa, mahasiswa pascasarjana, ilmuwan muda yang menggunakan basis pengetahuan dalam studi dan pekerjaan mereka akan sangat berterima kasih kepada Anda.
Diposting pada http://www.allbest.ru/
pengantar
Titrasi adalah penambahan bertahap larutan pereaksi yang dititrasi (titran) ke dalam larutan yang dianalisis untuk menentukan titik ekivalen. Metode analisis titrimetri didasarkan pada pengukuran volume reagen dengan konsentrasi yang diketahui secara pasti, yang dihabiskan untuk reaksi interaksi dengan analit. Titik ekivalen adalah momen titrasi ketika rasio ekivalen reaktan tercapai.
Persyaratan berikut berlaku untuk reaksi yang digunakan dalam analisis volumetrik kuantitatif:
1. Reaksi harus berjalan sesuai dengan persamaan reaksi stoikiometri dan praktis tidak dapat diubah. Hasil reaksi harus mencerminkan jumlah analit. Konstanta kesetimbangan reaksi harus cukup besar.
2. Reaksi harus berlangsung tanpa reaksi samping, jika tidak, hukum ekivalen tidak dapat diterapkan.
3. Reaksi harus berlangsung pada laju yang cukup tinggi, yaitu. dalam 1-3 detik. Ini adalah keuntungan utama dari analisis titrimetri.
4. Harus ada cara untuk memperbaiki titik ekivalen. Akhir dari reaksi harus ditentukan dengan cukup mudah dan sederhana.
Jika suatu reaksi tidak memenuhi setidaknya satu dari persyaratan ini, reaksi tersebut tidak dapat digunakan dalam analisis titrimetri.
1. sistem
Ciri khas reaksi redoks adalah transfer elektron antara partikel yang bereaksi - ion, atom, molekul, dan kompleks, sebagai akibatnya keadaan oksidasi partikel-partikel ini berubah, misalnya
Karena elektron tidak dapat terakumulasi dalam larutan, dua proses harus terjadi secara bersamaan - kehilangan dan perolehan, yaitu, proses oksidasi beberapa partikel dan reduksi partikel lain. Jadi, setiap reaksi redoks selalu dapat direpresentasikan sebagai dua setengah-reaksi:
aOx1 + bRed2 = aRed1 + bOx2
Partikel awal dan produk dari setiap setengah reaksi merupakan pasangan atau sistem redoks. Dalam setengah reaksi di atas, Red1 terkonjugasi ke Ox1 dan Ox2 terkonjugasi ke Red1.
Potensial sistem redoks apa pun, yang diukur dalam kondisi standar terhadap elektroda hidrogen, disebut potensial standar (E0) dari sistem ini. Potensi standar dianggap positif jika sistem bertindak sebagai zat pengoksidasi dan setengah reaksi oksidasi terjadi pada elektroda hidrogen:
atau negatif jika sistem berperan sebagai reduktor, dan terjadi setengah reaksi reduksi pada elektroda hidrogen:
Nilai absolut dari potensial standar mencirikan "kekuatan" zat pengoksidasi atau zat pereduksi.
Potensi standar - nilai standar termodinamika - adalah parameter fisikokimia dan analitik yang sangat penting yang memungkinkan untuk mengevaluasi arah reaksi yang sesuai dan menghitung aktivitas partikel yang bereaksi dalam kondisi kesetimbangan.
Untuk mengkarakterisasi sistem redoks dalam kondisi tertentu, mereka menggunakan konsep potensial nyata (formal) E0 ", yang sesuai dengan potensial yang terbentuk pada elektroda dalam larutan khusus ini ketika konsentrasi awal bentuk-bentuk penentuan potensial teroksidasi dan tereduksi ion sama dengan 1 mol / l dan konsentrasi tetap dari semua larutan komponen lainnya.
Dari sudut pandang analitis, potensial nyata lebih berharga daripada potensial standar, karena perilaku sebenarnya dari sistem tidak ditentukan oleh standar, tetapi oleh potensial nyata, dan yang terakhir yang memungkinkan untuk memprediksi terjadinya reaksi redoks pada kondisi tertentu. Potensi sebenarnya dari sistem tergantung pada keasaman, keberadaan ion asing dalam larutan, dan dapat bervariasi pada rentang yang luas.
2. kurvatitrasi
Dalam metode titrimetri, perhitungan dan plot kurva titrasi memungkinkan untuk menilai seberapa sukses titrasi dan memungkinkan pilihan indikator. Saat membuat kurva titrasi redoks, potensial sistem diplot sepanjang sumbu ordinat, dan volume titran atau persentase titrasi diplot sepanjang sumbu absis.
2.1 Pengaruhkondisititrasidibergerakkurva
Kurva titrasi dibangun berdasarkan nilai potensial redoks, oleh karena itu, semua faktor yang mempengaruhi potensial akan mempengaruhi bentuk kurva titrasi dan lompatan di atasnya. Faktor-faktor tersebut meliputi nilai potensial standar sistem analit dan titran, jumlah elektron yang terlibat dalam setengah reaksi, pH larutan, adanya reagen pengompleks atau pengendap, dan sifat asam. Semakin besar jumlah elektron yang terlibat dalam reaksi redoks, semakin datar kurva yang mencirikan titrasi ini. Lonjakan titrasi semakin besar, semakin besar perbedaan potensial redoks dari zat pengoksidasi dan zat pereduksi. Dengan perbedaan potensial redoks yang sangat kecil, titrasi tidak mungkin dilakukan. Jadi titrasi ion Cl- (E = 1,36V) dengan permanganat (E = 1,51) secara praktis tidak mungkin. Seringkali perlu untuk memperluas interval potensial di mana lompatan berada jika kecil. Dalam kasus tersebut, kontrol melompat terpaksa.
Penurunan konsentrasi salah satu komponen pasangan redoks secara signifikan mempengaruhi ukuran lompatan (misalnya, dengan bantuan reagen pengompleks). Mari kita asumsikan bahwa asam fosfat, fluorida, atau oksalat, yang membentuk kompleks dengan besi (III) dan tidak berinteraksi dengan besi (II), dimasukkan ke dalam larutan, sedangkan potensi pasangan Fe3+/Fe2+ berkurang. Jika, misalnya, karena reaksi kompleksasi yang bersaing, konsentrasi ion Fe3+ dalam larutan berkurang dengan faktor 10.000, lompatan potensial pada kurva titrasi tidak akan dimulai pada E = 0,95V, tetapi pada E = 0,71V . Ini akan berakhir, seperti sebelumnya, pada E = 1.48V. Dengan demikian, daerah lompatan pada kurva titrasi akan diperluas secara signifikan.
Peningkatan suhu, masing-masing, meningkatkan potensi sistem titran dan analit.
Jadi, ketika memilih kondisi optimal untuk titrasi redoks, pertama-tama kita harus memperhitungkan pengaruhnya terhadap keadaan sistem redoks, dan, akibatnya, pada potensial redoks nyata.
2.2 Definisipoinpersamaan derajatnya
Dalam metode titrasi redoks, serta dalam metode interaksi asam-basa, berbagai cara untuk menunjukkan titik ekivalen dimungkinkan.
1. Metode non-indikator dapat diterapkan saat menggunakan titran berwarna (larutan KMnO4, I2), yang sedikit berlebih memberikan warna yang dapat diperbaiki secara visual pada larutan.
2. Metode indikator dapat menjadi kimia jika senyawa kimia digunakan sebagai indikator yang berubah warna secara tajam di dekat titik ekivalen (dalam lompatan pada kurva titrasi).
Kadang-kadang indikator asam-basa digunakan dalam metode titrasi redoks: jingga metil, metil merah, merah Kongo, dll. Indikator-indikator ini pada titik akhir titrasi dioksidasi secara ireversibel oleh zat pengoksidasi berlebih dan berubah warna.
Dimungkinkan untuk menggunakan indikator fluoresen dan chemiluminescent ketika mentitrasi zat pereduksi dengan zat pengoksidasi kuat. Indikator fluoresen mencakup banyak zat (acridine, euchrysine, dll.) yang memancarkan di wilayah yang terlihat pada nilai pH tertentu dari larutan setelah penyinaran dengan radiasi ultraviolet. Indikator chemiluminescent adalah zat (luminol, lucigenin, siloxene, dll.) yang terpancar di wilayah spektrum yang terlihat pada titik akhir titrasi karena proses kimia eksotermik. Chemiluminescence diamati terutama selama reaksi oksidasi dengan hidrogen peroksida, hipoklorit dan beberapa agen pengoksidasi lainnya. Keuntungan dari indikator fluoresen dan chemiluminescent adalah dapat digunakan untuk titrasi tidak hanya transparan dan tidak berwarna, tetapi juga larutan keruh atau berwarna, yang indikator redoks konvensional tidak cocok untuk titrasi.
Metode indikator juga dapat berupa fisikokimia: potensiometri, amperometrik, konduktometri, dll.
2.3 redoksindikator
Untuk menentukan titik ekivalen dalam redoksimetri, berbagai indikator digunakan:
1. Indikator redoks (indikator redoks) yang berubah warna ketika potensi redoks sistem berubah.
2. Indikator spesifik yang berubah warna ketika titran berlebih muncul atau analit menghilang. Indikator khusus digunakan dalam beberapa kasus. Jadi pati merupakan indikator adanya yodium bebas, atau lebih tepatnya ion triiodida. Dengan adanya pati, warnanya menjadi biru pada suhu kamar. Munculnya warna biru pati dikaitkan dengan adsorpsi pada amilase, yang merupakan bagian dari pati.
Kadang-kadang amonium tiosianat digunakan sebagai indikator ketika mentitrasi garam besi(III); kation dengan ion membentuk senyawa merah. Pada titik ekivalen, semua ion direduksi menjadi dan larutan yang dititrasi berubah dari merah menjadi tidak berwarna.
Ketika dititrasi dengan larutan kalium permanganat, titran itu sendiri berperan sebagai indikator. Pada sedikit kelebihan KMnO4, larutan berubah menjadi merah muda.
Indikator redoks dibagi menjadi: reversibel dan ireversibel.
Indikator reversibel - berubah warna secara reversibel saat potensi sistem berubah. Indikator ireversibel - mengalami oksidasi atau reduksi ireversibel, akibatnya warna indikator berubah secara ireversibel.
Indikator redoks ada dalam dua bentuk, teroksidasi dan tereduksi, dengan warna satu bentuk berbeda dari warna lainnya.
Transisi indikator dari satu bentuk ke bentuk lainnya dan perubahan warnanya terjadi pada potensial tertentu dari sistem (potensial transisi). Potensial indikator ditentukan oleh persamaan Nernst:
Ketika konsentrasi bentuk teroksidasi dan tereduksi dari indikator adalah sama. Pada saat yang sama, setengah dari molekul indikator ada dalam bentuk teroksidasi, dan setengahnya lagi dalam bentuk tereduksi. Interval transisi indikator (IT) terletak dalam rasio konsentrasi kedua bentuk indikator dari 1/10 ke 10/1.
Saat melakukan titrasi redoks, indikator harus dipilih sedemikian rupa sehingga potensial indikator berada dalam loncatan potensial pada kurva titrasi. Banyak indikator titrasi redoks bersifat asam atau basa dan dapat mengubah perilakunya tergantung pada pH medium.
Salah satu indikator redoks yang paling terkenal dan umum digunakan adalah difenilamin:
Bentuk indikator yang dipulihkan tidak berwarna. Di bawah aksi agen pengoksidasi, difenilamin pertama-tama diubah secara ireversibel menjadi difenilbenzidin yang tidak berwarna, yang kemudian dioksidasi secara reversibel menjadi difenilbenzidin violet biru-ungu.
Indikator dua warna adalah ferroin, yang merupakan kompleks Fe2+ dengan o-fenantrolin
Titrasi dengan metode indikator dimungkinkan jika untuk reaksi yang diberikan EMF? 0.4V. Pada EMF = 0,4-0,2V, indikator instrumental digunakan.
3. Klasifikasimetoderedokstitrasi
Jika reaksi redoks berlangsung secara non-stoikiometrik atau tidak cukup cepat, metode titrasi tidak langsung digunakan: titrasi balik dan titrasi substitusi. Misalnya, dalam penentuan cerimetri Fe3+, digunakan metode titrasi substitusi:
Fe3+ +Ti3+ = TiIV + Fe2+ + + CeIV = Fe3+ + Ce3+.3+ tidak mengganggu titrasi.
Titrasi redoks dimungkinkan jika satu keadaan oksidasi analit yang sesuai ada dalam larutan. Jika tidak, sebelum memulai titrasi, perlu dilakukan reduksi awal (oksidasi) ke keadaan oksidasi yang sesuai, seperti yang dilakukan, misalnya, ketika menganalisis campuran Fe2+ dan Fe3+ dengan permanganatometri. Reduksi pendahuluan (oksidasi) harus memberikan transfer kuantitatif dari unsur yang ditentukan ke keadaan oksidasi yang diinginkan.
Reagen yang dimasukkan untuk tujuan ini harus berupa senyawa seperti itu, yang kelebihannya, sebelum dimulainya titrasi, mudah dihilangkan (dengan merebus, menyaring, dll.). Dalam beberapa kasus, redoksimetri digunakan untuk menentukan senyawa yang tidak mengubah keadaan oksidasinya.
Jadi, dengan titrasi substitusi, kalsium, seng, nikel, kobalt dan ion timbal ditentukan dalam permanganatometri, asam kuat dalam iodometri.
Tabel 1
Metode Titrasi Redoks
|
Nama metode |
Larutan standar (titran) |
Persamaan setengah reaksi dari sistem titran |
Fitur metode |
||
|
Larutan standar - oksidan |
|||||
|
Permanganatometri |
MnO4?+ 8H+ + 5e? = Mn2++ 4H2O MnO4?+ 4H+ + 3e? = MnO2 + 2H2O MnO4? + 2H2O + 3e? = MnO2 + 4OH? |
Metode non-indikator, digunakan dalam rentang pH yang luas |
|||
|
bromatometri |
BrO3?+ 6H+ + 6e? = Br?+ 3H2O |
Indikatornya adalah jingga metil. Rabu - sangat asam |
|||
|
Cerimetri |
Ce4+ + e? = Ce3+ |
Indikatornya adalah ferroin. Rabu - sangat asam |
|||
|
Kromatometri |
Cr2O72?+ 14H+ + 6e? = 2Cr3++2H2O |
Indikatornya adalah difenilamin. Rabu? asam kuat |
|||
|
Nitritometri |
NO2- + 2H+ + e? = TIDAK + H2O |
Indikator eksternal adalah kertas kanji iodida. Rabu? subasam |
|||
|
iodimetri |
Indikator - pati |
||||
|
Solusi standar - zat pereduksi |
|||||
|
ascorbino-metri |
6H6O6 +2H+ +2 e? = 6H8O6 |
Indikator - variamine blue atau potassium thiocyanate untuk penentuan ion Fe3 +. Rabu - asam |
|||
|
titanometri |
TiO2+ + 2H+ + e? =Ti3+ + H2O |
Indikatornya adalah biru metilen. Rabu - asam |
|||
|
iodometri |
S4O62?+ 2e? = 2S2O32? |
Indikatornya adalah pati-kecil. Reagen pembantu - KI. Sedang - sedikit asam atau netral |
4. permanganatometri
Permanganatometri adalah salah satu metode titrasi redoks yang paling umum digunakan. Sebagai titran, larutan kalium permanganat digunakan, yang sifat pengoksidasinya dapat dikontrol tergantung pada keasaman larutan.
4.1 Keunikanmetode
Yang paling banyak digunakan dalam praktik analitik adalah metode penentuan permanganometrik dalam media asam: reduksi MnO4- menjadi Mn2+ cepat dan stoikiometri:
Sebuah fitur dari metode ini adalah pengaruh yang kuat dari konsentrasi ion hidrogen pada potensial standar sistem MnO4-/Mn2+. Asam sulfat paling sering digunakan dalam titrasi dalam media asam kuat. Asam klorida dan asam nitrat tidak boleh digunakan, karena reaksi redoks yang bersaing dapat terjadi dengan adanya keduanya. Reduksi ion permanganat dalam media basa berlangsung secara berurutan: pertama menjadi ion mangan MnO42-, dan kemudian menjadi mangan dioksida MnO2:
Secara kuantitatif, reduksi permanganat dalam media basa menjadi manganat berlangsung dengan adanya garam barium. Ba(MnO4)2 larut dalam air, sedangkan BaMnO4 tidak larut, sehingga reduksi MnVI lebih lanjut dari endapan tidak terjadi.
Secara permanganometrik dalam media alkali, sebagai aturan, senyawa organik ditentukan: format, formaldehida, format, sinamat, tartarat, asam sitrat, hidrazin, aseton, dll.
Indikator akhir titrasi adalah warna merah muda pucat dari titran KMnO4 berlebih (satu tetes larutan titran 0,004 M memberikan warna yang nyata pada 100 ml larutan). Oleh karena itu, jika larutan yang dititrasi tidak berwarna, pencapaian titik ekivalen dapat dinilai dengan munculnya warna merah muda pucat yang melebihi titran KMnO4 pada titrasi langsung atau dengan hilangnya warna pada titrasi terbalik. Saat menganalisis larutan berwarna, disarankan untuk menggunakan indikator ferroin.
Keuntungan dari metode permanganometrik antara lain:
1. Kemungkinan titrasi dengan larutan KMnO4 dalam media apapun (asam, netral, basa).
2. Penerapan larutan kalium permanganat dalam media asam untuk penentuan banyak zat yang tidak berinteraksi dengan zat pengoksidasi yang lebih lemah.
Seiring dengan keuntungan yang terdaftar, metode permanganatometri memiliki sejumlah kelemahan:
1. Titran KMnO4 dibuat sebagai standar sekunder, karena reagen awal, kalium permanganat, sulit diperoleh dalam keadaan murni secara kimiawi.
2. Reaksi yang melibatkan MnO4- dimungkinkan dalam kondisi yang ditentukan secara ketat (pH, suhu, dll.).
4.2 Aplikasimetode
1. Definisi zat pereduksi. Jika reaksi redoks antara reduktor yang ditentukan dan MnO4- berlangsung cepat, maka titrasi dilakukan secara langsung. Ini adalah bagaimana oksalat, nitrit, hidrogen peroksida, besi (II), ferrocyanides, asam arsenik, dll ditentukan:
2О2 + 2MnO4- + 6Н+ = 5О2 + 2Мn2+ + 8Н2О
54- + MnO4- + 8H+ = 53- + 2Mn2+ + 4H2O
AsIII + 2MnO4- + 16H+ = 5AsV + 2Mn2+ + 8H2O
5Fe2+ + MnO4- +8H+ = 5Fe3+ + 2Mn2+ + 4H2O
2. Penentuan oksidator. Tambahkan kelebihan larutan standar pereduksi kemudian titrasi residunya dengan larutan KMnO4 (metode titrasi balik). Misalnya, kromat, persulfat, klorit, klorat dan zat pengoksidasi lainnya dapat ditentukan dengan metode permanganometri, pertama-tama bekerja dengan larutan standar Fe2+ berlebih, dan kemudian mentitrasi jumlah Fe2+ yang tidak bereaksi dengan larutan KMnO4:
Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O + (Fe2+) - kelebihan-
Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O - residu
3. Penentuan zat yang tidak memiliki sifat redoks dilakukan secara tidak langsung, misalnya dengan titrasi substitusi. Untuk melakukan ini, komponen yang ditentukan diubah menjadi bentuk senyawa dengan sifat pereduksi atau pengoksidasi, dan kemudian dilakukan titrasi. Misalnya, kalsium, seng, kadmium, nikel, ion kobalt mengendap dalam bentuk oksalat yang sedikit larut:
M2+ + C2O4- = vMC2O4
Endapan dipisahkan dari larutan, dicuci dan dilarutkan dalam H2SO4:
MC2O4 + H2SO4 = H2C2O4 + MSO4
Kemudian H2C2O4 (substituen) dititrasi dengan larutan KMnO4:
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
4. Penentuan senyawa organik. Ciri khas reaksi senyawa organik dengan MnO4- adalah lajunya yang rendah. Penentuan ini dimungkinkan jika metode tidak langsung digunakan: senyawa yang dianalisis diberi perlakuan awal dengan larutan permangan yang sangat basa dan reaksi dibiarkan berlangsung selama periode waktu yang diperlukan. Residu permanganat dititrasi dengan larutan natrium oksalat:
C3H5(OH)3 + 14MnO4- + 20OH- = 3CO32- + 14MnO42- + 14H2O +
(MnO4-), residu berlebih
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O residu
titrimetri redoks
5. esensidanklasifikasipengendapanmetode
Metode titrasi presipitasi adalah metode analisis titrimetri yang menggunakan titran yang membentuk endapan dengan analit.
Persyaratan untuk reaksi dan analit:
1. Zat yang akan ditentukan harus sangat larut dalam air dan harus membentuk ion yang akan aktif dalam reaksi pengendapan.
2. Endapan yang diperoleh dalam reaksi harus praktis tidak larut (PR< 10 -8 ? - 10 , S < 10 -5).
3. Hasil titrasi tidak boleh terdistorsi oleh fenomena adsorpsi (kopresipitasi).
4. Pengendapan harus terjadi cukup cepat (yaitu tidak ada larutan lewat jenuh yang terbentuk).
5. Seharusnya mungkin untuk memperbaiki titik ekivalen.
Klasifikasi metode titrasi pengendapan tergantung pada titran yang digunakan:
Argentometri (titran AgNO 3);
Merkurometri (titran Hg 2 (NO 3) 2);
Tiosianatometri (titrasi NH 4 SCN);
Sulfatometri (titran H 2 SO 4, BaCl 2);
Kromatometri (titran K 2 CrO 4);
Heksasianoferratometri (titran K 4 ).
6. kurvatitrasidanmilik merekaanalisis
Konstruksi kurva titrasi dilakukan berdasarkan perhitungan sesuai dengan aturan produk kelarutan dan, masing-masing.
Kurva titrasi dibangun dalam koordinat yang menunjukkan perubahan konsentrasi ion yang ditentukan tergantung pada volume titran yang ditambahkan.
Semakin besar lompatan titrasi pada kurva, semakin besar peluang untuk memilih indikator yang sesuai.
Faktor-faktor yang mempengaruhi besarnya lompatan pada kurva titrasi curah hujan:
1. Konsentrasi larutan titran dan ion target Semakin tinggi konsentrasi, semakin besar lompatan pada kurva titrasi.
2. Kelarutan endapan yang terbentuk selama titrasi (semakin rendah kelarutannya, semakin besar lompatan titrasi).
Ketergantungan titrasi melompat pada kelarutan elektrolit yang sedikit larut.
3. Suhu
Semakin tinggi suhu, semakin besar kelarutan endapan dan semakin kecil lompatan kurva titrasi. Titrasi dilakukan pada suhu kamar.
4. Kekuatan ionik larutan
Pengaruhnya relatif kecil, karena kekuatan ionik larutan, dibandingkan dengan faktor lain, tidak terlalu mengubah kelarutan endapan; namun, semakin tinggi kekuatan ionik larutan, semakin tinggi kelarutan dan semakin kecil lompatan titrasi.
7. Argentometri
Argentometri adalah metode titrasi presipitasi, yang didasarkan pada pembentukan garam Argentum yang hampir tidak larut:
X - + Ag + \u003d AgX,
dimana X - = Cl - , Br - , I - , CN - , SCN - dst.
Titran: AgNO 3 - larutan standar sekunder.
Standarisasi: untuk larutan standar utama natrium klorida NaCl:
Indikator untuk standarisasi adalah 5% kalium kromat K 2 CrO 4 . Titrasi dilakukan sampai endapan argentum kromat berwarna coklat-merah muncul:
Tergantung pada metode titrasi dan indikator yang digunakan, metode argentometri diklasifikasikan menjadi:
Non-indikator: - Metode Gay-Lussac (metode kabut sama)
Metode ke titik pencerahan
Indikator: - Metode Mohr
Metode Faience-Fischer-Khodakov
Metode folgard
Lebih banyak metode
Titran: AgNO 3 - detik. std. larutan.
AgNO 3 + NaCl \u003d AgCl? + NaNO3
Indikatornya adalah 5% kalium kromat K 2 CrO 4 (sampai argentum kromat berwarna coklat-merah):
2AgNO 3 + K 2 CrО 4 = Ag 2 CrО 4 ?+ 2KNO 3
Zat yang ditentukan: klorida Cl - , bromida Br - .
Sedang: pH ~ 6,5-10,3.
Aplikasi: penentuan kuantitatif natrium klorida, kalium klorida, natrium bromida, kalium bromida dalam zat zat obat.
Batasan aplikasi:
1. Jangan titrasi larutan asam:
2CrО 4 2- + 2H + = Cr 2 O 7 2- + H 2 O
2. Tidak mungkin untuk melakukan titrasi dengan adanya amonia dan ion lainnya, molekul yang dapat bertindak sebagai ligan terhadap ion Argentum dalam reaksi pembentukan kompleks.
3. Titrasi tidak mungkin dilakukan dengan adanya banyak kation (Ba 2+ , Pb 2+ , dll.), yang membentuk endapan berwarna dengan ion kromat CrO 4 2- .
4. Jangan titrasi dengan adanya zat pereduksi yang bereaksi dengan ion CrO 4 2-kromat, mengubahnya menjadi ion Cr 3+.
5. Titrasi tidak mungkin dilakukan dengan adanya banyak anion (PO 4 3-, AsO 4 3-, AsO 3 3-, S 2-, dll.), yang membentuk endapan berwarna argentum dengan ion argentum.
Metode Faience-Fischer-Khodakov
Titran: AgNO 3 - detik. std. larutan
Standarisasi untuk yang pertama. std. dengan larutan natrium klorida NaCl dengan cara dipipet:
AgNO 3 + NaCl \u003d AgCl? + NaNO3
Indikator untuk standarisasi adalah larutan 5% kalium kromat K 2 CrO 4 (sampai endapan argentum kromat berwarna coklat-merah):
2AgNO 3 + K 2 CrО 4 = Ag 2 CrО 4 ?+ 2KNO 3
Medium: pH ~ 6,5-10,3 saat menentukan klorida dan pH ~ 2,0-10,3 saat menentukan bromida dan iodida.
Indikator metode:
Fluorescein dalam penentuan klorida;
Eosin dalam penentuan bromida dan iodida.
Mekanisme kerja indikator: adsorpsi. Indikator adsorpsi adalah indikator yang adsorpsi atau desorpsinya oleh endapan disertai dengan perubahan warna pada T.E. atau di dekatnya.
AgNO 3 + NaCl \u003d AgCl? + NaNO3
Belakang x H + + Ind - .
Kondisi titrasi:
1. Keasaman larutan
2. Konsentrasi larutan yang bereaksi
3. Memperhitungkan kapasitas adsorpsi indikator dan ion yang ada dalam larutan.
4. Titrasi mendekati te harus dilakukan perlahan-lahan
5. Titrasi dengan indikator adsorpsi dilakukan dalam cahaya hambur.
Aplikasi: penentuan kuantitatif klorida, bromida, iodida, tiosianat, sianida.
Metode folgard
Titran: AgNO 3 , amonium atau kalium tiosianat NH 4 SCN, KSCN - larutan standar sekunder.
Standarisasi AgNO 3 untuk yang pertama. std. Larutan NaCl dengan pipet:
AgNO 3 + NaCl \u003d AgCl? + NaNO3
Indikator standarisasi AgNO 3 adalah larutan 5% kalium kromat K 2 CrO 4 (sampai muncul endapan argentum kromat berwarna coklat-merah):
2AgNO 3 + K 2 CrО 4 = Ag 2 CrО 4 + 2KNO 3
Standarisasi NH 4 SCN, KSCN untuk larutan standar AgNO 3 :
AgNO 3 + NH 4 SCN = AgSCN + NH 4 NO 3
Indikator standarisasi amonium atau kalium tiosianat adalah garam ferum (ІІІ) (misalnya, NH 4 Fe (SO 4) 2 12H 2 O dengan adanya asam nitrat):
Fe 3+ + SCN - \u003d 2+
Titrasi sampai muncul warna merah muda samar.
Rabu: nitrat.
Indikator metode: garam ferum (ІІІ) NH 4 Fe(SO 4) 2 ?12H 2 O dengan adanya asam nitrat.
Zat yang ditentukan: ion halida, sianida, tiosianat, sulfida, karbonat, kromat, oksalat, arsenat, dll.
Hal - + Ag + (kelebihan) = AgHal
Ag + (residu) + SCN - = AgSCN,
dan setelah titik ekivalen:
Fe 3+ + SCN - \u003d 2+
(warna pink-merah)
Saat menentukan iodida, indikator ditambahkan pada akhir titrasi untuk menghindari reaksi paralel:
2Fe 3+ + 2I - = 2Fe 2+ + I 2
Manfaat metode Volhard - kemampuan titrasi:
Dalam larutan yang sangat asam;
Dengan adanya banyak kation yang mengganggu penentuan dengan metode Mohr (kation barium, plumbum, dll, yang membentuk endapan berwarna kromat).
8. Merkurometri
Merkurometri adalah metode titrasi presipitasi, yang didasarkan pada penggunaan reaksi pembentukan garam merkuri (I) Hg 2 2+, hampir tidak larut dengan presipitasi:
2Cl - + Hg 2 2+ \u003d Hg 2 Cl 2 PR \u003d 1,3 × 10 -18
2I - + Hg 2 2+ \u003d Hg 2 I 2 PR \u003d 4,5 H10 -29
Titran: detik. std. larutan Hg2 (NO3)2.
Standarisasi: untuk larutan standar NaCl:
Hg 2 (NO 3) 2 + 2NaCl \u003d Hg 2 Cl 2 + 2NaNO 3
Indikator: 1) larutan ferum (ІІІ) tiosianat (dari merah menjadi perubahan warna)
2Fe(SCN) 2+ + Hg 2 2+ = Hg 2 (SCN) 2 + 2Fe 3+ ;
1-2% larutan alkohol difenilkarbazon (sampai muncul warna biru).
Untuk menghitung volume titran yang digunakan untuk mentitrasi indikator, titrasi "sampel buta":
2) Indikator ditambahkan sebelum akhir titrasi, karena jika ditambahkan terlebih dahulu, mungkin lama sebelum t.e. difenilkarbazida merkuri (II) terbentuk dan memberikan warna biru lebih cepat dari halida yang dititrasi.
Zat yang ditentukan: klorida dan iodida.
Lingkungan: sangat asam (dapat mencapai 5 mol/l ion H+).
Kerugian: Garam merkuri (I) sangat beracun.
9. Sulfametri
Sulfatometri adalah metode titrasi presipitasi, yang didasarkan pada penggunaan reaksi pembentukan garam yang sedikit larut - sulfat.
Terkadang barimetri dibedakan - metode titrasi pengendapan, yang didasarkan pada penggunaan reaksi untuk pembentukan garam barium yang tidak larut.
Metode ini didasarkan pada reaksi pembentukan presipitasi barium sulfat:
Ba 2+ + SO 4 2- \u003d BaSO 4
def. zat titran
Titran: detik. std. larutan H 2 SO 4 , Ba(NO 3) 2 , BaCl 2 .
Standarisasi: larutan H 2 SO 4 dengan Na 2 B 4 O 7 atau Na 2 CO 3 dengan jingga metil; Ba (NO 3) 2 dan BaCl 2 untuk H 2 SO 4 dengan nitrochromazo atau orthonyl A.
Indikator: indikator metalokromik digunakan (mereka berubah warna dengan adanya ion logam) - nitrchromazo (ortanil C), ortanil A. Indikator ini berwarna merah muda dalam larutan, dan ungu dengan adanya kation barium.
Zat yang ditentukan dalam titrasi langsung:
asam sulfat - kandungan barium;
barium klorida atau barium nitrat - kandungan sulfat.
Kesimpulan
Dari metode analisis titrimetri, titrasi redoks tersebar luas, batas penerapan metode ini lebih luas daripada metode asam basa atau kompleksometri. Karena berbagai macam reaksi redoks, metode ini memungkinkan untuk menentukan sejumlah besar berbagai macam zat, termasuk yang tidak secara langsung menunjukkan sifat redoks.
Permanganatometri digunakan untuk menentukan oksidasi keseluruhan air dan tanah. Pada saat yang sama, semua komponen organik (termasuk asam humat tanah dan air alami) bereaksi dengan ion MnO4 - dalam lingkungan asam. Jumlah milimol ekuivalen KMnO4 yang digunakan untuk titrasi merupakan karakteristik kemampuan oksidasi (oleh permanganat).
Permanganatometri juga digunakan untuk analisis senyawa organik yang mudah teroksidasi (aldehida, keton, alkohol, asam karboksilat: oksalat, tartarat, sitrat, malat, serta gugus hidrazo). Dalam industri makanan, permanganatometri dapat digunakan untuk mengetahui kandungan gula dalam produk makanan dan bahan baku, kandungan nitrit dalam sosis.
Dalam industri metalurgi, kandungan besi dalam garam, paduan, logam, bijih dan silikat ditentukan oleh permanganatometri.
Daftarliteratur
1. Kimia analitik. Metode analisis kimia / ed. O.M. petrukhin. Moskow: Kimia, 1992, 400 hal.
2. Vasiliev V.P. Kimia Analisis. Pukul 2 siang Bagian 1. Metode analisis gravimetri dan titrimetri. M.: Sekolah Tinggi, 1989, 320 hal.
3. Dasar-dasar kimia analitik. Dalam 2 buku. Buku. 2. Metode analisis kimia / red. Yu.A. Zolotova. Moskow: Sekolah Tinggi, 2000, 494 hal.
Diselenggarakan di Allbest.ru
...Dokumen serupa
Ciri khas reaksi redoks. Skema elektroda hidrogen standar. persamaan Nernst. Kurva titrasi teoritis. Pengertian titik ekivalen. Indikator redoks, permanganatometri.
makalah, ditambahkan 05/06/2011
Klasifikasi metode titrasi redoks. Indikator titrasi redoks. Permanganatometri, iodometri dan dikromatometri. Pewarnaan bentuk teroksidasi dan tereduksi. Memperbaiki titik ekivalen.
abstrak, ditambahkan 23/02/2011
Fitur metode titrasi redoks. Persyaratan dasar untuk reaksi, konstanta kesetimbangan. Karakteristik jenis-jenis titrasi redoks, indikator dan kurvanya. Persiapan dan standarisasi larutan.
makalah, ditambahkan 25/12/2014
Klasifikasi metode analisis titrametri. Inti dari metode "netralisasi". Persiapan solusi kerja. Perhitungan titik dan konstruksi kurva untuk titrasi asam-basa dan redoks. Kelebihan dan kekurangan iodometri.
makalah, ditambahkan 17/11/2013
Klasifikasi metode titrasi redoks. Faktor yang mempengaruhi laju reaksi. Indikator spesifik dan redoks. Inti dari permanganatometri, iodometri, dikromatometri. Pembuatan larutan kalium dikromat.
presentasi, ditambahkan 19 03/2015
Metode titrasi asam-basa: konsep dan kandungan, tahapan utama dan prinsip penerapan, persyaratan, kondisi utama, dan kemungkinan penerapan. Perhitungan pH larutan. Konstruksi kurva titrasi. Pilihan indikator dan alasannya.
presentasi, ditambahkan 16/05/2014
Konsep analisis titrametri. Titrasi redoks, jenis dan kondisi reaksinya. Perhitungan titik kurva titrasi, potensial, konstruksi kurva titrasi. Pemilihan indikator, perhitungan kesalahan titrasi indikator.
makalah, ditambahkan 10/06/2012
Metode analisis titrimetri. Teori metode analisis bromatometrik. Teknik titrasi. Kelebihan dan kekurangan metode bromatometrik. Fenol. Penentuan fenol. Reaksi kimia yang digunakan dalam metode titrimetri.
makalah, ditambahkan 26/03/2007
Klasifikasi titrasi redoks; penggunaannya dalam analisis farmasi, dalam menentukan oksidasi air dan senyawa organik. Pertimbangan titrasi redoks pada contoh cerimetri. Titrasi garam besi dengan serium sulfat.
makalah, ditambahkan 12/09/2012
Penentuan air kristalisasi dalam barium klorida. Pengaturan titer larutan kerja asam klorida. Metode titrasi asam basa dan redoks. Penentuan kandungan ion dalam suatu larutan dengan metode analisis kualitatif.
Kirim karya bagus Anda di basis pengetahuan sederhana. Gunakan formulir di bawah ini
Mahasiswa, mahasiswa pascasarjana, ilmuwan muda yang menggunakan basis pengetahuan dalam studi dan pekerjaan mereka akan sangat berterima kasih kepada Anda.
Diposting pada http://www.allbest.ru/
Rencana
1. Esensi titrasi presipitasi
2. Titrasi argentometri
3. Titrasi tiosianatometri
4. Penerapan titrasi presipitasi
4.1 Persiapan larutan perak nitrat standar
4.2 Pembuatan larutan standar amonium tiosianat
4.3 Penentuan kandungan klorin sampel menurut Volhard
4.4 Penentuan kandungan natrium trikloroasetat dalam produk teknis
1. Inti dari presipitasititrasi
Metode ini menggabungkan penentuan titrimetri berdasarkan reaksi pembentukan endapan senyawa yang sukar larut. Untuk tujuan ini, hanya reaksi tertentu yang memenuhi kondisi tertentu yang cocok. Reaksi harus berjalan secara ketat menurut persamaan dan tanpa proses samping. Endapan yang dihasilkan harus praktis tidak larut dan mengendap cukup cepat, tanpa pembentukan larutan lewat jenuh. Selain itu, perlu untuk dapat menentukan titik akhir titrasi dengan menggunakan indikator. Akhirnya, fenomena adsorpsi (ko-presipitasi) harus dinyatakan dengan sangat lemah selama titrasi sehingga hasil penentuan tidak terdistorsi.
Nama-nama metode pengendapan individu berasal dari nama-nama solusi yang digunakan. Metode yang menggunakan larutan perak nitrat disebut argentometri. Metode ini menentukan kandungan ion C1~ dan Br~ dalam media netral atau sedikit basa. Tiosianatometri didasarkan pada penggunaan larutan amonium tiosianat NH 4 SCN (atau kalium KSCN) dan berfungsi untuk menentukan jejak C1- dan Br~, tetapi sudah dalam larutan basa dan asam kuat. Ini juga digunakan untuk menentukan kandungan perak dalam bijih atau paduan.
Metode argentometrik yang mahal untuk menentukan halogen secara bertahap digantikan oleh metode mercurometric. Dalam yang terakhir, larutan merkuri nitrat (I) Hg 2 (NO 3) 2 digunakan.
Mari kita perhatikan lebih detail titrasi argentometri dan tiosianatometri.
2. Titrasi argentometri
Metode ini didasarkan pada reaksi pengendapan ion C1~ dan Br~ oleh kation perak dengan pembentukan halida yang sedikit larut:
Cl-+Ag+=AgClb Br^- + Ag+= AgBr
Dalam hal ini, larutan perak nitrat digunakan. Jika zat tersebut dianalisis kandungan peraknya, maka larutan natrium (atau kalium) klorida digunakan. obat larutan titrasi
Kurva titrasi sangat penting untuk memahami metode argentometri. Sebagai contoh, perhatikan kasus titrasi 10,00 ml 0,1 N. larutan natrium klorida 0,1 N. larutan perak nitrit (tanpa memperhitungkan perubahan volume larutan).
Sebelum dimulainya titrasi, konsentrasi ion klorida dalam larutan sama dengan konsentrasi total natrium klorida, yaitu 0,1 mol / l atau \u003d -lg lO-i \u003d 1.
Ketika 9,00 ml larutan perak nitrat ditambahkan ke larutan natrium klorida yang dititrasi dan 90% ion klorida diendapkan, konsentrasinya dalam larutan akan berkurang dengan faktor 10 dan menjadi sama dengan N0 ~ 2 mol/l, dan pC1 akan sama dengan 2. Karena nilai nPAgci= IQ- 10 , konsentrasi ion perak dalam hal ini adalah:
10 / [C1-] \u003d 10-10 / 10-2 \u003d 10-8 M ol / l, ATAU pAg \u003d - lg \u003d - IglO-s \u003d 8.
Demikian pula, semua titik lainnya dihitung untuk memplot kurva titrasi. Pada titik ekivalen pCl=pAg= = 5 (lihat tabel).
Tabel Perubahan pC\ dan pAg selama titrasi 10,00 ml 0,1 N. larutan natrium klorida 0,1 N. larutan perak nitrat
|
Ditambahkan larutan AgNO3, |
|||||
|
9.99 10.00 (titik setara) 10.01 |
yu-4 yu-5 yu-6. |
yu- 6 yu- 5 yu-* |
|||
Interval lompatan dalam titrasi argentometri tergantung pada konsentrasi larutan dan pada nilai produk kelarutan endapan. Semakin kecil nilai PR senyawa hasil titrasi, maka semakin lebar interval lompatan pada kurva titrasi dan semakin mudah untuk menentukan titik akhir titrasi menggunakan indikator.
Yang paling umum adalah penentuan argentometrik klorin dengan metode Mohr. Esensinya terdiri dari titrasi langsung cairan dengan larutan perak nitrat dengan indikator kalium kromat sampai endapan putih berubah menjadi coklat.
Indikator metode Mohr - larutan K2CrO 4 memberikan endapan merah perak kromat Ag 2 CrO 4 dengan perak nitrat, tetapi kelarutan endapan (0,65-10 ~ 4 E / l) jauh lebih besar daripada kelarutan perak klorida ( 1,25X _X10 ~ 5 E / l ). Oleh karena itu, ketika titrasi dengan larutan perak nitrat dengan adanya kalium kromat, endapan merah perak kromat hanya muncul setelah penambahan ion Ag + berlebih, ketika semua ion klorida telah diendapkan. Dalam hal ini, larutan perak nitrat selalu ditambahkan ke cairan yang dianalisis, dan bukan sebaliknya.
Kemungkinan menggunakan argentometri agak terbatas. Ini hanya digunakan ketika mentitrasi larutan netral atau sedikit basa (pH 7 hingga 10). Dalam lingkungan asam, endapan perak kromat larut.
Dalam larutan yang sangat basa, perak nitrat terurai dengan melepaskan oksida tidak larut Ag 2 O. Metode ini juga tidak cocok untuk analisis larutan yang mengandung ion NH ^, karena dalam hal ini kompleks amonia terbentuk dengan kation Ag + + - Larutan yang dianalisis tidak boleh mengandung ion Ba 2 +, Sr 2+ , Pb 2+ , Bi 2+ dan lainnya yang mengendap dengan kalium kromat. Namun demikian, argentometri cocok untuk analisis larutan tidak berwarna yang mengandung ion C1~ dan Br_.
3. Titrasi tiosianatometri
Titrasi tiosianatometri didasarkan pada pengendapan ion Ag+ (atau Hgl+) dengan tiosianat:
Ag+ + SCN- = AgSCN|
Penentuannya membutuhkan larutan NH 4 SCN (atau KSCN). Tentukan Ag+ atau Hgi+ dengan titrasi langsung dengan larutan tiosianat.
Penentuan tiosianatometri halogen dilakukan sesuai dengan apa yang disebut metode Volhard. Esensinya dapat dinyatakan dalam diagram:
CI- + Ag+ (kelebihan) -* AgCI + Ag+ (residu), Ag+ (residu) + SCN~-> AgSCN
Dengan kata lain, kelebihan larutan perak nitrat yang dititrasi ditambahkan ke cairan yang mengandung C1~. Residu AgNO3 kemudian dititrasi kembali dengan larutan tiosianat dan dihitung hasilnya.
Indikator metode Volhard adalah larutan jenuh NH 4 Fe (SO 4) 2 - 12H 2 O. Selama ada ion Ag + dalam cairan titrasi, anion SCN ~ yang ditambahkan mengikat pengendapan AgSCN, tetapi tidak berinteraksi dengan ion Fe3+. Namun, setelah titik ekivalen, sedikit kelebihan NH 4 SCN (atau KSCN) menyebabkan pembentukan ion merah darah 2 + dan +. Berkat ini, dimungkinkan untuk menentukan titik ekivalen.
Definisi tiosianatometri lebih sering digunakan daripada definisi argentometrik. Kehadiran asam tidak mengganggu titrasi Volhard dan bahkan berkontribusi pada hasil yang lebih akurat, karena lingkungan asam menghambat hidrolisis garam Fe**. Metode ini memungkinkan untuk menentukan ion C1~ tidak hanya dalam basa, tetapi juga dalam asam. Penetapan tersebut tidak mengganggu keberadaan Ba2+, Pb2+, Bi3+ dan beberapa ion lainnya. Namun, jika larutan yang dianalisis mengandung zat pengoksidasi atau garam merkuri, maka penerapan metode Volhard menjadi tidak mungkin: zat pengoksidasi menghancurkan ion SCN-, dan kation merkuri mengendapkannya.
Larutan uji basa dinetralkan sebelum titrasi dengan asam nitrat, sebaliknya ion Fe 3+ yang merupakan bagian dari indikator akan mengendapkan besi (III) hidroksida.
4. Penerapan titrasi presipitasi
4.1 Persiapan larutan standar perak nitrat
Standar utama untuk standarisasi larutan perak nitrat adalah natrium atau kalium klorida. Siapkan larutan standar natrium klorida dan kira-kira 0,02 N. larutan perak nitrat, standarkan larutan kedua sesuai dengan yang pertama.
Pembuatan larutan standar natrium klorida. Suatu larutan natrium klorida (atau kalium klorida) dibuat dari garam kimia murni. Massa ekivalen natrium klorida sama dengan massa molarnya (58,45 g/mol). Secara teoritis, untuk preparasi 0,1 l 0,02 N. larutan membutuhkan 58,45-0,02-0,1 \u003d 0,1169 g NaCl.
Ambil sampel kurang lebih 0,12 g natrium klorida pada neraca analitik, pindahkan ke dalam labu takar 100 ml, larutkan, tandai volume dengan air, aduk rata. Hitung titer dan konsentrasi normal larutan stok natrium klorida.
Pembuatan 100 ml kira-kira 0,02 N. larutan perak nitrat. Perak nitrat adalah reagen yang langka, dan biasanya larutannya memiliki konsentrasi tidak lebih tinggi dari 0,05 N. Untuk pekerjaan ini, 0,02 n cukup cocok. larutan.
Dalam titrasi argentometri, massa ekivalen AgN0 3 sama dengan massa molar, yaitu 169,9 g / mol. Oleh karena itu, 0,1 l 0,02 n. larutan harus mengandung 169,9-0,02-0,1 \u003d 0,3398 g AgNO 3. Namun, tidak masuk akal untuk mengambil sampel seperti itu, karena perak nitrat komersial selalu mengandung kotoran. Timbang pada timbangan teknokimia sekitar 0,34 - 0,35 g perak nitrat; timbang dalam labu takar berkapasitas 100 ml, larutan dalam sedikit air dan bawa volumenya dengan air; simpan larutan dalam labu, bungkus dengan kertas hitam dan tuangkan ke dalam botol kaca gelap. larutan belerang nitrat dengan natrium klorida, perak dan siapkan untuk titrasi. Bilas pipet dengan larutan natrium klorida dan pindahkan 10,00 ml larutan ke dalam labu berbentuk kerucut. Tambahkan 2 tetes larutan kalium kromat jenuh dan titrasi dengan hati-hati dengan larutan perak nitrat setetes demi setetes sambil diaduk. Pastikan campuran berubah dari kuning menjadi kemerahan dengan satu tetes perak nitrat berlebih. Setelah mengulangi titrasi 2-3 kali, ambil rata-rata pembacaan konvergen dan hitung konsentrasi normal larutan perak nitrat.
Mari kita asumsikan bahwa untuk titrasi 10,00 ml 0,02097 N. larutan natrium klorida rata-rata 10,26 ml larutan perak nitrat. Kemudian
A^ AgNOj . 10,26 = 0,02097. 10.00, AT AgNO = 0,02097-10,00/10,26 = 0,02043
Jika seharusnya menentukan kandungan C1 ~ dalam sampel, maka, selain itu, titer larutan perak nitrat dalam klorin dihitung: T, - \u003d 35,46-0. ml larutan perak nitrat sesuai dengan 0,0007244 g klorin yang dititrasi.
4.2 Persiapan larutan amonium tiosianat standarsaya
Larutan NH 4 SCN atau KSCN dengan titer yang diketahui secara pasti tidak dapat dibuat dengan melarutkan sampel, karena garam ini sangat higroskopis. Oleh karena itu, siapkan larutan dengan perkiraan konsentrasi normal dan atur ke dalam larutan standar perak nitrat. Indikatornya adalah larutan jenuh NH 4 Fe (SO 4) 2 - 12H 2 O. Untuk mencegah hidrolisis garam Fe, ditambahkan 6 N ke indikator itu sendiri dan ke dalam larutan yang dianalisis sebelum titrasi. asam sendawa.
Pembuatan 100 ml kira-kira 0,05 N. larutan amonium tiosianat. Massa ekivalen NH4SCN sama dengan massa molarnya, yaitu 76,12 g/mol. Oleh karena itu, 0,1 l 0,05 n. larutan harus mengandung 76.12.0.05-0.1=0,3806 g NH 4 SCN.
Ambil sampel sekitar 0,3-0,4 g pada neraca analitik, pindahkan ke labu 100 ml, larutkan, encerkan volume larutan dengan air hingga tanda dan campur.
Standarisasi larutan amonium tiosianat dengan perak nitrat. Siapkan buret untuk titrasi dengan larutan NH4 SCN. Bilas pipet dengan larutan perak nitrat dan ukur 10,00 ml ke dalam labu berbentuk kerucut. Tambahkan 1 ml larutan NH 4 Fe(SO 4) 2 (indikator) dan 3 ml. 6 n. asam sendawa. Perlahan, dengan pengadukan terus menerus, tuangkan larutan NH 4 SCN dari buret. Hentikan titrasi ketika warna coklat-merah muda 2+ muncul, yang tidak hilang dengan pengocokan yang kuat.
Ulangi titrasi 2-3 kali, ambil rata-rata dari pembacaan konvergen dan hitung konsentrasi normal NH 4 SCN.
Asumsikan bahwa untuk titrasi 10,00 ml 0,02043 N. larutan perak nitrat masuk rata-rata 4,10 ml larutan NH 4 SCN.
4.3 Definisiisiklorin dalam sampel menurut Folgard
Halogen volhard ditentukan dengan titrasi balik residu perak nitrat dengan larutan NH 4 SCN. Namun, titrasi yang akurat hanya mungkin dilakukan di sini dengan syarat bahwa tindakan diambil untuk mencegah (atau memperlambat) reaksi antara perak klorida dan kelebihan besi tiosianat:
3AgCI + Fe(SCN) 3 = SAgSCNJ + FeCl 3
di mana warna yang muncul pada awalnya berangsur-angsur menghilang. Yang terbaik adalah menyaring endapan AgCl sebelum mentitrasi kelebihan perak nitrat dengan larutan NH 4 SCN. Tetapi kadang-kadang, sebagai gantinya, beberapa cairan organik ditambahkan ke larutan, tidak dicampur dengan air dan, seolah-olah, mengisolasi endapan ApCl dari kelebihan nitrat.
Metode definisi. Ambil tabung reaksi dengan larutan analit yang mengandung natrium klorida. Sebagian zat yang ditimbang dilarutkan dalam labu volumetrik dengan kapasitas 100 ml dan volume larutan dibawa ke tanda dengan air (konsentrasi klorida dalam larutan tidak boleh lebih dari 0,05 N).
Pipet 10,00 ml larutan yang dianalisis ke dalam labu berbentuk kerucut, tambahkan 3 ml 6N. asam nitrat dan tambahkan kelebihan larutan AgNO 3 yang diketahui dari buret, misalnya 18,00 ml. Kemudian saring endapan perak klorida. Titrasi residu perak nitrat dengan NH 4 SCN seperti yang dijelaskan pada paragraf sebelumnya. Setelah mengulangi definisi 2-3 kali, ambil rata-ratanya. Jika endapan perak klorida disaring, maka harus dicuci dan cucian ditambahkan ke filtrat.
Mari kita asumsikan bahwa berat sampel adalah 0,2254 g. Untuk 10,00 ml larutan yang dianalisis ditambahkan 18,00 ml 0,02043 N. larutan perak nitrat. Untuk titrasi kelebihannya 5,78 ml * 0,04982 n. larutan NH4 SCN.
Pertama-tama, kami menghitung berapa volume 0,02043 n. larutan perak nitrat sesuai dengan 5,78 ml 0,04982 N yang dihabiskan untuk titrasi. larutan NH4 SCN:
akibatnya, 18.00 - 14.09 = 3,91 ml 0,2043 n pergi ke pengendapan ion C1 ~. larutan perak nitrat. Dari sini mudah untuk menemukan konsentrasi normal larutan natrium klorida.
Karena massa ekivalen klorin adalah 35,46 g/mol*, maka massa total klorin dalam sampel adalah:
772 \u003d 0,007988-35,46-0,1 \u003d 0,02832 g.
0,2254 g C1 - 100%
x \u003d 0,02832-100 / 0,2254 \u003d 12,56%.:
0,02832 > C1 -- x%
Menurut metode Folgard, kandungan ion Br~ dan I- juga ditentukan. Pada saat yang sama, tidak diperlukan untuk menyaring endapan perak bromida atau iodida. Tetapi harus diperhitungkan bahwa ion Fe 3 + mengoksidasi iodida menjadi yodium bebas. Oleh karena itu, indikator ditambahkan setelah pengendapan semua ion I-perak nitrat.
4.4 Penentuan konten triklHAInatrium asetat | dalam persiapan teknis (untuk klorin)
Natrium trikloroasetat teknis (TXA) adalah herbisida untuk mengendalikan gulma rumput. Ini adalah zat kristal putih atau coklat muda, sangat larut dalam air. Menurut Folgard, fraksi massa senyawa organoklorida pertama kali ditentukan, dan kemudian setelah penghancuran klorin. Dengan perbedaan, temukan fraksi massa (%) natrium klorin trikloroasetat.
Penentuan fraksi massa (%) senyawa anorganik klorin. Ditimbang secara akurat 2-2,5 g obat, masukkan ke dalam labu volumetrik dengan kapasitas 250 ml, larutkan, encerkan larutan dengan air sampai tanda, campur. Pipet 10 ml larutan ke dalam labu berbentuk kerucut dan tambahkan 5-10 ml asam nitrat pekat.
Tambahkan dari buret 5 atau 10 ml 0,05 N. larutan perak nitrat dan kelebihannya, titrasi dengan 0,05 N. Larutan NH 4 SCN dengan adanya NH 4 Fe(SO 4) 2 (indikator).
Hitung fraksi massa (%) klorin (x) senyawa anorganik menggunakan rumus
(V - l / i) 0,001773-250x100
di mana V adalah volume tepat 0,05 n. larutan AgNO 3 diambil untuk analisis; Vi -- volumenya tepat 0,05 N. Larutan NH 4 SCN digunakan untuk titrasi kelebihan AgNO 3 ; t adalah sampel natrium trikloroasetat; 0,001773 adalah massa klorin yang sesuai dengan 1 ml 0,05 N. larutan AgNO. Penentuan fraksi massa (%) klorin total. Masukkan 10 ml larutan yang telah disiapkan sebelumnya ke dalam labu takar, tambahkan 10 ml larutan dengan fraksi massa NaOH 30% dan 50 ml air. Hubungkan labu ke kondensor manik refluks dan didihkan isinya selama 2 jam Biarkan cairan dingin, bilas kondensor dengan air, kumpulkan air cucian di labu yang sama. Tambahkan 20 ml asam nitrat encer (1:1) ke dalam larutan dan tuangkan 30 ml 0,05 N. larutan perak nitrat. Titrasi kelebihan perak nitrat dengan 0,05 N. Larutan NH 4 SCN dengan adanya NH 4 Fe(SO 4) 2. Hitung fraksi massa (%) dari total klorin (xi) menggunakan rumus di atas. Temukan fraksi massa (%) natrium trikloroasetat dalam sediaan (х^) menggunakan rumus
x2 \u003d (x1 - x) (185,5 / 106,5),
di mana 185,5 adalah massa molar natrium trikloroasetat; 106,5 adalah massa klorin yang terkandung dalam massa molar natrium trikloroasetat.
Diselenggarakan di Allbest.ru
...Dokumen serupa
Esensi dan klasifikasi metode titrasi asam-basa, penggunaan indikator. Fitur titrasi kompleksometri. Analisis metode titrasi presipitasi. Deteksi titik akhir titrasi. Konsep argenometri dan ticyanometry.
tes, ditambahkan 23/02/2011
Urutan perhitungan kurva titrasi larutan asam klorida dengan larutan basa lemah amonium hidroksida. Konstruksi kurva titrasi, penentuan titik ekivalen dan netralitas langsung. Memilih indikator dan menghitung kesalahannya.
pekerjaan kontrol, ditambahkan 01/03/2016
Penentuan kandungan pembawa alkalinitas dalam larutan natrium karbonat dengan titrasi asam-basa langsung. Ekspresi matematis dari hukum ekivalen. Konstruksi kurva integral dan kurva diferensial dari titrasi potensiometri.
pekerjaan laboratorium, ditambahkan 15/02/2012
Konsep dan jenis analisis titrimetri. Karakterisasi agen pengompleks dan indikator. Persiapan larutan titrasi untuk titrasi kompleksometri. Metodologi untuk mempelajari aluminium, bismut, timbal, magnesium, seng.
makalah, ditambahkan 13/01/2013
Metode titrasi potensiometri. Titrasi asam basa. Penentuan titik akhir titrasi. Metode melakukan titrasi potensiometri. Titrasi potensiometri, instrumen yang digunakan dan pengolahan hasil analisis.
makalah, ditambahkan 24/06/2008
Klasifikasi metode titrasi redoks. Faktor yang mempengaruhi laju reaksi. Indikator spesifik dan redoks. Inti dari permanganatometri, iodometri, dikromatometri. Pembuatan larutan kalium dikromat.
presentasi, ditambahkan 19 03/2015
Perhitungan error indikator untuk indikator terpilih, kurva titrasi dengan 25 ml larutan CH3COOH 0,05 M dengan larutan KOH 0,05 M. Indikator asam basa. Tahapan titrasi: titik awal, area sebelum titik dan area setelah titik ekivalen.
tes, ditambahkan 18/12/2013
Fitur metode titrasi redoks. Persyaratan dasar untuk reaksi, konstanta kesetimbangan. Karakteristik jenis-jenis titrasi redoks, indikator dan kurvanya. Persiapan dan standarisasi larutan.
makalah, ditambahkan 25/12/2014
Konsep analisis titrametri. Titrasi redoks, jenis dan kondisi reaksinya. Perhitungan titik kurva titrasi, potensial, konstruksi kurva titrasi. Pemilihan indikator, perhitungan kesalahan titrasi indikator.
makalah, ditambahkan 10/06/2012
Klasifikasi metode analisis titrametri. Inti dari metode "netralisasi". Persiapan solusi kerja. Perhitungan titik dan konstruksi kurva untuk titrasi asam-basa dan redoks. Kelebihan dan kekurangan iodometri.