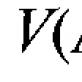Mendapatkan, sifat kimia dan aplikasi fenol. Fenol Formula untuk memperoleh fenol dari benzena
Menurut jumlah gugus hidroksil:
monoatomik; Sebagai contoh:
diatomik; Sebagai contoh:

triatomik; Sebagai contoh:

Ada fenol dan atomisitas yang lebih tinggi.
Fenol monoatomik paling sederhana
C 6 H 5 OH - fenol (hidroksibenzena), nama sepelenya adalah asam karbol.

Fenol dihidrat yang paling sederhana

Struktur elektronik molekul fenol. Saling pengaruh atom dalam molekul
Gugus hidroksil -OH (seperti radikal alkil) adalah substituen dari jenis pertama, yaitu donor elektron. Hal ini disebabkan oleh fakta bahwa salah satu pasangan elektron bebas dari atom oksigen hidroksil masuk ke p, -konjugasi dengan sistem dari inti benzena.

Hasil dari ini adalah:
Peningkatan kerapatan elektron pada atom karbon pada posisi orto dan para dari inti benzena, yang memfasilitasi penggantian atom hidrogen pada posisi ini;
Peningkatan polaritas ikatan O-H, menyebabkan peningkatan sifat asam fenol dibandingkan dengan alkohol.
Tidak seperti alkohol, fenol terdisosiasi sebagian dalam larutan berair menjadi ion:

yaitu menunjukkan sifat asam lemah.
Properti fisik
Fenol paling sederhana dalam kondisi normal adalah zat kristal tidak berwarna dengan titik leleh rendah dengan bau yang khas. Fenol sedikit larut dalam air, tetapi mudah larut dalam pelarut organik. Mereka adalah zat beracun yang menyebabkan kulit terbakar.
Sifat kimia
I. Reaksi yang melibatkan gugus hidroksil (sifat asam)

(reaksi netralisasi, tidak seperti alkohol)

Fenol adalah asam yang sangat lemah, oleh karena itu fenolat diuraikan tidak hanya oleh asam kuat, tetapi bahkan oleh asam lemah seperti karbonat:

II. Reaksi yang melibatkan gugus hidroksil (pembentukan ester dan eter)
Seperti alkohol, fenol dapat membentuk eter dan ester.
Ester dibentuk oleh interaksi fenol dengan anhidrida atau klorida asam karboksilat (esterifikasi langsung dengan asam karboksilat lebih sulit):

Eter (alkilaril) dibentuk oleh interaksi fenolat dengan alkil halida:

AKU AKU AKU. Reaksi substitusi yang melibatkan cincin benzena

Pembentukan endapan putih tribromofenol kadang-kadang dianggap sebagai reaksi kualitatif terhadap fenol.

IV. Reaksi adisi (hidrogenasi)

V. Reaksi kualitatif dengan besi (III) klorida
Fenol monatomik + FeCl 3 (larutan) → Warna biru-ungu, menghilang saat diasamkan.
Fenol- turunan dari hidrokarbon aromatik, yang dapat mencakup satu atau lebih gugus hidroksil yang terhubung ke cincin benzena.
Apa nama senyawa fenol?
Menurut aturan IUPAC, nama " fenol". Penomoran atom berasal dari atom yang berhubungan langsung dengan gugus hidroksi (jika yang tertua) dan diberi nomor sehingga substituen menerima jumlah terkecil.
Perwakilan - fenol - C 6 H 5 OH:
Struktur fenol.
Atom oksigen memiliki pasangan elektron yang tidak digunakan bersama di tingkat terluar, yang "ditarik" ke dalam sistem cincin (+ M-efek APAKAH DIA-kelompok). Akibatnya, 2 efek dapat terjadi:
1) peningkatan kerapatan elektron cincin benzena ke posisi orto dan para. Pada dasarnya, efek ini dimanifestasikan dalam reaksi substitusi elektrofilik.
2) kepadatan pada atom oksigen berkurang, akibatnya ikatan DIA melemah dan dapat pecah. Efeknya dikaitkan dengan peningkatan keasaman fenol dibandingkan dengan alkohol jenuh.
Derivatif tersubstitusi tunggal fenol(kresol) dapat dalam 3 isomer struktural:

Sifat fisik fenol.
Fenol adalah zat kristal pada suhu kamar. Kurang larut dalam air dingin, tetapi baik - dalam larutan alkali panas dan berair. Mereka memiliki bau yang khas. Karena pembentukan ikatan hidrogen, mereka memiliki titik didih dan titik leleh yang tinggi.
Mendapatkan fenol.
1. Dari halobenzena. Ketika klorobenzena dan natrium hidroksida dipanaskan di bawah tekanan, natrium fenolat diperoleh, yang, setelah berinteraksi dengan asam, berubah menjadi fenol:
2. Metode industri: selama oksidasi katalitik cumene di udara, fenol dan aseton diperoleh:

3. Dari asam sulfonat aromatik melalui fusi dengan basa. Lebih sering, reaksi dilakukan untuk mendapatkan fenol polihidrat:

Sifat kimia fenol.
R-orbital atom oksigen membentuk sistem tunggal dengan cincin aromatik. Oleh karena itu, kerapatan elektron pada atom oksigen berkurang, pada cincin benzena meningkat. Polaritas komunikasi DIA meningkat, dan hidrogen dari gugus hidroksil menjadi lebih reaktif dan dapat dengan mudah digantikan oleh atom logam bahkan di bawah pengaruh alkali.
Keasaman fenol lebih tinggi daripada alkohol, sehingga reaksi dapat dilakukan:
Tapi fenol adalah asam lemah. Jika karbon dioksida atau sulfur dioksida dilewatkan melalui garamnya, maka fenol dilepaskan, yang membuktikan bahwa asam karbonat dan asam sulfat adalah asam yang lebih kuat:
Sifat asam fenol dilemahkan dengan pengenalan substituen jenis pertama ke dalam cincin dan ditingkatkan dengan pengenalan II.
2) Pembentukan ester. Proses berlangsung di bawah pengaruh asam klorida:
3) Reaksi substitusi elektrofilik. Karena APAKAH DIA-gugus adalah substituen jenis pertama, maka reaktivitas cincin benzena pada posisi orto dan para meningkat. Di bawah aksi air brom pada fenol, pengendapan diamati - ini adalah reaksi kualitatif terhadap fenol:

4) Nitrasi fenol. Reaksi dilakukan dengan campuran nitrasi, menghasilkan pembentukan asam pikrat:

5) Polikondensasi fenol. Reaksi berlangsung di bawah pengaruh katalis:

6) Oksidasi fenol. Fenol mudah teroksidasi oleh oksigen atmosfer:

7) Reaksi kualitatif terhadap fenol adalah efek dari larutan besi klorida dan pembentukan kompleks ungu.
Penggunaan fenol.
Fenol digunakan dalam produksi resin fenol-formaldehida, serat sintetis, pewarna dan obat-obatan, dan desinfektan. Asam pikrat digunakan sebagai bahan peledak.
Ada satu, dua, tiga atom fenol tergantung pada jumlah gugus OH dalam molekul (Gbr. 1)
Beras. satu. FENOL TUNGGAL, DUA DAN TRI-ATOM
Sesuai dengan jumlah siklus aromatik yang menyatu dalam molekul, ada (Gbr. 2) fenol itu sendiri (satu cincin aromatik - turunan benzena), naftol (2 cincin menyatu - turunan naftalena), antranol (3 cincin menyatu - turunan antrasena) dan fenantrol (Gbr. 2).
Beras. 2. FENOLA MONO- DAN POLINUKLIR
Nomenklatur alkohol.
Untuk fenol, nama-nama sepele yang telah berkembang secara historis banyak digunakan. Awalan juga digunakan dalam nama fenol mononuklear tersubstitusi orto-,meta- Dan pasangan -, digunakan dalam penamaan senyawa aromatik. Untuk senyawa yang lebih kompleks, atom yang merupakan bagian dari siklus aromatik diberi nomor dan posisi substituen ditunjukkan dengan menggunakan indeks digital (Gbr. 3).
Beras. 3. NOMENKLATUR FENOL. Kelompok substituen dan indeks numerik yang sesuai disorot dalam warna yang berbeda untuk kejelasan.
Sifat kimia fenol.
Inti benzena dan gugus OH yang digabungkan dalam molekul fenol saling mempengaruhi, secara signifikan meningkatkan reaktivitas satu sama lain. Gugus fenil menarik pasangan elektron bebas dari atom oksigen pada gugus OH (Gbr. 4). Akibatnya, muatan positif parsial pada atom H dari kelompok ini meningkat (ditunjukkan oleh d+), polaritas ikatan O–H meningkat, yang memanifestasikan dirinya dalam peningkatan sifat asam dari kelompok ini. Jadi, dibandingkan dengan alkohol, fenol adalah asam yang lebih kuat. Muatan negatif parsial (dilambangkan dengan d–), diteruskan ke gugus fenil, terkonsentrasi di posisi orto- Dan pasangan-(berkenaan dengan gugus OH). Tempat reaksi ini dapat diserang oleh reagen yang cenderung ke pusat elektronegatif, yang disebut reagen elektrofilik ("pecinta elektron").
Beras. 4. DISTRIBUSI KEPADATAN ELEKTRON DALAM FENOL
Akibatnya, dua jenis transformasi yang mungkin untuk fenol: substitusi atom hidrogen pada gugus OH dan substitusi inti H-atomobenzene. Sepasang elektron atom O, yang ditarik ke cincin benzena, meningkatkan kekuatan ikatan C–O, sehingga reaksi yang terjadi dengan pemutusan ikatan ini, yang merupakan karakteristik alkohol, tidak khas untuk fenol.
1. Reaksi substitusi atom hidrogen pada gugus OH. Ketika fenol diperlakukan dengan alkali, fenolat terbentuk (Gbr. 5A), reaksi katalitik dengan alkohol menghasilkan eter (Gbr. 5B), dan sebagai hasil reaksi dengan anhidrida atau klorida asam dari asam karboksilat, ester terbentuk ( Gambar 5C). Saat berinteraksi dengan amonia (peningkatan suhu dan tekanan), gugus OH digantikan oleh NH 2, terbentuk anilin (Gbr. 5D), reagen pereduksi mengubah fenol menjadi benzena (Gbr. 5E)
2. Reaksi substitusi atom hidrogen pada cincin benzena.
Selama halogenasi, nitrasi, sulfonasi dan alkilasi fenol, pusat-pusat dengan kerapatan elektron yang meningkat diserang (Gbr. 4), yaitu. substitusi terjadi terutama di orto- Dan pasangan- posisi (gbr.6).
Dengan reaksi yang lebih dalam, dua dan tiga atom hidrogen diganti dalam cincin benzena.
Yang paling penting adalah reaksi kondensasi fenol dengan aldehida dan keton, pada dasarnya, ini adalah alkilasi, yang berlangsung dengan mudah dan dalam kondisi ringan (pada 40-50 ° C, media berair dengan adanya katalis), sedangkan karbon atom berupa gugus metilen CH2 atau gugus metilen tersubstitusi (CHR atau CR2) disisipkan di antara dua molekul fenol. Kondensasi seperti itu sering mengarah pada pembentukan produk polimer (Gbr. 7).
Dihydric phenol (nama dagang bisphenol A, Gbr. 7) digunakan sebagai komponen dalam produksi resin epoksi. Kondensasi fenol dengan formaldehida mendasari produksi resin fenol-formaldehida yang banyak digunakan (plastik fenolik).
Metode untuk mendapatkan fenol.
Fenol diisolasi dari tar batubara, serta dari produk pirolisis batubara coklat dan kayu (tar). Metode industri untuk memperoleh C6H5OH fenol itu sendiri didasarkan pada oksidasi kumena hidrokarbon aromatik (isopropilbenzena) dengan oksigen atmosfer, diikuti dengan dekomposisi hidroperoksida yang dihasilkan yang diencerkan dengan H2SO4 (Gbr. 8A). Reaksi berlangsung dengan hasil tinggi dan menarik karena memungkinkan seseorang memperoleh dua produk yang bernilai teknis sekaligus - fenol dan aseton. Metode lain adalah hidrolisis katalitik dari benzena terhalogenasi (Gbr. 8B).
Beras. 8. METODE UNTUK MEMPEROLEH FENOL
Penggunaan fenol.
Larutan fenol digunakan sebagai desinfektan (asam karbol). Fenol diatomik - pirokatekol, resorsinol (Gbr. 3), serta hidrokuinon ( pasangan- dihydroxybenzene) digunakan sebagai antiseptik (disinfektan antibakteri), dimasukkan ke dalam zat penyamak kulit dan bulu, sebagai penstabil untuk minyak pelumas dan karet, serta untuk memproses bahan fotografi dan sebagai reagen dalam kimia analitik.
Dalam bentuk senyawa individu, fenol digunakan sampai batas tertentu, tetapi berbagai turunannya banyak digunakan. Fenol berfungsi sebagai senyawa awal untuk memperoleh berbagai produk polimer - resin fenol-aldehida (Gbr. 7), poliamida, poliepoksida. Berdasarkan fenol, banyak obat diperoleh, misalnya aspirin, salol, fenolftalein, selain itu, pewarna, parfum, plasticizer untuk polimer dan produk perlindungan tanaman.
Mikhail Levitsky

a) Asetilen dapat diperoleh dari metana jika dipanaskan:
Dengan adanya katalis, asetilena diubah menjadi benzena (reaksi trimerisasi):

Fenol dapat diperoleh dari benzena dalam dua langkah. Benzena bereaksi dengan klorin dengan adanya besi klorida membentuk klorobenzena:

Di bawah aksi alkali pada klorobenzena pada suhu tinggi, atom klorin digantikan oleh gugus hidroksil dan fenol diperoleh:

Di bawah aksi bromin pada fenol, 2,4,6-tribromofenol terbentuk:

b) Etana dapat diperoleh dari metana di dua stasiun. Ketika metana diklorinasi, klorometana terbentuk. Ketika metana diklorinasi dengan adanya cahaya, klorometana terbentuk:
Ketika klorometana bereaksi dengan natrium, etana terbentuk (reaksi Wurtz):
Propana juga dapat dibuat dari etana dalam dua tahap. Ketika etana diklorinasi, kloroetan terbentuk:
Ketika kloroetan bereaksi dengan klorometana dengan adanya natrium, propana terbentuk:
Propana dapat diubah menjadi heksana dalam dua langkah. Ketika propana diklorinasi, campuran isomer terbentuk - 1-kloropropana dan 2-kloropropana. Isomer memiliki titik didih yang berbeda dan dapat dipisahkan dengan distilasi.
Ketika 1-kloropropana bereaksi dengan natrium, heksana terbentuk:
Ketika heksana didehidrogenasi melalui katalis, benzena terbentuk:

Dari benzena, asam pikrat (2,4,6-trinitrofenol) dapat diperoleh dalam tiga tahap. Ketika benzena bereaksi dengan klorin dengan adanya besi klorida, klorobenzena terbentuk.
Fenol - zat organik yang molekulnya mengandung radikal fenil yang berasosiasi dengan satu atau lebih gugus hidrokso. Sama seperti alkohol klasifikasi fenol dengan atomisitas, yaitu dengan jumlah gugus hidroksil.
Fenol monoatomik mengandung satu gugus hidroksil dalam molekul:

Fenol polihidrat mengandung lebih dari satu gugus hidroksil dalam molekul:

Ada juga fenol polihidrat yang mengandung tiga atau lebih gugus hidroksil dalam cincin benzena.
Mari berkenalan lebih detail dengan struktur dan sifat perwakilan paling sederhana dari kelas ini - fenol C 6 H 5 OH. Nama zat ini menjadi dasar untuk nama seluruh mesin kasir - fenol.
Sifat fisik fenol
Fenol adalah zat kristal padat, tidak berwarna, titik leleh = 43 ° C, titik didih = 181 ° C, dengan bau khas yang tajam. Beracun. Fenol sedikit larut dalam air pada suhu kamar. Larutan fenol dalam air disebut asam karbol. Pada kontak dengan kulit, itu menyebabkan terbakar, oleh karena itu, fenol harus ditangani dengan sangat hati-hati!
Sifat kimia fenol
 Fenol lebih aktif dalam sebagian besar reaksi ikatan O-H, karena ikatan ini lebih polar karena pergeseran kerapatan elektron dari atom oksigen menuju cincin benzena (partisipasi pasangan elektron bebas atom oksigen dalam konjugasi-p). sistem). Keasaman fenol jauh lebih tinggi daripada alkohol. Untuk fenol, reaksi pemutusan ikatan C-O tidak khas, karena atom oksigen terikat kuat pada atom karbon cincin benzena karena partisipasi pasangan elektron bebasnya dalam sistem konjugasi. Pengaruh timbal balik atom dalam molekul fenol dimanifestasikan tidak hanya dalam perilaku gugus hidroksi, tetapi juga dalam reaktivitas cincin benzena yang lebih besar. Gugus hidroksil meningkatkan kerapatan elektron pada cincin benzena, terutama pada posisi orto dan para (gugus OH).
Fenol lebih aktif dalam sebagian besar reaksi ikatan O-H, karena ikatan ini lebih polar karena pergeseran kerapatan elektron dari atom oksigen menuju cincin benzena (partisipasi pasangan elektron bebas atom oksigen dalam konjugasi-p). sistem). Keasaman fenol jauh lebih tinggi daripada alkohol. Untuk fenol, reaksi pemutusan ikatan C-O tidak khas, karena atom oksigen terikat kuat pada atom karbon cincin benzena karena partisipasi pasangan elektron bebasnya dalam sistem konjugasi. Pengaruh timbal balik atom dalam molekul fenol dimanifestasikan tidak hanya dalam perilaku gugus hidroksi, tetapi juga dalam reaktivitas cincin benzena yang lebih besar. Gugus hidroksil meningkatkan kerapatan elektron pada cincin benzena, terutama pada posisi orto dan para (gugus OH).
Sifat asam fenol
Atom hidrogen dari gugus hidroksil bersifat asam. Karena Karena sifat asam fenol lebih menonjol daripada air dan alkohol, maka fenol bereaksi tidak hanya dengan logam alkali, tetapi juga dengan alkali untuk membentuk fenolat:

Keasaman fenol tergantung pada sifat substituen (donor atau akseptor kerapatan elektron), posisi relatif terhadap gugus OH, dan jumlah substituen. Pengaruh terbesar pada OH-keasaman fenol diberikan oleh gugus yang terletak di posisi orto dan para. Donor meningkatkan kekuatan ikatan O-H (sehingga mengurangi mobilitas hidrogen dan sifat asam), akseptor mengurangi kekuatan ikatan O-H, sementara keasaman meningkat:

Namun, sifat asam fenol kurang menonjol dibandingkan dengan asam anorganik dan asam karboksilat. Jadi, misalnya, sifat asam fenol sekitar 3000 kali lebih kecil daripada asam karbonat. Oleh karena itu, dengan melewatkan karbon dioksida melalui larutan natrium fenolat berair, fenol bebas dapat diisolasi.

Menambahkan asam klorida atau asam sulfat ke larutan natrium fenolat berair juga mengarah pada pembentukan fenol:

Reaksi kualitatif terhadap fenol
Fenol bereaksi dengan besi (3) klorida untuk membentuk senyawa kompleks yang sangat ungu. Reaksi ini memungkinkan untuk dideteksi bahkan dalam jumlah yang sangat terbatas. Fenol lain yang mengandung satu atau lebih gugus hidroksil pada cincin benzena juga memberikan warna biru-ungu cerah pada reaksi dengan besi (3) klorida.
Reaksi cincin benzena dari fenol
Kehadiran substituen hidroksil sangat memudahkan jalannya reaksi substitusi elektrofilik pada cincin benzena.
- Brominasi fenol. Tidak seperti benzena, brominasi fenol tidak memerlukan penambahan katalis (besi(3) bromida). Selain itu, interaksi dengan fenol berlangsung secara selektif (selektif): atom bromin dikirim ke orto- Dan pasangan- posisi, menggantikan atom hidrogen yang terletak di sana. Selektivitas substitusi dijelaskan oleh fitur struktur elektronik dari molekul fenol yang dibahas di atas.
Jadi, ketika fenol berinteraksi dengan air brom, terbentuk endapan putih 2,4,6-tribromofenol:

Reaksi ini, serta reaksi dengan besi (3) klorida, berfungsi untuk deteksi kualitatif fenol.
2.Nitrasi fenol juga terjadi lebih mudah daripada nitrasi benzena. Reaksi dengan asam nitrat encer berlangsung pada suhu kamar. Hasilnya adalah campuran orto- Dan paro isomer nitrofenol:

Saat menggunakan asam nitrat pekat, 2,4,6, asam trinitritfenol-pikrat, bahan peledak terbentuk:

3. Hidrogenasi cincin aromatik fenol di hadapan katalis lewat dengan mudah:

4.Polikondensasi fenol dengan aldehida, khususnya, dengan formaldehida terjadi dengan pembentukan produk reaksi - resin fenol-formaldehida dan polimer padat.
Interaksi fenol dengan formaldehida dapat digambarkan dengan skema:

Molekul dimer mempertahankan atom hidrogen "mobile", yang berarti bahwa reaksi dapat dilanjutkan lebih lanjut dengan jumlah reagen yang cukup:

Reaksi polikondensasi, itu. reaksi produksi polimer, dilanjutkan dengan pelepasan produk samping molekul rendah (air), dapat berlanjut lebih lanjut (sampai salah satu reagen benar-benar dikonsumsi) dengan pembentukan makromolekul besar. Proses tersebut dapat digambarkan dengan persamaan keseluruhan:

Pembentukan molekul linier terjadi pada suhu biasa. Melakukan reaksi yang sama selama pemanasan mengarah pada fakta bahwa produk yang dihasilkan memiliki struktur bercabang, padat dan tidak larut dalam air.Sebagai hasil dari pemanasan resin fenol-formaldehida linier dengan kelebihan aldehida, massa plastik padat dengan unik properti diperoleh. Polimer berdasarkan resin fenol-formaldehida digunakan untuk pembuatan pernis dan cat, produk plastik yang tahan terhadap pemanasan, pendinginan, air, alkali, asam, memiliki sifat dielektrik yang tinggi. Polimer berdasarkan resin fenol-formaldehida digunakan untuk membuat bagian paling penting dan penting dari peralatan listrik, kotak unit daya dan bagian mesin, dasar polimer papan sirkuit tercetak untuk perangkat radio. Perekat berdasarkan resin fenol-formaldehida mampu menghubungkan bagian-bagian dari berbagai alam dengan andal, mempertahankan kekuatan ikatan tertinggi dalam rentang suhu yang sangat luas. Perekat semacam itu digunakan untuk merekatkan dasar logam dari lampu penerangan ke bohlam kaca, sehingga fenol dan produk berdasarkan itu banyak digunakan.
Penggunaan fenol
Fenol adalah zat padat dengan bau khas yang menyebabkan luka bakar ketika bersentuhan dengan kulit. Beracun. Ini larut dalam air, larutannya disebut asam karbol (antiseptik). Dia adalah antiseptik pertama yang diperkenalkan ke dalam operasi. Ini banyak digunakan untuk produksi plastik, obat-obatan (asam salisilat dan turunannya), pewarna, bahan peledak.