Mendapatkan fenol. Struktur, sifat dan aplikasi fenol. Memperoleh fenol: metode utama Fenol digunakan sebagai bahan baku untuk memperoleh
Bagaimana untuk mendapatkan/>.
1 . Memperoleh dari halobenzena. Ketika klorobenzena dan natrium hidroksida dipanaskan di bawah tekanan, natrium fenolat diperoleh, setelah perlakuan lebih lanjut yang dengan asam, fenol terbentuk:
C 6 H 5 - DENGAN l + 2 NaOH → C 6 H 5 - ONa + NaCl + H 2 O.
2. Selama oksidasi katalitik isopropilbenzena (kumena) dengan oksigen atmosfer, fenol dan aseton terbentuk:
(1)
Ini adalah metode industri utama untuk memproduksi fenol.
3. Diperoleh dari asam sulfonat aromatik. Reaksi dilakukan dengan menggabungkan asam sulfonat dengan basa. Awalnya fenoksida yang terbentuk diperlakukan dengan asam kuat untuk mendapatkan fenol bebas. Metode ini biasanya digunakan untuk mendapatkan fenol polihidrat:

Sifat kimia/>. Dalam fenol p - orbital atom oksigen membentuk satu unit dengan cincin aromatik P -sistem. Karena interaksi ini, kerapatan elektron pada atom oksigen berkurang, dan pada cincin benzena meningkat. Polaritas ikatan O-H meningkat, dan hidrogen dari gugus OH menjadi lebih reaktif dan mudah digantikan oleh logam bahkan di bawah pengaruh alkali (tidak seperti alkohol monohidrat jenuh).
1. Keasaman fenol secara signifikan lebih tinggi daripada alkohol jenuh; itu bereaksi baik dengan logam alkali:
C 6 H 5 OH + Na → C 6 H 5 ONa + 1/2 H 2,
dan dengan hidroksidanya (maka nama lama "asam karbol"):
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
Fenol, bagaimanapun, adalah asam yang sangat lemah. Ketika melewatkan karbon dioksida atau sulfur dioksida melalui larutan fenolat, fenol dilepaskan; reaksi seperti itu membuktikan bahwa fenol adalah asam yang lebih lemah daripada karbonat dan belerang:
C 6 H 5 ONa + CO 2 + H 2 O → C 6 H 5 OH + NaHC03.
Sifat asam fenol dilemahkan oleh pengenalan substituen ke dalam cincin Saya jenis dan ditingkatkan dengan pengenalan substituen jenis II.
2. Pembentukan ester. Tidak seperti alkohol, fenol tidak membentuk ester ketika terkena asam karboksilat; asam klorida digunakan untuk ini:
C 6 H 5 OH + CH 3 - CO - Cl → C 6 H 5 - O - CO - CH 3 + HCl.
3. Reaksi substitusi elektrofilik dalam fenol berlangsung jauh lebih mudah daripada di hidrokarbon aromatik. Karena gugus OH adalah orientasi tipe I, reaktivitas cincin benzena pada posisi orto dan para dalam molekul fenol meningkat (selama halogenasi, nitrasi, polikondensasi, dll.). Jadi, di bawah aksi air brom pada fenol, tiga atom hidrogen digantikan oleh brom, dan endapan 2,4,6-tribromofenol terbentuk:
 (2)
(2)
Ini adalah reaksi kualitatif terhadap fenol.
Ketika fenol dinitrasi dengan asam nitrat pekat, tiga atom hidrogen digantikan oleh gugus nitro, dan 2,4,6-trinitrofenol (asam pikrat) terbentuk:

Ketika fenol dipanaskan dengan formaldehida dengan adanya katalis asam atau basa, reaksi polikondensasi terjadi, dan resin fenol-formaldehida terbentuk - senyawa molekul tinggi dengan struktur bercabang dari jenis:

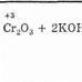
4. Oksidasi. Fenol mudah teroksidasi bahkan di bawah aksi oksigen atmosfer. Jadi, ketika berdiri di udara, fenol secara bertahap berubah menjadi warna merah muda-merah muda. Dalam oksidasi kuat fenol dengan campuran kromium, kuinon adalah produk oksidasi utama. Fenol dihidrat lebih mudah teroksidasi. Ketika hidrokuinon dioksidasi, kuinon juga terbentuk:
 (3)
(3)
Sebagai kesimpulan, kami mencatat bahwa fenol sering diidentifikasi dengan reaksinya dengan larutan FeCl3 ; dalam hal ini, ion kompleks ungu terbentuk. Seiring dengan reaksi (2), ini adalah reaksi kualitatif untuk mendeteksi fenol.
aplikasi. Fenol digunakan sebagai perantara dalam produksi resin fenol-formaldehida, serat sintetis, pewarna, obat-obatan, dan banyak zat berharga lainnya. Asam pikrat digunakan dalam industri sebagai bahan peledak. Cresol digunakan sebagai zat dengan efek desinfektan yang kuat./>
Fenol adalah zat kristal tidak berwarna dengan bau yang sangat spesifik. Zat ini banyak digunakan dalam produksi berbagai pewarna, plastik, berbagai serat sintetis (terutama nilon). Sebelum pengembangan industri petrokimia, produksi fenol dilakukan secara eksklusif dari tar batubara. Tentu saja cara ini tidak mampu menutupi semua kebutuhan industri yang berkembang pesat akan fenol, yang kini telah menjadi komponen penting hampir semua benda di sekitar kita.
Fenol, yang produksinya telah menjadi kebutuhan mendesak karena munculnya bahan dan zat baru yang sangat luas, yang merupakan bahan integral, digunakan dalam proses sintesis. komponen fenolat. Juga, sejumlah besar fenol diproses menjadi sikloheksanol, yang diperlukan untuk pembuatan pada skala industri.

Area penting lainnya adalah produksi campuran kreosol, yang disintesis menjadi resin formaldehida kreosol yang digunakan untuk membuat banyak obat, antiseptik, dan antioksidan. Oleh karena itu, saat ini produksi fenol dalam jumlah besar merupakan tugas penting petrokimia. Banyak metode telah dikembangkan untuk menghasilkan zat ini dalam volume yang cukup. Mari kita membahas yang utama.
Metode tertua dan paling terbukti adalah metode peleburan basa, yang ditandai dengan konsumsi besar asam sulfat dan kaustik, diikuti oleh peleburannya menjadi garam benzenasulfonatrium, dari mana zat ini dipisahkan secara langsung. Memperoleh fenol dengan metode klorinasi benzena diikuti dengan saponifikasi klorobenzena hanya menguntungkan jika ada sejumlah besar listrik murah yang dibutuhkan untuk produksi kaustik dan klorin. Kerugian utama dari teknik ini adalah kebutuhan untuk menciptakan tekanan tinggi (setidaknya tiga ratus atmosfer) dan tingkat korosi peralatan yang sangat signifikan.

Metode yang lebih modern adalah memperoleh fenol dengan dekomposisi isopropilbenzena hidroperoksida. Benar, skema untuk mengisolasi zat yang diperlukan di sini agak rumit, karena melibatkan produksi awal hidroperoksida dengan metode alkilasi benzena dengan larutan propilena. Selanjutnya, teknologi menyediakan oksidasi isopropilbenzena yang dihasilkan dengan campuran udara untuk membentuk hidroperoksida. Sebagai faktor positif dari teknik ini, seseorang dapat mencatat produksi zat penting lainnya, aseton, secara paralel dengan fenol.
Ada juga metode untuk mengisolasi fenol dari kokas dan tar semi-kokas dari bahan bakar padat. Prosedur seperti itu diperlukan tidak hanya untuk mendapatkan fenol yang berharga, tetapi juga untuk meningkatkan kualitas berbagai produk hidrokarbon. Salah satu sifat fenol adalah oksidasi cepat, yang menyebabkan percepatan penuaan minyak dan pembentukan fraksi resin kental di dalamnya.
Tetapi metode paling modern dan pencapaian terbaru dari industri petrokimia adalah memperoleh fenol dari benzena secara langsung dengan mengoksidasinya.Seluruh proses dilakukan dalam reaktor adiabatik khusus, yang berisi katalis yang mengandung zeolit. Nitro oksida asli diperoleh dengan mengoksidasi amonia dengan udara atau dengan memisahkannya dari, lebih tepatnya, dari produk sampingannya yang terbentuk selama sintesis. Teknologi ini mampu menghasilkan fenol dengan kemurnian tinggi dengan kandungan total pengotor yang minimal.
Deskripsi presentasi pada slide individu:
1 slide
Deskripsi slide:
2 slide
Deskripsi slide:
Tujuan: Mengkarakterisasi sifat fisik dan kimia fenol Menunjukkan peran negatif dan positif fenol dan turunannya dalam alam dan kehidupan manusia
3 slide
Deskripsi slide:
Fenol (oksibenzena, asam karbol usang) C6H5OH adalah perwakilan paling sederhana dari kelas fenol. Kristalin, zat tidak berwarna dengan bau yang khas. Ini mudah teroksidasi di udara, menjadi merah muda pertama, lalu coklat. Kristal jarum fenol
4 slide
Deskripsi slide:
Klasifikasi fenol Ada satu, dua, tiga atom fenol tergantung pada jumlah gugus OH dalam molekul:
5 slide
Deskripsi slide:
Metode persiapan Cumene untuk produksi fenol (USSR, Sergeev P.G., Udris R.Yu., Kruzhalov B.D., 1949). Keuntungan dari metode: teknologi non-limbah (hasil produk yang berguna> 99%) dan ekonomi. Fusi garam asam sulfonat aromatik dengan alkali padat: C6H5-SO3Na + NaOH t → Na2SO3 + C6H5 - OH Dari tar batubara: C6H5ONa + H2SO4 (diff) → C6H5 - OH + NaHSO4 OH+NaCl
6 slide
Deskripsi slide:
Sifat fisik Larut dalam air (6 g per 100 g air), dalam larutan alkali, dalam alkohol, dalam benzena, dalam aseton. Fenol sangat beracun dan berbahaya bagi tubuh manusia.
7 slide
Deskripsi slide:
Struktur elektronik Gugus hidroksil -OH adalah substituen dari jenis pertama, yang berkontribusi pada peningkatan kerapatan elektron pada cincin benzena (terutama pada posisi orto dan para). Hal ini disebabkan oleh fakta bahwa salah satu pasangan elektron bebas dari atom oksigen dari gugus OH memasuki konjugasi dengan sistem dari cincin benzena. Perpindahan pasangan elektron bebas atom oksigen ke arah cincin benzena menyebabkan peningkatan polaritas ikatan O-H.
8 slide
Deskripsi slide:
Sifat kimia Interaksi dengan logam natrium: 2C6H5OH + 2Na 2C6H5ONa + H2 Memiliki sifat asam lemah, membentuk garam - fenolat di bawah aksi alkali (misalnya, natrium fenolat - C6H5ONa): C6H5OH + NaOH C6H5ONa + H2O Interaksi dengan air bromin (reaksi kualitatif menjadi fenol) : C6H5OH + 3Br2 C6H2Br3OH + 3HBr (membentuk padatan putih 2,4,6-tribromofenol) Reaksi dengan asam nitrat pekat: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (membentuk 2,4,6-trinitrofenol) Reaksi dengan klorida besi(III) (reaksi kualitatif untuk fenol): 6C6H5OH + FeCl3 Cl3
9 slide
Deskripsi slide:
Peran biologis Minyak atsiri (memiliki sifat bakterisida dan antivirus yang kuat, merangsang sistem kekebalan tubuh, meningkatkan tekanan darah: - anethole dalam adas, adas, adas manis - carvacrol dan timol dalam thyme - eugenol dalam cengkeh, kemangi Flavonoid (membantu menghilangkan unsur radioaktif dari tubuh) ) Sediaan obat (pembersih, parasetamol) Antiseptik (larutan 3-5% - asam karbol) Fenol adalah salah satu polutan industri Fenol cukup beracun bagi hewan dan manusia Fenol berbahaya bagi banyak mikroorganisme, oleh karena itu air limbah industri dengan kandungan fenol tinggi sulit untuk diobati secara biologis.
10 slide
Deskripsi slide:
Sifat toksik Mengacu pada zat yang sangat berbahaya (kelas bahaya II). Ketika terhirup, itu menyebabkan kerusakan pada fungsi sistem saraf. Debu, uap dan larutan fenol mengiritasi selaput lendir mata, saluran pernapasan, kulit, menyebabkan luka bakar kimia. Di kulit, fenol sangat cepat diserap bahkan melalui area yang utuh dan setelah beberapa menit mulai mempengaruhi jaringan otak.
11 slide
Deskripsi slide:
Sifat toksik Pertama, ada eksitasi jangka pendek, dan kemudian kelumpuhan pusat pernapasan. Bahkan ketika terkena dosis minimal fenol, bersin, batuk, sakit kepala, pusing, pucat, mual, dan kehilangan kekuatan diamati. Kasus keracunan yang parah ditandai dengan ketidaksadaran, sianosis, kesulitan bernapas, ketidakpekaan kornea, denyut nadi cepat, nyaris tak terlihat, keringat dingin, sering kejang.
12 slide
Deskripsi slide:
Dampak pada tubuh Ketika larutan fenol mengenai kulit, luka bakar kimia yang parah segera muncul, berubah menjadi bisul. Jika seperempat dari seluruh permukaan tubuh terbakar oleh paparan fenol, maka kemungkinan kematian mendekati 100%. Menelan suatu zat ke dalam tubuh melalui saluran pencernaan berkontribusi pada kesulitan bergerak, dapat memicu perdarahan, maag. Dosis mematikan bagi manusia ketika tertelan adalah 1-10 g, untuk anak-anak 0,05-0,5 g. Meskipun periode eliminasi cepat dari tubuh (hanya sehari), fenol dapat menyebabkan kerusakan yang tidak dapat diperbaiki, dan pengobatan dapat memakan waktu beberapa tahun. Konsekuensi paling serius adalah perkembangan kanker, infertilitas, masalah jantung.
1. Fenol- turunan dari hidrokarbon aromatik, di mana molekul yang gugus hidroksil (-OH) terikat langsung ke atom karbon dalam cincin benzena.
2. Klasifikasi fenol
Ada satu, dua, tiga atom fenol tergantung pada jumlah gugus OH dalam molekul:
Sesuai dengan jumlah siklus aromatik yang menyatu dalam molekul, fenol itu sendiri dibedakan (satu cincin aromatik - turunan benzena), naftol (2 cincin menyatu - turunan naftalena), antranol (3 cincin menyatu - turunan antrasena) dan fenantrol:
3. Isomerisme dan tata nama fenol
Ada 2 jenis isomerisme:
- isomerisme posisi substituen dalam cincin benzena
- isomerisme rantai samping (struktur radikal alkil dan jumlah radikal)
Untuk fenol, nama-nama sepele yang telah berkembang secara historis banyak digunakan. Awalan juga digunakan dalam nama fenol mononuklear tersubstitusi orto-,meta- dan pasangan -, digunakan dalam penamaan senyawa aromatik. Untuk senyawa yang lebih kompleks, atom yang membentuk cincin aromatik diberi nomor dan posisi substituen ditunjukkan dengan menggunakan indeks digital.
4. Struktur molekul
Gugus fenil C 6 H 5 - dan hidroksil -OH saling mempengaruhi satu sama lain
- pasangan elektron tunggal dari atom oksigen tertarik oleh awan 6 elektron dari cincin benzena, yang menyebabkan ikatan O-H bahkan lebih terpolarisasi. Fenol adalah asam yang lebih kuat daripada air dan alkohol.
- Pada cincin benzena, simetri awan elektron terputus, kerapatan elektron meningkat pada posisi 2, 4, 6. Hal ini membuat ikatan C-H pada posisi 2, 4, 6 lebih reaktif, dan ikatan - pada cincin benzena.
5. Sifat fisik
Kebanyakan fenol monoatomik dalam kondisi normal adalah zat kristal tidak berwarna dengan titik leleh rendah dan bau yang khas. Fenol kurang larut dalam air, mudah larut dalam pelarut organik, beracun, dan secara bertahap menjadi gelap ketika disimpan di udara sebagai akibat dari oksidasi.
Fenol C 6 H 5 OH (asam karbol ) - zat kristal tidak berwarna teroksidasi di udara dan menjadi merah muda, pada suhu biasa sedikit larut dalam air, di atas 66 ° C dapat larut dengan air dalam rasio apa pun. Fenol adalah zat beracun, menyebabkan kulit terbakar, bersifat antiseptik.
6. Sifat beracun
Fenol beracun. Menyebabkan disfungsi sistem saraf. Debu, uap dan larutan fenol mengiritasi selaput lendir mata, saluran pernapasan, dan kulit. Begitu masuk ke dalam tubuh, Fenol diserap dengan sangat cepat bahkan melalui area kulit yang utuh dan setelah beberapa menit mulai bekerja pada jaringan otak. Pertama, ada eksitasi jangka pendek, dan kemudian kelumpuhan pusat pernapasan. Bahkan ketika terkena dosis minimal fenol, bersin, batuk, sakit kepala, pusing, pucat, mual, dan kehilangan kekuatan diamati. Kasus keracunan yang parah ditandai dengan ketidaksadaran, sianosis, sesak napas, ketidakpekaan kornea, denyut nadi cepat, nyaris tak terlihat, keringat dingin, sering kejang. Seringkali fenol adalah penyebab kanker.
7. Aplikasi fenol
1. Produksi resin sintetis, plastik, poliamida
2. Obat-obatan
3. Pewarna
4. Surfaktan
5. Antioksidan
6. Antiseptik
7. Bahan Peledak
8. Mendapatkan fenol v industri
satu). Metode Cumene untuk produksi fenol (USSR, Sergeev P.G., Udris R.Yu., Kruzhalov B.D., 1949). Keuntungan dari metode: teknologi non-limbah (hasil produk yang berguna> 99%) dan ekonomi. Saat ini, metode cumene digunakan sebagai metode utama dalam produksi fenol dunia.

2). Dari tar batubara (sebagai produk sampingan - hasil rendah):
C 6 H 5 ONa + H 2 SO 4 (razb) → C 6 H 5 - OH + NaHSO 4
natrium fenolat
(gambar produksepatu bot resinsoda api)
3). Dari halobenzena :
Dari 6 H5 -Cl + NaOH T , P→ C 6 H 5 - OH + NaCl
4). Fusi garam asam sulfonat aromatik dengan alkali padat :
C 6 H 5 -SO 3 Na + NaOH T → Na 2 SO 3 + C 6 H 5 - OH
garam natrium
asam benzenasulfonat
9. Sifat kimia fenol (asam karbol)
Saya . Sifat gugus hidroksil
Sifat asam- lebih jelas daripada alkohol jenuh (warna indikator tidak berubah):
- dengan logam aktif-
2C 6 H 5 -OH + 2Na → 2C 6 H 5 -ONa + H 2
natrium fenolat
- Dengan alkali-
C 6 H 5 -OH + NaOH (larutan air) C 6 H 5 -ONa + H 2 O
! Fenolat - garam dari asam karbol lemah, diuraikan oleh asam karbonat -
C 6 H 5 -ONa + H 2 O +DENGANO 2 → C 6 H 5 -OH + NaHCO 3
Dalam hal sifat asam, fenol 10 kali lebih unggul dari etanol. Pada saat yang sama, itu lebih rendah daripada asam asetat dengan jumlah yang sama. Tidak seperti asam karboksilat, fenol tidak dapat menggantikan asam karbonat dari garamnya.
C 6 H 5 - Oh + NaHCO 3 = reaksi tidak berjalan - karena larut sempurna dalam larutan alkali berair, reaksi ini sebenarnya tidak larut dalam larutan natrium bikarbonat.
Sifat asam fenol ditingkatkan di bawah pengaruh gugus penarik elektron yang terkait dengan cincin benzena ( TIDAK 2 - , br - )
2,4,6-trinitrophenol atau asam pikrat lebih kuat dari karbonat
II . Sifat-sifat cincin benzena
1). Pengaruh timbal balik atom dalam molekul fenol dimanifestasikan tidak hanya dalam perilaku gugus hidroksi (lihat di atas), tetapi juga dalam reaktivitas cincin benzena yang lebih besar. Gugus hidroksil meningkatkan kerapatan elektron pada cincin benzena, terutama pada orto- dan pasangan- ketentuan (+ M-efek gugus OH):
Oleh karena itu, fenol jauh lebih aktif daripada benzena dalam reaksi substitusi elektrofilik pada cincin aromatik.
- Nitrasi. Di bawah aksi 20% asam nitrat HNO 3, fenol mudah diubah menjadi campuran orto- dan pasangan- nitrofenol:
Bila menggunakan HNO3 pekat, terbentuk 2,4,6-trinitrofenol ( asam pikrat):
- halogenasi. Fenol mudah berinteraksi dengan air brom pada suhu kamar untuk membentuk endapan putih 2,4,6-tribromofenol (reaksi kualitatif untuk fenol):
- Kondensasi dengan aldehida. Misalnya:
2). Hidrogenasi fenol
C 6 H 5 -OH + 3H 2 Ni, 170ºC→ C 6 H 11 - OH sikloheksil alkohol (sikloheksanol)
Berdasarkan benzena. Dalam kondisi normal, mereka adalah zat beracun padat dengan aroma tertentu. Dalam industri modern, senyawa kimia ini memegang peranan penting. Dalam hal penggunaan, fenol dan turunannya termasuk di antara dua puluh senyawa kimia yang paling banyak diminati di dunia. Mereka banyak digunakan dalam industri kimia dan ringan, farmasi dan energi. Oleh karena itu, produksi fenol dalam skala industri merupakan salah satu tugas utama industri kimia.
Sebutan fenol
Nama asli fenol adalah asam karbol. Kemudian, senyawa ini belajar nama "fenol". Rumus zat ini ditunjukkan pada gambar:
Atom-atom fenol diberi nomor mulai dari atom karbon yang berikatan dengan gugus OH-hidroksida. Urutan berlanjut sedemikian rupa sehingga atom tersubstitusi lainnya menerima nomor terendah. Turunan fenol ada sebagai tiga elemen yang karakteristiknya dijelaskan oleh perbedaan isomer strukturalnya. Berbagai orto-, meta-, parakresol hanya merupakan modifikasi dari struktur dasar senyawa cincin benzena dan gugus hidroksil yang kombinasi dasarnya adalah fenol. Rumus zat ini dalam notasi kimia terlihat seperti C 6 H 5 OH.
Sifat fisik fenol
Secara visual, fenol merupakan kristal padat tidak berwarna. Di udara terbuka, mereka teroksidasi, memberi zat warna merah muda yang khas. Dalam kondisi normal, fenol agak kurang larut dalam air, tetapi dengan peningkatan suhu hingga 70 ° C, angka ini meningkat tajam. Dalam larutan basa, zat ini larut dalam jumlah berapa pun dan pada suhu berapa pun.

Sifat-sifat ini juga diawetkan dalam senyawa lain, yang komponen utamanya adalah fenol.
Sifat kimia
Sifat unik fenol dijelaskan oleh struktur internalnya. Dalam molekul bahan kimia ini, orbital p oksigen membentuk sistem p tunggal dengan cincin benzena. Interaksi yang erat ini meningkatkan kerapatan elektron cincin aromatik dan menurunkan kerapatan atom oksigen. Dalam hal ini, polaritas ikatan gugus hidrokso meningkat secara signifikan, dan hidrogen dalam komposisinya mudah digantikan oleh logam alkali apa pun. Ini adalah bagaimana berbagai fenolat terbentuk. Senyawa ini tidak terurai dengan air, seperti alkoholat, tetapi larutannya sangat mirip dengan garam dari basa kuat dan asam lemah, sehingga mereka memiliki reaksi basa yang cukup jelas. Fenolat berinteraksi dengan berbagai asam, sebagai akibat dari reaksi, fenol tereduksi. Sifat kimia senyawa ini memungkinkan untuk berinteraksi dengan asam, sehingga membentuk ester. Misalnya, interaksi fenol dan asam asetat mengarah pada pembentukan fenil ester (fenyasetat).

Reaksi nitrasi dikenal luas, di mana, di bawah pengaruh asam nitrat 20%, fenol membentuk campuran para- dan orthonitrophenols. Jika fenol diperlakukan dengan asam nitrat pekat, diperoleh 2,4,6-trinitrofenol, yang kadang-kadang disebut asam pikrat.

Fenol di alam
Sebagai zat independen, fenol ditemukan di alam dalam tar batubara dan dalam kadar minyak tertentu. Namun untuk kebutuhan industri, jumlah tersebut tidak berperan apa-apa. Oleh karena itu, memperoleh fenol secara artifisial telah menjadi prioritas bagi banyak generasi ilmuwan. Untungnya, masalah ini diselesaikan dan fenol buatan diperoleh sebagai hasilnya.
properti, mendapatkan
Penggunaan berbagai halogen memungkinkan untuk memperoleh fenolat, dari mana benzena terbentuk selama pemrosesan lebih lanjut. Misalnya, pemanasan natrium hidroksida dan klorobenzena menghasilkan natrium fenolat, yang terurai menjadi garam, air, dan fenol bila terkena asam. Rumus untuk reaksi ini diberikan di sini:
C 6 H 5 -CI + 2NaOH -> C 6 H 5 -ONa + NaCl + H 2 O
Asam sulfonat aromatik juga merupakan sumber untuk produksi benzena. Reaksi kimia dilakukan dengan pelelehan alkali dan asam sulfonat secara simultan. Seperti yang dapat dilihat dari reaksi, fenoksida terbentuk terlebih dahulu. Ketika diperlakukan dengan asam kuat, mereka direduksi menjadi fenol polihidrat.
Fenol dalam industri
Secara teori, memperoleh fenol dengan cara yang paling sederhana dan paling menjanjikan terlihat seperti ini: menggunakan katalis, benzena dioksidasi dengan oksigen. Namun sejauh ini, katalis untuk reaksi ini belum ditemukan. Oleh karena itu, metode lain saat ini digunakan dalam industri.
Metode industri berkelanjutan untuk memproduksi fenol terdiri dari interaksi klorobenzena dan larutan natrium hidroksida 7%. Campuran yang dihasilkan dilewatkan melalui sistem pipa sepanjang satu setengah kilometer yang dipanaskan hingga suhu 300 C. Di bawah pengaruh suhu dan tekanan tinggi yang dipertahankan, bahan awal bereaksi untuk memperoleh 2,4-dinitrofenol dan produk lainnya.

Belum lama ini, metode industri untuk memperoleh zat yang mengandung fenol dengan metode cumene dikembangkan. Proses ini terdiri dari dua tahap. Pertama, isopropilbenzena (kumena) diperoleh dari benzena. Untuk melakukan ini, benzena dialkilasi dengan propilena. Reaksinya terlihat seperti ini:

Setelah itu, cumene dioksidasi dengan oksigen. Keluaran dari reaksi kedua adalah fenol dan produk penting lainnya, aseton.
Produksi fenol pada skala industri dimungkinkan dari toluena. Untuk melakukan ini, toluena dioksidasi pada oksigen yang terkandung di udara. Reaksi berlangsung dengan adanya katalis.
Contoh fenol
Homolog terdekat dari fenol disebut kresol.

Ada tiga jenis kresol. Meta-kresol dalam kondisi normal adalah cairan, para-kresol dan orto-kresol adalah padatan. Semua kresol kurang larut dalam air, dan sifat kimianya hampir mirip dengan fenol. Kresol secara alami ditemukan dalam tar batubara, digunakan dalam industri dalam produksi pewarna dan beberapa jenis plastik.
Contoh fenol dihidrat adalah para-, orto- dan meta-hidrobenzena. Semuanya padat, mudah larut dalam air.
Satu-satunya perwakilan dari trihydric phenol adalah pyrogallol (1,2,3-trihydroxybenzene). Formulanya ditunjukkan di bawah ini.

Pyrogallol adalah agen pereduksi yang cukup kuat. Ini mudah teroksidasi, sehingga digunakan untuk mendapatkan gas yang dimurnikan dari oksigen. Zat ini dikenal oleh fotografer, digunakan sebagai pengembang.