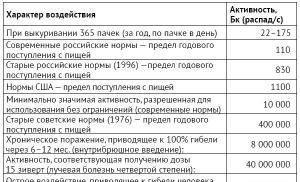
Indeks vodonika sredine rastvora je pH. Kiselost okoline. Koncept pH otopine Jednačine koje se odnose na pH i pOH
pH vrijednost, pH(lat. strondus hydrogenii- "težina vodonika", izgovara se "peh") je mjera aktivnosti (u visoko razrijeđenim otopinama ekvivalentna koncentraciji) vodikovih jona u otopini, koja kvantitativno izražava njegovu kiselost. Jednaka po veličini i suprotnog predznaka od decimalnog logaritma aktivnosti vodikovih jona, koja se izražava u molovima po litru:
Istorija pH vrednosti.
Koncept pH vrijednost uveo danski hemičar Sørensen 1909. Indikator se poziva pH (prema prvim slovima latinskih reči potentia hydrogeni- jačina vodonika, ili pondus hydrogeni- težina vodonika). U hemiji kombinacijom pX obično označavaju količinu koja je jednaka log X, i pismo H u ovom slučaju označimo koncentraciju vodikovih jona ( H+), odnosno termodinamička aktivnost hidronij jona.
Jednačine koje se odnose na pH i pOH.
Prikaz pH vrijednosti.
U čistoj vodi na 25 °C koncentracija vodikovih jona ([ H+]) i hidroksid ioni ([ OH− ]) identični i jednaki 10 −7 mol/l, to jasno proizilazi iz definicije ionskog proizvoda vode, jednakog [ H+] · [ OH− ] i iznosi 10 −14 mol²/l² (na 25 °C).
Ako su koncentracije dvije vrste jona u otopini iste, onda se kaže da otopina ima neutralnu reakciju. Kada se u vodu doda kiselina, koncentracija vodikovih iona se povećava, a koncentracija hidroksidnih iona smanjuje; kada se doda baza, naprotiv, sadržaj hidroksidnih iona se povećava, a koncentracija vodikovih iona opada. Kada [ H+] > [OH− ] kaže se da se rastvor ispostavi kiselim, a kada [ OH − ] > [H+] - alkalna.
Da bi bilo zgodnije zamisliti, da biste se riješili negativnog eksponenta, umjesto koncentracija vodikovih jona, koristite njihov decimalni logaritam koji se uzima sa suprotnim predznakom, a to je eksponent vodika - pH.
Pokazatelj bazičnosti otopine pOH.
Obrnuto je nešto manje popularno pH vrijednost - indeks osnovnosti rješenja, pOH, što je jednako decimalnom logaritmu (negativno) koncentracije jona u otopini OH − :
kao u bilo kojoj vodenoj otopini na 25 °C, što znači na ovoj temperaturi:
pH vrijednosti u otopinama različite kiselosti.
- Suprotno uvriježenom mišljenju, pH može varirati izvan raspona 0 - 14, a može ići i izvan ovih granica. Na primjer, pri koncentraciji vodikovih jona [ H+] = 10 −15 mol/l, pH= 15, pri koncentraciji hidroksidnih jona od 10 mol/l pOH = −1 .
Jer na 25 °C (standardni uslovi) [ H+] [OH − ] = 10 −14 , onda je jasno da na takvoj temperaturi pH + pHOH = 14.
Jer u kiselim otopinama [ H+] > 10 −7 , što znači da za kisele otopine pH < 7, соответственно, у щелочных растворов pH > 7 , pH neutralnih rastvora je jednako 7. Na višim temperaturama konstanta elektrolitičke disocijacije vode raste, što znači da se povećava jonski proizvod vode, tada će ona biti neutralna pH= 7 (što odgovara istovremeno povećanim koncentracijama kao H+, dakle OH−); sa padom temperature, naprotiv, neutralno pH povećava.
Metode za određivanje pH vrijednosti.
Postoji nekoliko metoda za određivanje vrijednosti pH rješenja. Indeks vodonika se približno procjenjuje pomoću indikatora, a mjeri se precizno korištenjem pH-metar ili određen analitički izvođenjem acidobazne titracije.
- Za grubu procjenu koncentracije vodikovih jona, često se koristi acido-bazni indikatori- organske materije za bojenje čija boja zavisi od pH okruženje. Najpopularniji indikatori: lakmus, fenolftalein, metil narandža (metilnarandža) itd. Indikatori mogu biti u dva različito obojena oblika – kiseli ili bazični. Boja svih indikatora se mijenja unutar vlastitog raspona kiselosti, često 1-2 jedinice.
- Za povećanje radnog intervala mjerenja pH primijeniti univerzalni indikator, što je mješavina nekoliko indikatora. Univerzalni indikator mijenja boju uzastopno od crvene preko žute, zelene, plave do ljubičaste kada se kreće iz kiselog područja u alkalno. Definicije pH korištenje indikatorske metode je teško za zamućene ili obojene otopine.
- Korišćenjem specijalnog uređaja - pH-metar - omogućava mjerenje pH u širem rasponu i preciznije (do 0,01 jedinica pH) nego korištenjem indikatora. Ionometrijska metoda određivanja pH zasniva se na mjerenju emf galvanskog kola milivoltmetar-jonometrom, koji uključuje staklenu elektrodu, čiji potencijal ovisi o koncentraciji jona H+ u okolnom rješenju. Metoda je vrlo precizna i pogodna, posebno nakon kalibracije indikatorske elektrode u odabranom rasponu pH, što omogućava mjerenje pH neprozirne i obojene otopine i stoga se često koristi.
- Analitička volumetrijska metoda — acidobazna titracija— takođe daje tačne rezultate za određivanje kiselosti rastvora. Otopina poznate koncentracije (titrant) dodaje se kap po kap u otopinu koja se ispituje. Kada se pomiješaju, dolazi do hemijske reakcije. Tačka ekvivalencije - trenutak kada ima tačno dovoljno titranta da se reakcija završi - bilježi se pomoću indikatora. Nakon toga, ako je poznata koncentracija i volumen dodane otopine titranta, određuje se kiselost otopine.
- pH:
0,001 mol/L HCl na 20 °C ima pH=3, na 30 °C pH=3,
0,001 mol/L NaOH na 20 °C ima pH=11,73, na 30 °C pH=10,83,
Utjecaj temperature na vrijednosti pH objašnjava se različitom disocijacijom vodikovih jona (H+) i nije eksperimentalna greška. Temperaturni efekat se ne može kompenzovati elektronski pH-metar.
Uloga pH u hemiji i biologiji.
Kiselost sredine je važna za većinu hemijskih procesa, a mogućnost nastanka ili rezultata određene reakcije često zavisi od pH okruženje. Za održavanje određene vrijednosti pH u reakcionom sistemu, prilikom izvođenja laboratorijskih istraživanja ili u proizvodnji, koriste se puferske otopine koje omogućavaju održavanje gotovo konstantne vrijednosti pH kada se razrijedi ili kada se otopini dodaju male količine kiseline ili lužine.
pH vrijednost pHčesto se koristi za karakterizaciju kiselinsko-baznih svojstava različitih bioloških medija.
Za biohemijske reakcije od velikog je značaja kiselost reakcionog medija koji se javlja u živim sistemima. Koncentracija vodikovih jona u otopini često utječe na fizičko-hemijska svojstva i biološku aktivnost proteina i nukleinskih kiselina, stoga je za normalno funkcioniranje organizma održavanje acidobazne homeostaze zadatak od izuzetnog značaja. Dinamičko održavanje optimalnog pH biološke tečnosti se postiže pod uticajem pufer sistema organizma.
U ljudskom tijelu pH vrijednost je različita u različitim organima.
|
Neka značenja pH. |
|
|
Supstanca |
|
|
Elektrolit u olovnim baterijama |
|
|
Želudačni sok |
|
|
Limunov sok (5% rastvor limunske kiseline) |
|
|
Prehrambeno sirće |
|
|
koka kola |
|
|
sok od jabuke |
|
|
Zdrava koža |
|
|
Kisela kiša |
|
|
Pije vodu |
|
|
Čista voda na 25 °C |
|
|
Morska voda |
|
|
Sapun (masni) za ruke |
|
|
Amonijak |
|
|
izbjeljivač (izbjeljivač) |
|
|
Koncentrovani alkalni rastvori |
|
pH vrijednost (pH faktor) je mjera aktivnosti vodikovih jona u otopini, kvantitativno izražavajući njegovu kiselost. Kada pH nije na optimalnom nivou, biljke počinju da gube sposobnost da apsorbuju neke od elemenata koji su im potrebni za zdrav rast. Sve biljke imaju specifičan pH nivo koji im omogućava postizanje maksimalnih rezultata pri rastu. Većina biljaka preferira blago kiselo okruženje za uzgoj (između 5,5-6,5).
Indeks vodika u formulama
U vrlo razrijeđenim otopinama, pH vrijednost je ekvivalentna koncentraciji vodikovih jona. Jednaka po veličini i suprotnog predznaka od decimalnog logaritma aktivnosti vodikovih jona, izražena u molovima po litri:
pH = -lg
U standardnim uslovima pH vrednost se kreće od 0 do 14. U čistoj vodi, pri neutralnom pH, koncentracija H + jednaka je koncentraciji OH - i iznosi 1·10 -7 mola po litru. Maksimalna moguća pH vrijednost definirana je kao zbir pH i pOH i jednaka je 14.
Suprotno popularnom mišljenju, pH može varirati ne samo u rasponu od 0 do 14, već može ići i preko ovih granica. Na primjer, pri koncentraciji vodikovih iona = 10 -15 mol/l, pH = 15, pri koncentraciji hidroksidnih jona od 10 mol/l pOH = -1.
Važno je razumjeti! pH skala je logaritamska, što znači da je svaka jedinica promjene jednaka desetostrukoj promjeni koncentracije vodikovih jona. Drugim rečima, rastvor sa pH 6 je deset puta kiseliji od rastvora sa pH 7, a rastvor sa pH 5 biće deset puta kiseliji od rastvora sa pH 6 i sto puta kiseliji od rastvora sa pH 7. To znači da kada podešavate pH svoje hranjive otopine i trebate promijeniti pH za dvije točke (na primjer sa 7,5 na 5,5) morate koristiti deset puta više pH regulatora nego da ste promijenili pH samo za jedan bod (od 7,5 do 6,5).
Metode za određivanje pH vrijednosti
Nekoliko metoda se široko koristi za određivanje pH vrijednosti otopina. pH vrijednost može se približno procijeniti pomoću indikatora, precizno izmjerena pH metrom ili analitički odrediti izvođenjem acidobazne titracije.
Indikatori kiselinske baze
Za grubu procjenu koncentracije vodikovih iona, široko se koriste kiselinsko-bazni indikatori - organske tvari za bojenje, čija boja ovisi o pH medija. Najpoznatiji indikatori su lakmus, fenolftalein, metil narandža (metilnarandža) i drugi. Indikatori mogu postojati u dva različito obojena oblika - kiseli ili bazični. Promjena boje svakog indikatora događa se u vlastitom rasponu kiselosti, obično 1-2 jedinice.
Univerzalni indikator
 Za proširenje radnog opsega pH mjerenja koristi se takozvani univerzalni indikator, koji je mješavina nekoliko indikatora. Univerzalni indikator uzastopno mijenja boju od crvene preko žute, zelene, plave do ljubičaste kada se kreće iz kiselog područja u bazično.
Za proširenje radnog opsega pH mjerenja koristi se takozvani univerzalni indikator, koji je mješavina nekoliko indikatora. Univerzalni indikator uzastopno mijenja boju od crvene preko žute, zelene, plave do ljubičaste kada se kreće iz kiselog područja u bazično.
Otopine takvih mješavina - "univerzalni indikatori" - obično su impregnirane trakama "indikatorskog papira", uz pomoć kojih možete brzo (sa preciznošću pH jedinica, ili čak desetina pH) odrediti kiselost vodenih otopina pod studijom. Za preciznije određivanje, boja indikatorskog papira dobijena nanošenjem kapi rastvora odmah se upoređuje sa referentnom skalom boja, čiji je izgled prikazan na slikama.

Određivanje pH pomoću indikatorske metode je teško za zamućene ili obojene otopine.
S obzirom na činjenicu da optimalne pH vrijednosti za hranjive otopine u hidroponici imaju vrlo uzak raspon (obično od 5,5 do 6,5), koristim i druge kombinacije indikatora. Na primjer, naš ima radni raspon i skalu od 4,0 do 8,0, što takav test čini preciznijim u odnosu na univerzalni indikatorski papir.

pH metar
 Korištenje posebnog uređaja - pH metra - omogućuje vam mjerenje pH u širem rasponu i preciznije (do 0,01 pH jedinica) nego korištenjem univerzalnih indikatora. Metoda je pogodna i vrlo precizna, posebno nakon kalibracije indikatorske elektrode u odabranom pH opsegu. Omogućava vam mjerenje pH neprozirnih i obojenih otopina i stoga se široko koristi.
Korištenje posebnog uređaja - pH metra - omogućuje vam mjerenje pH u širem rasponu i preciznije (do 0,01 pH jedinica) nego korištenjem univerzalnih indikatora. Metoda je pogodna i vrlo precizna, posebno nakon kalibracije indikatorske elektrode u odabranom pH opsegu. Omogućava vam mjerenje pH neprozirnih i obojenih otopina i stoga se široko koristi.

Analitička volumetrijska metoda
Analitička volumetrijska metoda - kiselinsko-bazna titracija - takođe daje precizne rezultate za određivanje kiselosti rastvora. Otopina poznate koncentracije (titrant) dodaje se kap po kap testnoj otopini. Kada se pomiješaju, dolazi do hemijske reakcije. Tačka ekvivalencije - trenutak kada ima tačno dovoljno titranta da se reakcija u potpunosti završi - bilježi se pomoću indikatora. Zatim, znajući koncentraciju i volumen dodane otopine titranta, izračunava se kiselost otopine.
Utjecaj temperature na pH vrijednosti
 pH vrijednost može se mijenjati u širokom rasponu s promjenama temperature. Dakle, 0,001 molarni rastvor NaOH na 20°C ima pH=11,73, a na 30°C pH=10,83. Utjecaj temperature na pH vrijednosti objašnjava se različitom disocijacijom vodikovih iona (H+) i nije eksperimentalna greška. Učinak temperature ne može se kompenzirati elektronikom pH metra.
pH vrijednost može se mijenjati u širokom rasponu s promjenama temperature. Dakle, 0,001 molarni rastvor NaOH na 20°C ima pH=11,73, a na 30°C pH=10,83. Utjecaj temperature na pH vrijednosti objašnjava se različitom disocijacijom vodikovih iona (H+) i nije eksperimentalna greška. Učinak temperature ne može se kompenzirati elektronikom pH metra.
Podešavanje pH nutritivnog rastvora
Zakiseljavanje hranljivog rastvora
Hranljivi rastvor se obično mora zakiseliti. Apsorpcija jona od strane biljaka uzrokuje postupnu alkalizaciju otopine. Bilo koja otopina koja ima pH 7 ili više će se najčešće morati podesiti na svoj optimalni pH. Za zakiseljavanje hranljivog rastvora mogu se koristiti različite kiseline. Najčešće se koriste sumporna ili fosforna kiselina. Bolje rješenje za hidroponske otopine su puferski aditivi kao što su i. Ovi proizvodi ne samo da dovode pH vrijednosti do optimalnih nivoa, već i stabiliziraju vrijednosti na duži period.
Prilikom prilagođavanja pH i kiselinama i alkalijama, treba nositi gumene rukavice kako biste izbjegli opekotine kože. Iskusni hemičar vješto rukuje koncentriranom sumpornom kiselinom, dodaje kiselinu kap po kap u vodu. Ali za hidroponiste početnike, možda je bolje kontaktirati iskusnog kemičara i zamoliti ga da pripremi 25% otopinu sumporne kiseline. Prilikom dodavanja kiseline otopina se miješa i određuje joj pH. Kada saznate približnu količinu sumporne kiseline, možete je dodati iz cilindričnog cilindra.
Sumporna kiselina se mora dodavati u malim porcijama kako se otopina ne bi previše zakiselila, koja će se zatim morati ponovo alkalizirati. Za neiskusnog radnika, zakiseljavanje i alkalizacija mogu trajati beskonačno. Pored gubljenja vremena i reagensa, ovakva regulacija dovodi do debalansa hranljivog rastvora zbog nakupljanja jona nepotrebnih biljkama.
Alkaliziranje hranjivog rastvora
Otopine koje su previše kisele postaju alkalne natrijum hidroksidom (natrijum hidroksidom). Kao što mu ime govori, radi se o kaustičnoj supstanci, pa se moraju koristiti gumene rukavice. Preporučuje se kupovina natrijum hidroksida u obliku tableta. U prodavnicama kućne hemije, natrijum hidroksid se može kupiti kao sredstvo za čišćenje odvoda, kao što je "Krtica". Otopiti jednu tabletu u 0,5 litara vode i postepeno dodavati alkalni rastvor u hranljivu otopinu uz stalno miješanje, često provjeravajući njen pH. Nikakva količina matematičkih proračuna ne može odrediti koliko kiseline ili lužine treba dodati u datom slučaju.
Ako želite uzgajati nekoliko usjeva u jednoj posudi, trebate ih odabrati tako da se ne poklapa samo njihov optimalni pH, već i njihove potrebe za drugim faktorima rasta. Na primjer, žuti narcisi i krizanteme zahtijevaju pH od 6,8, ali različite razine vlažnosti, tako da se ne mogu uzgajati u istoj posudi. Ako narcisima date istu količinu vlage kao krizantemama, lukovice narcisa će istrunuti. U eksperimentima, rabarbara je dostigla maksimalan razvoj pri pH 6,5, ali je mogla rasti čak i pri pH 3,5. Zob, koja preferira pH od oko 6, daje dobre prinose pri pH od 4 ako se doza dušika u hranjivoj otopini znatno poveća. Krompir raste u prilično širokom rasponu pH vrijednosti, ali najbolje raste pri pH od 5,5. Ispod ovog pH takođe se dobijaju visoki prinosi gomolja, ali oni poprimaju kiselkast ukus. Za postizanje maksimalnog prinosa visokog kvaliteta, pH hranljivih rastvora mora biti precizno podešen.
Voda je slab elektrolit; slabo se disocira prema jednačini
Na 25 °C, 10-7 mol H2O se raspada u jone u 1 litru vode. Koncentracija H+ i OH- jona (u mol/l) će biti jednaka
![]()
Čista voda ima neutralnu reakciju. Kada joj se doda kiselina povećava se koncentracija H+ jona, tj. > 10-7 mol/l; koncentracija OH- jona se smanjuje, tj. manje od 10-7 mol/l. Pri dodavanju lužine povećava se koncentracija OH- jona: > 10-7 mol/l, dakle manje od 10-7 mol/l.
U praksi se za izražavanje kiselosti ili alkalnosti otopine umjesto koncentracije koristi njen negativni decimalni logaritam, koji se naziva pH vrijednost:
![]()
U neutralnoj vodi pH = 7. pH vrijednosti i odgovarajuće koncentracije H+ i OH- jona date su u tabeli. 4.

Puferska rješenja
Mnoge analitičke reakcije se izvode na strogo definiranoj pH vrijednosti, koja se mora održavati tijekom cijele reakcije. Tokom nekih reakcija, pH se može promijeniti kao rezultat vezivanja ili oslobađanja H+ jona. Za održavanje konstantne pH vrijednosti koriste se puferske otopine.
Puferske otopine su najčešće mješavine slabih kiselina sa solima ovih kiselina ili mješavine slabih baza sa solima istih baza. Ako se, na primjer, određena količina jake kiseline kao što je HCl doda u otopinu acetatnog pufera koji se sastoji od octene kiseline CH3COOH i natrijevog acetata CH3COONa, ona će reagirati s acetatnim ionima da bi se formirao CH3COOH koji se blago disocira:
Dakle, ioni H+ dodani u otopinu neće ostati slobodni, već će biti vezani CH3COO- jonima, pa će se pH otopine teško promijeniti. Prilikom dodavanja alkalne otopine u otopinu acetatnog pufera, OH- joni će biti vezani nedisociranim molekulima octene kiseline CH3COOH:
Posljedično, pH otopine u ovom slučaju će također ostati gotovo nepromijenjen.
Puferske otopine zadržavaju svoj puferski učinak do određene granice, tj. imaju određeni kapacitet bafera. Ako u otopini ima više H+ ili OH- jona nego što puferski kapacitet otopine dozvoljava, tada će se pH značajno promijeniti, kao u nepuferiranoj otopini.
Obično postupci analize određuju koji puferski rastvor treba koristiti za dati test i kako ga treba pripremiti. Puferske smjese sa preciznim pH vrijednostima proizvode se u ampulama za pripremu otopine od 500 ml.
pH = 1,00. Sastojci: 0,084 g glikola (aminosirćetna kiselina NH2CH2COOH), 0,066 g natrijum hlorida NaCl i 2,228 g hlorovodonične kiseline HCl.
pH = 2,00. Sastav: 3,215 g limunske kiseline C6H8O7-H2O, 1,224 g natrijum hidroksida NaOH i 1,265 g hlorovodonične kiseline HCl.
pH = 3,00. Sastav: 4,235 g limunske kiseline C6H8O7-H2O, 1,612 g natrijum hidroksida NaOH i 1,088 g hlorovodonične kiseline HCl.
pH = 4,00. Sastav: 5,884 g limunske kiseline C6H8O7-H2O, 2,240 g natrijum hidroksida NaOH i 0,802 g hlorovodonične kiseline HCl.
pH = 5,00. Sastav: 10,128 g limunske kiseline C6H8O7-H2O i 3,920 g natrijum hidroksida NaOH.
pH = 6,00. Sastav: 6,263 g limunske kiseline C6H8O7-H2O i 3,160 g natrijum hidroksida NaOH.
pH = 7,00. Sastav: 1,761 g kalijum dihidrogen fosfata KH2PO4 i 3,6325 g natrijum hidrogen fosfata Na2HPO4-2H2O.
pH = 8,00. Sastav: 3,464 g borne kiseline H3BO3, 1,117 g natrijum hidroksida NaOH i 0,805 g hlorovodonične kiseline HCl.
pH = 9,00. Sastav: 1,546 g borne kiseline H3BO3, 1,864 g kalijum hlorida, KCl i 0,426 g natrijum hidroksida NaOH.
pH = 10,00. Sastav: 1,546 g borne kiseline H3BO3, 1,864 g kalijum hlorida KCl i 0,878 g natrijum hidroksida NaOH.
pH = 11,00. Sastav: 2,225 g natrijum hidrogen fosfata Na2HPO4-2H2O i 0,068 g natrijum hidroksida NaOH.
pH = 12,00. Sastav: 2,225 g natrijum hidrogen fosfata Na2HPO4-2H2O i 0,446 g natrijum hidroksida NaOH.
pH = 13,00. Sastav: 1,864 g kalijum hlorida KCl i 0,942 g natrijum hidroksida NaOH.
Odstupanja od nominalne pH vrednosti dostižu ±0,02 za rastvore sa pH od 1 do 10 i ±0,05 za pH od 11 do 13. Ova tačnost je sasvim dovoljna za praktičan rad.
Za postavljanje pH metara koriste se standardne puferske otopine s preciznim pH vrijednostima.
1. Rastvor acetatnog pufera sa pH=4,62: 6,005 g sirćetne kiseline CH3COOH i 8,204 g natrijum acetata CH3COONa u 1 litru rastvora.
2. Fosfatni puferski rastvor sa pH=6,88: 4.450 g natrijum hidrogen fosfata Na2HPO4-2H2O i 3.400 g kalijum dihidrogen fosfata KH2PO4 u 1 litru rastvora.
3. Boratni puferski rastvor sa pH=9,22: 3,81 g natrijum tetraborata Na2B4O7-10H2O u 1 litru rastvora.
4. Fosfatni puferski rastvor sa pH=11,00: 4,450 g natrijum hidrogen fosfata Na2HPO4-2H2O i 0,136 g natrijum hidroksida NaOH u 1 litru rastvora.
Za pripremu puferskih rastvora za agrohemijske i biohemijske analize sa pH vrednostima od 1,1 do 12,9 sa intervalom od 0,1 koristi se 7 baznih osnovnih rastvora.
Rješenje 1. Otopiti 11,866 g natrijum hidrogen fosfata Na2HPO4-2H2O u vodi i razblažiti u volumetrijskoj tikvici vodom do 1 litre (koncentracija rastvora 1/15 M).
Rješenje 2. Rastvoriti 9,073 kalijum dihidrogen fosfata KH2PO4 u 1 litru vode u odmjernoj tikvici (koncentracija 1/15 M).
Rješenje 3. U odmjernoj tikvici otopiti 7,507 g glikola (aminosirćetne kiseline) NH2CH2COOH i 5,84 g natrijum hlorida NaCl u 1 litru vode. Iz ovog rastvora mešanjem sa 0,1 N. puferski rastvori sa pH od 1,1 do 3,5 pripremaju se sa rastvorom HCl; mešanje sa 0,1 N. Rastvor NaOH se koristi za pripremu rastvora sa pH od 8,6 do 12,9.
Rješenje 4. Rastvoriti 21,014 g limunske kiseline C6H8O7-H2O u vodi, dodati 200 ml 1N rastvoru. otopinom NaOH i razrijediti do 1 litre vodom u odmjernoj tikvici. Mešanjem ovog rastvora sa 0,1 N. puferski rastvori sa pH od 1,1 do 4,9 pripremaju se pomoću rastvora HCl; mešanje sa 0,1 N. Puferski rastvori sa pH od 5,0 do 6,6 pripremaju se pomoću rastvora NaOH.
Rješenje 5. Otopiti 12,367 g borne kiseline H3BO3 u vodi, dodati 100 ml 1 N. otopinom NaOH i razrijediti vodom do 1 litre u odmjernoj tikvici. Mešanjem ovog rastvora sa 0,1 N. puferski rastvori sa pH od 7,8 do 8,9 pripremaju se pomoću rastvora HCl; mešanje sa 0,1 N. Puferski rastvori sa pH od 9,3 do 11,0 pripremaju se pomoću rastvora NaOH.
Rješenje 6. Pripremite tačno 0,1 N. rastvor HCl;
Rješenje 7. Pripremite tačno 0,1 N. rastvor NaOH; Za pripremu rastvora, destilovana voda se kuva 2 sata da bi se uklonio CO2. Tokom skladištenja, rastvor je zaštićen od ulaska CO2 iz vazduha pomoću cevi od kalcijum hlorida.
U nekim otopinama se tijekom skladištenja razvija plijesan; kako biste to spriječili, dodajte nekoliko kapi timola u otopinu kao konzervans. Za pripremu puferske otopine potrebnog pH, pomiješajte navedene otopine u određenom omjeru (tabela 5). Volumen se mjeri biretom kapaciteta 100,0 ml. Sve pH vrijednosti puferskih otopina u tabeli su date na temperaturi od 20 °C.
Za pripremu početnih rastvora koriste se reagensi hemijskog kvaliteta. Natrijum hidrogen fosfat Na2HPO4-2H2O je dva puta prekristalizovan. Tokom druge rekristalizacije, temperatura rastvora ne bi trebalo da pređe 90 °C. Dobijeni preparat se lagano navlaži i suši u termostatu na 36 °C dva dana. Kalijum dihidrogen fosfat KH2PO4 se takođe dva puta rekristališe i suši na 110-120 °C. Natrijum hlorid NaCl se dva puta rekristalizira i suši na 120 °C. Limunska kiselina C6H8O7-H2O se dva puta rekristalizira. Tokom druge rekristalizacije, temperatura rastvora ne bi trebalo da bude veća od 60 °C. Borna kiselina H3BO3 se dva puta rekristalizira iz kipuće vode i suši na temperaturi koja ne prelazi 80 °C.
Na pH vrijednost utiče temperatura puferske otopine. U tabeli Slika 6 prikazuje pH odstupanja u zavisnosti od temperature standardnih puferskih rastvora.

Za kreiranje datog pH u analiziranom rastvoru tokom kompleksometrijske titracije koriste se puferski rastvori sledećeg sastava.
pH = 1. Hlorovodonična kiselina, 0,1 N. rješenje.
pH = 2. Smjesa glikola NH2-CH2-COOH i njegove soli hlorovodonične kiseline NH2-CH2-COOH-HCl. Čvrsti glikol (0,2-0,3 g) se dodaje u 100 ml rastvora soli hlorovodonične kiseline.
pH = 4-6,5. Acetatna mješavina 1 N. rastvor natrijum acetata i 1 N. rastvor sirćetne kiseline. Otopine se prije upotrebe pomiješaju u jednakim količinama.
pH = 5. Smjesa otopine od 27,22 g kristalnog natrijum acetata i 60 ml 1 N. Rastvor HCl se razblaži vodom do 1 litre.
pH = 5,5. Acetatna smjesa. Rastvorite 540 g natrijum acetata u vodi i razblažite do 1 litre. Dobijenoj otopini dodajte 500 ml 1 N. rastvor sirćetne kiseline.
pH = 6,5-8. Trietanolamin i njegova sol hlorovodonične kiseline. Prije upotrebe pomiješati 1 M rastvor trietanolamina N(C2H4OH)3 i 1 M rastvor HCl u jednakim količinama.
pH = 8,5-9,0. Smjesa amonijaka i acetata. Dodajte 300 ml glacijalne sirćetne kiseline u 500 ml koncentrovanog amonijaka i razblažite vodom do 1 litre.
pH = 9. Smjesa borata. Pomiješajte 100 ml 0,3 M rastvora borne kiseline sa 45 ml 0,5 N. rastvor kaustične sode.
pH = 8-11. Amonijak je amonijum hlorid. Pomiješajte 1 N. rastvor NH4OH i 1 N. Rastvor NH4Cl u jednakim količinama prije upotrebe.
pH = 10. U 570 ml koncentrovanog rastvora amonijaka dodajte 70 g amonijum hlorida i razblažite vodom do 1 litre.
pH = 11-13. Kaustična soda, 0,1 N. rješenje.
Prilikom kompleksometrijskog određivanja ukupne tvrdoće vode koriste se sivo-smeđe pufer tablete pripremljene zajedno sa indikatorom (eriohrom crni T). U uzorak vode (100 ml) dovoljno je dodati nekoliko kapi rastvora natrijum sulfida (za maskiranje teških metala), dve pufer tablete i 1 ml koncentrovanog amonijaka. Nakon što se tablete otope, otopina postaje crvena; titrira se sa 0,02 M rastvorom EDTA do stabilne zelene boje. 1 ml 0,02 M rastvora EDTA odgovara tvrdoći vode od 0,02 eq/l. Proizvedeno u DDR-u.
pH merenje
Za određivanje pH otopina koriste se posebni reagensi - indikatori, kao i uređaji - pH metri (elektrometrijsko određivanje pH).
Određivanje pH indikatora. Najčešće se u analitičkoj praksi pH otopina određuje približno pomoću reaktivnog indikatorskog papira (u rasponu od 0,5-2,0 pH jedinica). Koristeći univerzalni indikatorski papir, možete preciznije odrediti pH (u rasponu od 0,2-0,3 pH jedinice). U tabeli 7 i 8 prikazani su podaci o reaktivnim i univerzalnim indikatorskim papirima.

Prijelaz boje univerzalnog indikatorskog papira dat je u tabeli. 8 i 9. Rezultirajuće međuboje se upoređuju sa priloženom skalom poređenja i iz nje se pronalaze pH vrijednosti ispitne otopine. Indikatorski papiri se mogu koristiti za određivanje pH vodenih rastvora sa niskom koncentracijom soli i u odsustvu jakih oksidacionih sredstava. Nakon određivanja pH pomoću univerzalnog indikatorskog papira s pH rasponom od 1,0-11,0 ili 0-12, rezultat se pojašnjava korištenjem Rifan papira s užim pH rasponom.

Elektrometrijsko mjerenje pH vrijednosti. Ova metoda je korisna za mjerenje pH obojenih otopina, u kojima je to praktično nemoguće. Za mjerenja se koriste instrumenti - pH metri sa staklenom elektrodom, koja obično zamjenjuje vodoničnu elektrodu. Vrlo rijetko se u tu svrhu koristi antimonska ili kvinhidronska elektroda.
Staklene elektrode se koriste za određivanje pH otopina koje sadrže teške metale, oksidanse i redukcione agense, kao i koloidne otopine i emulzije. Određivanje pH pomoću staklene elektrode temelji se na promjeni emf. element koji je reverzibilan u odnosu na jone vodonika.
Potencijal staklene površine u kontaktu s kiselinom ovisi o pH otopine. Ovo svojstvo stakla se koristi u staklenim elektrodama - pH indikatorima. Staklena elektroda obično ima oblik epruvete, čije je dno izrađeno u obliku staklene ploče tankih stijenki ili u obliku kugle debljine stijenke ne veće od 0,01 mm. Puferski rastvor sa poznatim pH se sipa u staklenu elektrodu i stavlja u test rastvor.
Kao referentna elektroda koristi se kalomelna elektroda. Ova elektroda je posuda koja sadrži živu na dnu, spojena na kolo platinastom žicom. Iznad žive se nalazi kalomel pasta sa kristalima KCl, a na vrhu su zasićeni rastvori KCl i kalomela (Hg2Cl2). Do kontakta elektrode sa ispitnom otopinom dolazi kroz tanko azbestno vlakno. Kalomel referentna elektroda može se koristiti za mjerenja pH na temperaturama koje ne prelaze 60 °C; pH rastvora koji sadrže fluoride ne može se izmeriti.
PH metar se uvijek provjerava i podešava pomoću puferske otopine čija je pH vrijednost blizu pH otopine koja se testira. Na primjer, za mjerenje pH u rasponu od 2 do 6, pripremite Serensen puferski rastvor sa pH = 3 ili 4, ili koristite standardni rastvor pufera sa pH = 4,62.
U laboratorijskoj praksi za mjerenje pH koristi se pH metar LPU-01, koji je dizajniran za određivanje pH otopine u rasponu od -2 do 14 sa rasponom od 4 pH jedinice: -2-2; 2-4; 6-10; 10-14. Osetljivost uređaja je 0,01 pH. Koriste i poseban laboratorijski pH metar LPS-02; pH metar tipa PL-U1 i prenosni pH metar-milivoltmetar PPM-03M1.
Industrijski pretvarač povećane tačnosti je pH metar tipa pH-261, koji je namenjen za merenje pH vrednosti rastvora i pulpe. U poljskim uslovima, pH-47M pH metar se koristi za merenje pH vodenih rastvora; za mjerenje pH ekstrakata slanog tla - pH metar PLP-64; Za mlijeko i mliječne proizvode koristi se pH metar pH-222-2. Rad na pH metrima obavlja se prema uputama koje su priložene uz svaki uređaj.
Vodikov indeks - pH - je mjera aktivnosti (u slučaju razrijeđenih otopina, odražava koncentraciju) vodikovih jona u otopini, kvantitativno izražavajući njegovu kiselost, izračunato kao negativan (uzet sa suprotnim predznakom) decimalni logaritam od aktivnost vodikovih jona, izražena u molovima po litru.
pH = – log
Ovaj koncept je 1909. godine uveo danski hemičar Sørensen. Indikator se zove pH, po prvim slovima latinske riječi potentia hydrogeni - snaga vodonika, ili pondus hydrogenii - težina vodonika.
Inverzna pH vrijednost je nešto manje rasprostranjena - pokazatelj bazičnosti otopine, pOH, jednak negativnom decimalnom logaritmu koncentracije OH iona u otopini:
rON = – log
U čistoj vodi na 25°C koncentracije vodikovih iona () i hidroksidnih iona () su iste i iznose 10 -7 mol/l, što direktno proizilazi iz konstante autoprotolize vode K w, koja se inače naziva jonski proizvod vode:
K w = =10 –14 [mol 2 /l 2 ] (na 25°C)
pH + pH = 14
Kada su koncentracije oba tipa jona u otopini iste, za otopinu se kaže da je neutralna. Kada se u vodu doda kiselina, koncentracija vodikovih iona se povećava, a koncentracija hidroksidnih iona shodno tome opada; kada se doda baza, naprotiv, sadržaj hidroksidnih jona raste, a koncentracija vodikovih iona opada. Kada > za rastvor se kaže da je kisela, a kada > da je alkalna.
pH određivanje
Nekoliko metoda se široko koristi za određivanje pH vrijednosti otopina.
1) pH vrijednost se može približno procijeniti pomoću indikatora, precizno izmjerena pH metrom ili analitički odrediti izvođenjem acidobazne titracije.
Za grubu procjenu koncentracije vodikovih iona, široko se koriste kiselinsko-bazni indikatori - organske tvari za bojenje, čija boja ovisi o pH medija. Najpoznatiji indikatori su lakmus, fenolftalein, metil narandža (metilnarandža) i drugi. Indikatori mogu postojati u dva različito obojena oblika - kiseli ili bazični. Promjena boje svakog indikatora događa se u vlastitom rasponu kiselosti, obično 1-2 jedinice (vidi tabelu 1, lekciju 2).
Za proširenje radnog opsega pH mjerenja koristi se takozvani univerzalni indikator, koji je mješavina nekoliko indikatora. Univerzalni indikator mijenja boju uzastopno od crvene preko žute, zelene, plave do ljubičaste kada se kreće iz kiselog područja u alkalno. Određivanje pH pomoću indikatorske metode je teško za zamućene ili obojene otopine.
2) Analitička volumetrijska metoda - acidobazna titracija - takođe daje tačne rezultate za određivanje ukupne kiselosti rastvora. Otopina poznate koncentracije (titrant) dodaje se kap po kap testnoj otopini. Kada se pomiješaju, dolazi do hemijske reakcije. Tačka ekvivalencije - trenutak kada ima tačno dovoljno titranta da se reakcija u potpunosti završi - bilježi se pomoću indikatora. Zatim, znajući koncentraciju i volumen dodane otopine titranta, izračunava se ukupna kiselost otopine.
Kiselost sredine je važna za mnoge hemijske procese, a mogućnost ili ishod određene reakcije često zavisi od pH okoline. Za održavanje određene pH vrijednosti u reakcionom sistemu tokom laboratorijskih istraživanja ili u proizvodnji koriste se puferske otopine, koje omogućavaju održavanje gotovo konstantne pH vrijednosti kada se razrijedi ili kada se u otopinu dodaju male količine kiseline ili lužine.
pH vrijednost se široko koristi za karakterizaciju kiselinsko-baznih svojstava različitih bioloških medija (Tablica 2).
Kiselost reakcionog medija je od posebnog značaja za biohemijske reakcije koje se odvijaju u živim sistemima. Koncentracija vodikovih jona u otopini često utječe na fizičko-hemijska svojstva i biološku aktivnost proteina i nukleinskih kiselina, stoga je za normalno funkcioniranje organizma održavanje acidobazne homeostaze zadatak od izuzetnog značaja. Dinamičko održavanje optimalnog pH bioloških tečnosti postiže se djelovanjem puferskih sistema.
3) Upotreba posebnog uređaja - pH metra - omogućava vam da mjerite pH u širem rasponu i preciznije (do 0,01 pH jedinica) nego pomoću indikatora, pogodan je i vrlo precizan, omogućava vam mjerenje pH neprozirnosti i obojena rješenja i stoga se široko koriste.
Pomoću pH metra se meri koncentracija vodoničnih jona (pH) u rastvorima, vodi za piće, prehrambenim proizvodima i sirovinama, objektima životne sredine i proizvodnim sistemima za kontinuirano praćenje tehnoloških procesa, uključujući i agresivne sredine.
pH metar je neophodan za hardversko praćenje pH rastvora za odvajanje uranijuma i plutonijuma, kada su zahtevi za ispravnost očitavanja opreme bez kalibracije izuzetno visoki.
Uređaj se može koristiti u stacionarnim i mobilnim laboratorijama, uključujući terenske laboratorije, kao i kliničkim dijagnostičkim, forenzičkim, istraživačkim i proizvodnim laboratorijama, uključujući mesnu, mliječnu i pekarsku industriju.
U posljednje vrijeme pH metri se također široko koriste u akvarijumskim farmama, praćenju kvaliteta vode u domaćim uslovima, poljoprivredi (posebno u hidroponici), a također i za praćenje zdravstvene dijagnostike.
Tabela 2. pH vrijednosti za neke biološke sisteme i druga rješenja
|
Sistem (rješenje) | |
|
Duodenum | |
|
Želudačni sok | |
|
Ljudska krv | |
|
Muscle | |
|
Sok pankreasa | |
|
Protoplazma ćelija | |
|
Tanko crijevo | |
|
Morska voda | |
|
Od belanaca od pilećeg jajeta | |
|
sok od narandže | |
|
Sok od paradajza | |
Vodikov indeks - pH - je mjera aktivnosti (u slučaju razrijeđenih otopina, odražava koncentraciju) vodikovih jona u otopini, kvantitativno izražavajući njegovu kiselost, izračunato kao negativan (uzet sa suprotnim predznakom) decimalni logaritam od aktivnost vodikovih jona, izražena u molovima po litru.
pH = – log
Ovaj koncept je 1909. godine uveo danski hemičar Sørensen. Indikator se zove pH, po prvim slovima latinske riječi potentia hydrogeni - snaga vodonika, ili pondus hydrogenii - težina vodonika.
Inverzna pH vrijednost je nešto manje rasprostranjena - pokazatelj bazičnosti otopine, pOH, jednak negativnom decimalnom logaritmu koncentracije OH iona u otopini:
rON = – log
U čistoj vodi na 25°C koncentracije vodikovih iona () i hidroksidnih iona () su iste i iznose 10 -7 mol/l, što direktno proizilazi iz konstante autoprotolize vode K w, koja se inače naziva jonski proizvod vode:
K w = =10 –14 [mol 2 /l 2 ] (na 25°C)
pH + pH = 14
Kada su koncentracije oba tipa jona u otopini iste, za otopinu se kaže da je neutralna. Kada se u vodu doda kiselina, koncentracija vodikovih iona se povećava, a koncentracija hidroksidnih iona shodno tome opada; kada se doda baza, naprotiv, sadržaj hidroksidnih jona raste, a koncentracija vodikovih iona opada. Kada > za rastvor se kaže da je kisela, a kada > da je alkalna.
pH određivanje
Nekoliko metoda se široko koristi za određivanje pH vrijednosti otopina.
1) pH vrijednost se može približno procijeniti pomoću indikatora, precizno izmjerena pH metrom ili analitički odrediti izvođenjem acidobazne titracije.
Za grubu procjenu koncentracije vodikovih iona, široko se koriste kiselinsko-bazni indikatori - organske tvari za bojenje, čija boja ovisi o pH medija. Najpoznatiji indikatori su lakmus, fenolftalein, metil narandža (metilnarandža) i drugi. Indikatori mogu postojati u dva različito obojena oblika - kiseli ili bazični. Promjena boje svakog indikatora događa se u vlastitom rasponu kiselosti, obično 1-2 jedinice (vidi tabelu 1, lekciju 2).
Za proširenje radnog opsega pH mjerenja koristi se takozvani univerzalni indikator, koji je mješavina nekoliko indikatora. Univerzalni indikator mijenja boju uzastopno od crvene preko žute, zelene, plave do ljubičaste kada se kreće iz kiselog područja u alkalno. Određivanje pH pomoću indikatorske metode je teško za zamućene ili obojene otopine.
2) Analitička volumetrijska metoda - acidobazna titracija - takođe daje tačne rezultate za određivanje ukupne kiselosti rastvora. Otopina poznate koncentracije (titrant) dodaje se kap po kap testnoj otopini. Kada se pomiješaju, dolazi do hemijske reakcije. Tačka ekvivalencije - trenutak kada ima tačno dovoljno titranta da se reakcija u potpunosti završi - bilježi se pomoću indikatora. Zatim, znajući koncentraciju i volumen dodane otopine titranta, izračunava se ukupna kiselost otopine.
Kiselost sredine je važna za mnoge hemijske procese, a mogućnost ili ishod određene reakcije često zavisi od pH okoline. Za održavanje određene pH vrijednosti u reakcionom sistemu tokom laboratorijskih istraživanja ili u proizvodnji koriste se puferske otopine, koje omogućavaju održavanje gotovo konstantne pH vrijednosti kada se razrijedi ili kada se u otopinu dodaju male količine kiseline ili lužine.
pH vrijednost se široko koristi za karakterizaciju kiselinsko-baznih svojstava različitih bioloških medija (Tablica 2).
Kiselost reakcionog medija je od posebnog značaja za biohemijske reakcije koje se odvijaju u živim sistemima. Koncentracija vodikovih jona u otopini često utječe na fizičko-hemijska svojstva i biološku aktivnost proteina i nukleinskih kiselina, stoga je za normalno funkcioniranje organizma održavanje acidobazne homeostaze zadatak od izuzetnog značaja. Dinamičko održavanje optimalnog pH bioloških tečnosti postiže se djelovanjem puferskih sistema.
3) Upotreba posebnog uređaja - pH metra - omogućava vam da mjerite pH u širem rasponu i preciznije (do 0,01 pH jedinica) nego pomoću indikatora, pogodan je i vrlo precizan, omogućava vam mjerenje pH neprozirnosti i obojena rješenja i stoga se široko koriste.
Pomoću pH metra se meri koncentracija vodoničnih jona (pH) u rastvorima, vodi za piće, prehrambenim proizvodima i sirovinama, objektima životne sredine i proizvodnim sistemima za kontinuirano praćenje tehnoloških procesa, uključujući i agresivne sredine.
pH metar je neophodan za hardversko praćenje pH rastvora za odvajanje uranijuma i plutonijuma, kada su zahtevi za ispravnost očitavanja opreme bez kalibracije izuzetno visoki.
Uređaj se može koristiti u stacionarnim i mobilnim laboratorijama, uključujući terenske laboratorije, kao i kliničkim dijagnostičkim, forenzičkim, istraživačkim i proizvodnim laboratorijama, uključujući mesnu, mliječnu i pekarsku industriju.
U posljednje vrijeme pH metri se također široko koriste u akvarijumskim farmama, praćenju kvaliteta vode u domaćim uslovima, poljoprivredi (posebno u hidroponici), a također i za praćenje zdravstvene dijagnostike.
Tabela 2. pH vrijednosti za neke biološke sisteme i druga rješenja