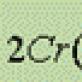Krom i njegovi spojevi. Krom oksid: formula, karakteristike i hemijska svojstva Krom he 3
Krom (II) oksid CrO- piroforni crni barut (piroforno - sposobnost paljenja na zraku u fino usitnjenom stanju). Dobija se oksidacijom hromovog amalgama atmosferskim kiseonikom. Rastvorljiv u razrijeđenoj hlorovodoničkoj kiselini:
U zraku, kada se zagrije iznad 100 ° C, krom (II) oksid se pretvara u krom (III) oksid.
Soli hroma (II). Po svojim hemijskim svojstvima, soli Cr 2+ su slične Fe 2+ soli. Tretiranjem njihovih rastvora alkalijama u odsustvu kiseonika može se dobiti žuti talog. hrom (II) hidroksid:
koji ima tipična osnovna svojstva. Je restaurator. Kada se Cr(OH) 2 kalcinira u odsustvu kiseonika, nastaje hrom oksid (II) CrO. Kada se kalciniše na vazduhu, pretvara se u Cr 2 O 3.
Sva jedinjenja hroma (II) su prilično nestabilna i lako se oksidiraju atmosferskim kiseonikom u jedinjenja hroma (III):
Soli hroma (III). Trovalentne soli hroma slične su solima aluminijuma po sastavu, strukturi kristalne rešetke i rastvorljivosti. U vodenim rastvorima, Cr 3+ katjon se javlja samo kao hidratisani jon [Cr(H 2 O) 6 ] 3+, koji daje ljubičastu boju rastvoru (radi jednostavnosti, napišite Cr 3+).
Pod dejstvom alkalija na soli hroma (III) nastaje želatinasti talog hrom hidroksid (III) - Cr (OH) 3 zelena boja:
Krom(III) hidroksid ima amfoterično svojstva, otapanje kao u kiselinama sa stvaranjem soli hroma (III):
a u alkalijama sa stvaranjem tetrahidroksihromita, odnosno soli u kojima je Cr 3+ dio anjona:
Kao rezultat kalcinacije Cr (OH) 3, može se dobiti hrom oksid (III) Cr 2 O 3 :
![]()
Krom oksid (III) Cr 2 O 3- vatrostalni zeleni prah. Po tvrdoći je blizak korundu, pa se uvodi u sastav sredstava za poliranje. Dobija se spajanjem elemenata na visokoj temperaturi.
Cr 2 O 3 je zeleni kristal, praktično nerastvorljiv u vodi. Cr 2 O 3 se takođe može dobiti kalcinacijom kalijum i amonijum dihromata:

Kada se Cr 2 O 3 spoji sa alkalijama, sodom i kiselim solima, dobijaju se jedinjenja Cr 3+ koja su rastvorljiva u vodi:

Krom(VI) oksid-kiseli oksid, anhidrid hromne H 2 CrO 4 i dihromne H 2 Cr 2 O 7 kiseline.
Dobiva se reakcijom koncentrirane sumporne kiseline sa zasićenom otopinom natrijevog ili kalijevog dihromata:
CrO 3 je kisele prirode: lako se otapa u vodi, stvarajući hromne kiseline. Sa viškom vode stvara hromnu kiselinu H 2 CrO 4:
Pri visokoj koncentraciji CrO 3 nastaje dihromna kiselina H 2 Cr 2 O 7:
koji, kada se razrijedi, postaje hromna kiselina:
Kromne kiseline postoje samo u vodenom rastvoru. Međutim, njihove soli su prilično stabilne.
CrO 3 je jarko crveni kristal, lako rastvorljiv u vodi Jak oksidant: oksidira jod, sumpor, fosfor, ugalj, dok se pretvara u Cr 2 O 3 . Na primjer:
Kada se zagrije na 250°C, razlaže se:
Reaguje sa alkalijama i formira žutu boju hromati CrO 4 2-:
U kiseloj sredini, CrO 4 2- jon se pretvara u Cr 2 O 7 2- jon.
U alkalnom okruženju, ova reakcija se odvija u suprotnom smjeru:

IN kisela sredina dihromat ion se reducira na Cr 3+:
Ako uporedimo kromove hidrokside s različitim stupnjevima oksidacije
Cr 2+ (OH) 2, Cr 3+ (OH) 3 i H 2 Cr 6+ O 4, lako je zaključiti da sa povećanjem stepena oksidacije, osnovna svojstva hidroksida slabe, a kisela se povećavaju.
Cr(OH) 2 pokazuje bazična svojstva, Cr(OH) 3 je amfoterna, a H 2 CrO 4 je kisela.
Kromati i dihromati (VI). Najvažnija jedinjenja hroma u najvišem oksidacionom stanju 6+ su kalijum hromat (VI) K 2 CrO 4 i kalijum dihromat (VI) K 2 Cr 2 O 7 .
Hromne kiseline formiraju dva niza soli: hromate, takozvane soli hromne kiseline, i dihromate, takozvane soli dihromne kiseline. Hromati su obojeni žuto (boja hromatnog jona CrO 4 2-), dihromati su obojeni narandžasto (boja dihromatnog jona Cr 2 O 7 2-).
Dihromati Na 2 Cr 2 O 7 × 2H 2 O i K 2 Cr 2 O 7 se nazivaju hromirani vrhovi. Koriste se kao oksidanti u industriji kože (štavljenje), boja i lakova, šibice i tekstilnoj industriji. Smjesa hroma - ovo je naziv 3% otopine kalij-dihromata u koncentrovanoj sumpornoj kiselini - koristi se u hemijskim laboratorijama za pranje staklenog posuđa.
Soli hromnih kiselina u kiseloj sredini su jaki oksidanti:
Jedinjenja hroma (III) u alkalnoj sredini igraju ulogu redukcionih agenasa. Pod dejstvom različitih oksidacionih sredstava - Cl 2, Br 2, H 2 O 2, KmnO 4 itd. - pretvaraju se u jedinjenja hroma (IV) - hromate:
Ovdje je jedinjenje Cr (III) prikazano u obliku Na, budući da postoji u obliku Na + i - jona u višku alkalnog rastvora.
Jaki oksidanti, kao što su KMnO 4, (NH 4) 2 S 2 O 8 u kiseloj sredini, pretvaraju jedinjenja Cr (III) u dihromate:
Dakle, oksidaciona svojstva se dosljedno poboljšavaju promjenom oksidacijskih stanja u seriji: Cr 2+ ® Cr 3+ ® Cr 6+ . Cr (II) jedinjenja su jaka redukciona sredstva, lako se oksidiraju, pretvarajući se u jedinjenja hroma. (III). Jedinjenja hroma (VI) su jaki oksidanti, lako se redukuju u jedinjenja hroma (III). Jedinjenja sa srednjim oksidacionim stanjem, tj. jedinjenja hroma (III), mogu pokazati oksidaciona svojstva kada su u interakciji sa jakim redukcionim agensima, pretvarajući se u jedinjenja hroma (II) i kada su u interakciji sa jakim oksidacionim agensima (na primer, brom, KMnO 4) mogu pokazati redukciona svojstva, pretvarajući se u jedinjenja hroma (VI).
Soli hroma (III) su veoma raznolike boje: ljubičasta, plava, zelena, smeđa, narandžasta, crvena i crna. Sve hromne kiseline i njihove soli, kao i hrom (VI) oksid su otrovne: utiču na kožu, respiratorni trakt, izazivaju upalu očiju, pa se pri radu s njima moraju pridržavati svih mera opreza.
Krom je hemijski element sa atomskim brojem 24. To je tvrd, sjajan, čelično siv metal koji se dobro polira i ne tamni. Koristi se u legurama kao što je nerđajući čelik i kao premaz. Ljudskom tijelu su potrebne male količine trovalentnog hroma za metabolizam šećera, ali Cr(VI) je vrlo toksičan.
Različita jedinjenja hroma, kao što su hrom(III) oksid i olovni hromat, jarkih su boja i koriste se u bojama i pigmentima. Crvena boja rubina je zbog prisustva ovog hemijskog elementa. Neke tvari, posebno natrij, su oksidanti koji se koriste za oksidaciju organskih spojeva i (zajedno sa sumpornom kiselinom) za čišćenje laboratorijskog staklenog posuđa. Osim toga, krom oksid (VI) se koristi u proizvodnji magnetne trake.
Otkriće i etimologija
Istorija otkrića hemijskog elementa hroma je sledeća. Godine 1761. Johann Gottlob Lehmann pronašao je narandžasto-crveni mineral na Uralskim planinama i nazvao ga "Sibirsko crveno olovo". Iako je pogrešno identificiran kao spoj olova sa selenom i željezom, materijal je zapravo bio olovni kromat s kemijskom formulom PbCrO 4 . Danas je poznat kao mineral krokonte.
Godine 1770. Peter Simon Pallas posjetio je mjesto gdje je Leman pronašao mineral crvenog olova koji je imao vrlo korisna svojstva pigmenta u bojama. Upotreba sibirskog crvenog olova kao boje se brzo razvila. Osim toga, svijetlo žuta od krokonta postala je moderna.
Godine 1797. Nicolas-Louis Vauquelin je dobio uzorke crvene Miješajući krokon sa hlorovodoničnom kiselinom, dobio je oksid CrO 3 . Krom kao hemijski element izolovan je 1798. godine. Vauquelin ga je dobio zagrijavanjem oksida s drvenim ugljem. Takođe je bio u stanju da otkrije tragove hroma u dragom kamenju kao što su rubin i smaragd.
U 1800-ima, Cr se uglavnom koristio u bojama i kožnim solima. Danas se 85% metala koristi u legurama. Ostatak se koristi u hemijskoj industriji, proizvodnji vatrostalnih materijala i livačkoj industriji.
Izgovor hemijskog elementa hrom odgovara grčkom χρῶμα, što znači "boja", zbog mnogih obojenih spojeva koji se mogu dobiti iz njega.

Rudarstvo i proizvodnja
Element je napravljen od hromita (FeCr 2 O 4). Otprilike polovina ove rude u svijetu kopa se u Južnoj Africi. Pored toga, Kazahstan, Indija i Turska su njeni glavni proizvođači. Ima dovoljno istraženih ležišta hromita, ali geografski su koncentrisani u Kazahstanu i južnoj Africi.
Naslage prirodnog metala hroma su rijetka, ali postoje. Na primjer, kopa se u rudniku Udačnaja u Rusiji. Bogat je dijamantima, a redukujuće okruženje pomoglo je u stvaranju čistog kroma i dijamanata.
Za industrijsku proizvodnju metala, rude hromita se tretiraju rastopljenom alkalijom (kaustična soda, NaOH). U tom slučaju nastaje natrijum hromat (Na 2 CrO 4) koji se redukuje ugljenikom u Cr 2 O 3 oksid. Metal se dobija zagrijavanjem oksida u prisustvu aluminija ili silicija.
U 2000. godini, oko 15 Mt rude hromita je iskopano i prerađeno u 4 Mt ferohroma, 70% hrom-gvožđa, sa procenjenom tržišnom vrednošću od 2,5 milijardi američkih dolara.

Glavne karakteristike
Karakteristika hemijskog elementa hroma je zbog činjenice da je prelazni metal četvrtog perioda periodnog sistema i da se nalazi između vanadijuma i mangana. Uvršten u VI grupu. Topi se na temperaturi od 1907 °C. U prisustvu kiseonika, hrom brzo formira tanak sloj oksida, koji štiti metal od dalje interakcije sa kiseonikom.
Kao prelazni element, reaguje sa supstancama u različitim omjerima. Tako formira spojeve u kojima ima različita oksidaciona stanja. Krom je hemijski element sa osnovnim stanjima +2, +3 i +6, od kojih je +3 najstabilnije. Osim toga, stanja +1, +4 i +5 se primjećuju u rijetkim slučajevima. Jedinjenja hroma u oksidacionom stanju +6 su jaka oksidaciona sredstva.
Koje je boje hrom? Hemijski element daje rubin nijansu. Cr 2 O 3 koji se koristi se također koristi kao pigment koji se naziva "hrom zeleno". Njegove soli boje staklo u smaragdno zelenu boju. Krom je hemijski element čije prisustvo čini rubin crvenom. Stoga se koristi u proizvodnji sintetičkih rubina.

izotopi
Izotopi hroma imaju atomsku težinu od 43 do 67. Tipično, ovaj hemijski element se sastoji od tri stabilna oblika: 52 Cr, 53 Cr i 54 Cr. Od njih, 52 Cr je najčešći (83,8% ukupnog prirodnog hroma). Osim toga, opisano je 19 radioizotopa, od kojih je 50 Cr najstabilniji, s vremenom poluraspada većim od 1,8 x 10 17 godina. 51 Cr ima poluživot od 27,7 dana, a za sve ostale radioaktivne izotope ne prelazi 24 sata, a za većinu njih traje manje od jedne minute. Element također ima dvije metastaze.
Izotopi hroma u zemljinoj kori, po pravilu, prate izotope mangana, koji nalazi primenu u geologiji. 53 Cr nastaje tokom radioaktivnog raspada 53 Mn. Odnos izotopa Mn/Cr pojačava druge informacije o ranoj istoriji Sunčevog sistema. Promjene u omjerima 53 Cr/ 52 Cr i Mn/Cr iz različitih meteorita dokazuju da su nova atomska jezgra nastala neposredno prije formiranja Sunčevog sistema.

Hemijski element hrom: svojstva, formula jedinjenja
Krom oksid (III) Cr 2 O 3, poznat i kao seskvioksid, jedan je od četiri oksida ovog hemijskog elementa. Dobija se od hromita. Zeleno jedinjenje se obično naziva "hrom zeleno" kada se koristi kao pigment za bojenje emajla i stakla. Oksid se može rastvoriti u kiselinama, formirajući soli, i u rastopljenim alkalijama, hromitima.
Kalijum bihromat
K 2 Cr 2 O 7 je snažno oksidaciono sredstvo i poželjno je kao sredstvo za čišćenje laboratorijskog staklenog posuđa od organskih materija. Za to se koristi njegova zasićena otopina, ali se ponekad zamjenjuje natrijum dihromatom, na osnovu veće rastvorljivosti potonjeg. Osim toga, može regulirati proces oksidacije organskih spojeva, pretvarajući primarni alkohol u aldehid, a zatim u ugljični dioksid.
Kalijum dihromat može izazvati kromov dermatitis. Krom je vjerovatno uzrok senzibilizacije koja dovodi do razvoja dermatitisa, posebno šaka i podlaktica, koji je kroničan i teško se liječi. Kao i druga jedinjenja Cr(VI), kalijum bihromat je kancerogen. Mora se rukovati u rukavicama i odgovarajućoj zaštitnoj opremi.

Hromna kiselina
Jedinjenje ima hipotetičku strukturu H 2 CrO 4 . U prirodi se ne nalaze ni hromne ni dihromne kiseline, ali se njihovi anioni nalaze u raznim supstancama. "Kromna kiselina", koja se može naći u prodaji, zapravo je njen kiseli anhidrid - CrO 3 trioksid.
Olovo(II) hromat
PbCrO 4 ima jarko žutu boju i praktično je nerastvorljiv u vodi. Iz tog razloga je našla primenu kao pigment za bojenje pod nazivom "žuta kruna".
Cr i petovalentna veza
Krom se odlikuje svojom sposobnošću da formira petovalentne veze. Jedinjenje stvaraju Cr(I) i ugljikovodični radikal. Između dva atoma hroma formira se petovalentna veza. Njegova formula se može napisati kao Ar-Cr-Cr-Ar gdje je Ar specifična aromatična grupa.

Aplikacija
Krom je hemijski element čija su svojstva omogućila mnogo različitih upotreba, od kojih su neke navedene u nastavku.
Daje metalima otpornost na koroziju i sjajnu površinu. Stoga je krom uključen u legure kao što je nehrđajući čelik, koji se koristi u priboru za jelo, na primjer. Koristi se i za hromiranje.
Krom je katalizator raznih reakcija. Koristi se za izradu kalupa za pečenje cigle. Njegove soli potamne kožu. Kalijum dihromat se koristi za oksidaciju organskih jedinjenja kao što su alkoholi i aldehidi, kao i za čišćenje laboratorijskog staklenog posuđa. Služi kao sredstvo za fiksiranje za bojenje tkanina, a koristi se i u fotografiji i štampanju fotografija.
CrO 3 se koristi za izradu magnetnih traka (na primjer, za audio snimanje), koje imaju bolje karakteristike od filmova od željeznog oksida.
Uloga u biologiji
Trovalentni hrom je hemijski element neophodan za metabolizam šećera u ljudskom tijelu. Nasuprot tome, heksavalentni Cr je veoma toksičan.
Mere predostrožnosti
Jedinjenja metala hroma i Cr(III) općenito se ne smatraju opasnima po zdravlje, ali tvari koje sadrže Cr(VI) mogu biti toksične ako se progutaju ili udahnu. Većina ovih supstanci iritira oči, kožu i sluzokože. Uz kroničnu izloženost, spojevi kroma(VI) mogu uzrokovati oštećenje oka ako se ne liječe pravilno. Osim toga, priznat je kancerogen. Smrtonosna doza ovog hemijskog elementa je oko pola kašičice. Prema preporukama Svjetske zdravstvene organizacije, maksimalno dozvoljena koncentracija Cr (VI) u vodi za piće je 0,05 mg po litru.
Budući da se spojevi hroma koriste u bojama i štavljenju kože, često se nalaze u tlu i podzemnim vodama napuštenih industrijskih lokacija koje zahtijevaju čišćenje i sanaciju okoliša. Prajmer koji sadrži Cr(VI) i dalje se široko koristi u vazduhoplovnoj i automobilskoj industriji.
Svojstva elementa
Glavna fizička svojstva hroma su sljedeća:
- Atomski broj: 24.
- Atomska težina: 51.996.
- Tačka topljenja: 1890 °C.
- Tačka ključanja: 2482 °C.
- Oksidacijsko stanje: +2, +3, +6.
- Konfiguracija elektrona: 3d 5 4s 1 .
Krom (II) hidroksid Cr (OH) 2 se dobija u obliku žutog taloga tretiranjem rastvora soli hroma (II) sa alkalijama u odsustvu kiseonika:
CrCl 2 + 2NaOH \u003d Cr (OH) 2 ¯ + 2NaCl
Cr(OH) 2 ima tipična osnovna svojstva i jako je redukciono sredstvo:
2Cr(OH) 2 +H 2 O+1/2O 2 =2Cr(OH) 3 ¯
Vodeni rastvori soli hroma (II) dobijaju se bez pristupa vazduhu otapanjem metalnog hroma u razblaženim kiselinama u atmosferi vodika ili redukcijom trovalentnih soli hroma cinkom u kiseloj sredini. Bezvodne soli hroma (II) su bijele, a vodeni rastvori i kristalni hidrati su plavi.
Po svojim hemijskim svojstvima, soli hroma (II) su slične solima gvožđa, ali se od ovih drugih razlikuju po izraženijim redukcionim svojstvima, tj. lakše se oksidiraju od odgovarajućih jedinjenja željeza. Zbog toga je vrlo teško dobiti i uskladištiti dvovalentna jedinjenja hroma.
Krom hidroksid (III) Cr (OH) 3 - želatinasti sivo-zeleni talog, dobija se delovanjem lužina na rastvore soli hroma (III):
Cr 2 (SO 4) 3 + 6NaOH \u003d 2Cr (OH) 3 ¯ + 3Na 2 SO 4
Krom (III) hidroksid ima amfoterna svojstva, rastvara se i u kiselinama uz stvaranje soli hroma (III):
2Cr (OH) 3 + 3H 2 SO 4 \u003d Cr 2 (SO 4) 3 + 6H 2 O i u alkalijama sa stvaranjem hidroksihromita: Cr (OH) 3 + NaOH \u003d Na 3
Kada se Cr (OH) 3 spoji sa alkalijama, nastaju metahromiti i ortohromiti:
Cr (OH) 3 + NaOH \u003d NaCrO 2 + 2H 2 O Cr (OH) 3 + 3NaOH \u003d Na 3 CrO 3 + 3H 2 O
Prilikom kalcinacije krom (III) hidroksida nastaje krom (III) oksid:
2Cr (OH) 3 \u003d Cr 2 O 3 + 3H 2 O
Trovalentne soli hroma su obojene iu čvrstom stanju iu vodenim rastvorima. Na primjer, bezvodni hrom (III) sulfat Cr 2 (SO 4) 3 je ljubičastocrven, vodeni rastvori hrom (III) sulfata, u zavisnosti od uslova, mogu promeniti boju od ljubičaste do zelene. Ovo se objašnjava činjenicom da u vodenim rastvorima Cr 3+ kation postoji samo u obliku hidratisanog jona 3+ zbog sklonosti trovalentnog hroma da formira kompleksna jedinjenja. Ljubičasta boja vodenih rastvora soli hroma (III) je upravo zbog katjona 3+. Kada se zagreju, kompleksne soli hroma (III) mogu
djelomično gube vodu, formirajući soli raznih boja, do zelene.
Trovalentne soli hroma slične su solima aluminijuma po sastavu, strukturi kristalne rešetke i rastvorljivosti; pa je za hrom (III), kao i za aluminijum tipično formiranje kalijum hrom stipse KCr (SO 4) 2 12H 2 O, koriste se za štavljenje kože i kao jedkalo u tekstilnoj delatnosti.
Soli hroma (III)Cr 2 (SO 4) 3, CrCl 3 itd. kada se čuvaju na vazduhu, stabilni su, au rastvorima prolaze kroz hidrolizu:
Cr 3+ + 3Cl - + NON "Cr (OH) 2+ + 3Cl - + H +
Hidroliza teče prema stupnju I, ali postoje soli koje su potpuno hidrolizirane:
Cr 2 S 3 + H 2 O \u003d Cr (OH) 3 ¯ + H 2 S
U redoks reakcijama u alkalnom mediju, soli hroma (III) se ponašaju kao redukcioni agensi:
Treba napomenuti da u nizu hrom hidroksida različitih oksidacionih stanja Cr (OH) 2 - Cr (OH) 3 - H 2 CrO 4, osnovna svojstva prirodno slabe, a kisela svojstva rastu. Takva promjena svojstava je posljedica povećanja stupnja oksidacije i smanjenja ionskih radijusa hroma. U istoj seriji, oksidirajuća svojstva su dosljedno poboljšana. Cr (II) jedinjenja su jaka redukciona sredstva, lako se oksidiraju, pretvarajući se u jedinjenja hroma (III). Jedinjenja hroma(VI) su jaka oksidaciona sredstva, koja se lako redukuju u jedinjenja hroma(III). Jedinjenja sa srednjim oksidacionim stanjem, tj. jedinjenja hroma (III) u interakciji sa jakim redukcionim agensima mogu da ispolje oksidirajuća svojstva, prelazeći u jedinjenja hroma (II), a u interakciji sa jakim oksidacionim agensima mogu da ispolje redukciona svojstva, prelazeći u jedinjenja hroma (VI).
Krom formira tri oksida: CrO, Cr 2 O 3 , CrO 3 .
Krom oksid (II) CrO - piroforni crni prah. Ima osnovna svojstva.
U redoks reakcijama se ponaša kao redukcijski agens:
CrO se dobija vakuumskom razgradnjom hrom karbonila Cr(CO) 6 na 300°C.
Krom oksid (III) Cr 2 O 3 - vatrostalni zeleni prah. Po tvrdoći je blizak korundu, pa se uvodi u sastav sredstava za poliranje. Nastaje interakcijom Cr i O 2 na visokoj temperaturi. U laboratoriji se hrom (III) oksid može dobiti zagrijavanjem amonijum dihromata:
(N -3 H 4) 2 Cr +6 2 O 7 \u003d Cr +3 2 O 3 + N 0 2 + 4H 2 O
Krom(III) oksid ima amfoterna svojstva. Prilikom interakcije s kiselinama nastaju soli hroma (III): Cr 2 O 3 + 3H 2 SO 4 = Cr 2 (SO 4) 3 + 3H 2 O
Pri interakciji sa alkalijama u talini nastaju jedinjenja hroma (III) - hromiti (u nedostatku kiseonika): Cr 2 O 3 + 2NaOH \u003d 2NaCrO 2 + H 2 O
Krom(III) oksid je nerastvorljiv u vodi.
U redoks reakcijama, hrom (III) oksid se ponaša kao redukciono sredstvo:

Krom oksid (VI) CrO 3 - hrom anhidrid, je tamnocrveni igličasti kristali. Kada se zagrije na oko 200°C, razlaže se:
4CrO 3 \u003d 2Cr 2 O 3 + 3O 2
Lako rastvorljiv u vodi, kiselog karaktera, stvara hromne kiseline. Sa viškom vode nastaje hromna kiselina H 2 CrO 4:
CrO 3 + H 2 O \u003d H 2 CrO 4
Pri visokoj koncentraciji CrO 3 nastaje dihromna kiselina H 2 Cr 2 O 7:
2CrO 3 + H 2 O \u003d H 2 Cr 2 O 7
koji, kada se razrijedi, postaje hromna kiselina:
H 2 Cr 2 O 7 + H 2 O \u003d 2H 2 CrO 4
Kromne kiseline postoje samo u vodenoj otopini; nijedna od ovih kiselina nije izolirana u slobodnom stanju. Međutim, njihove soli su vrlo stabilne.
Krom(VI) oksid je jako oksidaciono sredstvo:
3S + 4CrO 3 \u003d 3SO 2 + 2Cr 2 O 3
Oksidira jod, sumpor, fosfor, ugalj, pretvarajući se u Cr 2 O 3. CrO 3 se dobiva djelovanjem viška koncentrirane sumporne kiseline na zasićenu vodenu otopinu natrijevog dihromata: Na 2 Cr 2 O 7 + 2H 2 SO 4 = 2CrO 3 + 2NaHSO 4 + H 2 O Treba napomenuti jaka toksičnost hrom-oksida (VI).
DEFINICIJA
Chromium je dvadeset četvrti element periodnog sistema. Oznaka - Cr od latinskog "hroma". Smješten u četvrtom periodu, VIB grupa. Odnosi se na metale. Punjenje jezgra je 24.
Krom se nalazi u zemljinoj kori u količini od 0,02% (tež.). U prirodi se javlja uglavnom u obliku željeznog hroma FeO×Cr 2 O 3 .
Hrom je čvrst sjajni metal (slika 1), topi se na 1890 o C; njegova gustina je 7,19 g / cm 3. Na sobnoj temperaturi, hrom je otporan i na vodu i na vazduh. Razrijeđena sumporna i hlorovodonična kiselina otapaju hrom, oslobađajući vodonik. U hladnoj koncentrovanoj dušičnoj kiselini hrom je nerastvorljiv i postaje pasivan nakon tretmana s njim.
Rice. 1. Chrome. Izgled.
Atomska i molekulska težina hroma
DEFINICIJA
Relativna molekulska težina supstance(M r) je broj koji pokazuje koliko je puta masa date molekule veća od 1/12 mase atoma ugljika, i relativna atomska masa elementa(A r) - koliko je puta prosječna masa atoma nekog kemijskog elementa veća od 1/12 mase atoma ugljika.
Kako krom postoji u slobodnom stanju u obliku jednoatomskih molekula Cr, vrijednosti njegove atomske i molekularne mase su iste. One su jednake 51,9962.
Izotopi hroma
Poznato je da se hrom može pojaviti u prirodi u obliku četiri stabilna izotopa 50Cr, 52Cr, 53Cr i 54Cr. Njihovi maseni brojevi su 50, 52, 53, odnosno 54. Jezgro atoma izotopa hroma 50 Cr sadrži dvadeset četiri protona i dvadeset šest neutrona, a preostali izotopi se od njega razlikuju samo po broju neutrona.
Postoje umjetni izotopi hroma s masenim brojevima od 42 do 67, među kojima je najstabilniji 59 Cr s vremenom poluraspada od 42,3 minute, kao i jedan nuklearni izotop.
Joni hroma
Na vanjskom energetskom nivou atoma hroma nalazi se šest valentnih elektrona:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Kao rezultat hemijske interakcije, hrom odustaje od svojih valentnih elektrona, tj. je njihov donor, i pretvara se u pozitivno nabijeni ion:
Cr 0 -2e → Cr 2+;
Cr 0 -3e → Cr 3+;
Cr 0 -6e → Cr 6+.
Molekul i atom hroma
U slobodnom stanju, hrom postoji u obliku monoatomskih molekula Cr. Evo nekih svojstava koja karakteriziraju atom i molekulu hroma:
Legure hroma
Metalni hrom se koristi za hromiranje, a takođe i kao jedna od najvažnijih komponenti legiranih čelika. Uvođenje hroma u čelik povećava njegovu otpornost na koroziju kako u vodenim medijima na uobičajenim temperaturama tako i u plinovima na povišenim temperaturama. Osim toga, kromirani čelici imaju povećanu tvrdoću. Krom je dio nehrđajućeg čelika otpornog na kiseline i topline.
Primjeri rješavanja problema
PRIMJER 1
PRIMJER 2
| Zadatak | Krom oksid (VI) mase 2 g otopljen je u vodi mase 500 g. Izračunajte maseni udio hromne kiseline H 2 CrO 4 u nastaloj otopini. |
| Rješenje | Napišimo jednadžbu reakcije za dobijanje hromne kiseline iz hrom (VI) oksida: CrO 3 + H 2 O \u003d H 2 CrO 4. Pronađite masu rješenja: m otopina \u003d m (CrO 3) + m (H 2 O) = 2 + 500 = 502 g. n (CrO 3) \u003d m (CrO 3) / M (CrO 3); n (CrO 3) = 2/100 = 0,02 mol. Prema jednadžbi reakcije n(CrO 3) :n(H 2 CrO 4) = 1:1, tada n (CrO 3) = n (H 2 CrO 4) = 0,02 mol. Tada će masa hromne kiseline biti jednaka (molarna masa - 118 g / mol): m (H 2 CrO 4) \u003d n (H 2 CrO 4) × M (H 2 CrO 4); m (H 2 CrO 4) = 0,02 × 118 = 2,36 g. Maseni udio hromne kiseline u rastvoru je: ω = msolut / m rastvor × 100%; ω (H 2 CrO 4) \u003d m otopljene tvari (H 2 CrO 4) / m otopine × 100%; ω (H 2 CrO 4) = 2,36 / 502 × 100% = 0,47%. |
| Odgovori | Maseni udio hromne kiseline je 0,47%. |