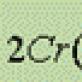Kromium dan senyawanya. Chromium oxide: rumus, karakteristik, dan sifat kimia Chromium he 3
Kromium (II) oksida CrO- bubuk hitam piroforik (piroforik - kemampuan untuk menyala di udara dalam keadaan terbagi halus). Itu diperoleh dengan oksidasi amalgam kromium dengan oksigen atmosfer. Larut dalam asam klorida encer:
Di udara, bila dipanaskan di atas 100 ° C, kromium (II) oksida berubah menjadi kromium (III) oksida.
Garam krom (II). Dalam hal sifat kimianya, garam Cr 2+ mirip dengan garam Fe 2+. Dengan memperlakukan larutannya dengan alkali tanpa oksigen, endapan kuning dapat diperoleh. kromium (II) hidroksida:
yang memiliki sifat dasar yang khas. Adalah pemulih. Ketika Cr(OH) 2 dikalsinasi tanpa oksigen, kromium oksida (II) CrO terbentuk. Ketika dikalsinasi di udara, itu berubah menjadi Cr 2 O 3.
Semua senyawa kromium (II) agak tidak stabil dan mudah teroksidasi oleh oksigen atmosfer menjadi senyawa kromium (III):
Garam krom (III). Garam kromium trivalen mirip dengan garam aluminium dalam komposisi, struktur kisi kristal dan kelarutannya. Dalam larutan berair, kation Cr 3+ hanya terjadi sebagai ion terhidrasi [Cr(H 2 O) 6 ] 3+ , yang memberikan warna ungu pada larutan (untuk mempermudah, tulis Cr 3+).
Di bawah aksi alkali pada garam krom (III), endapan agar-agar kromium hidroksida (III) - Cr (OH) 3 warna hijau:
Kromium(III) hidroksida memiliki amfoter sifat, larut seperti dalam asam dengan pembentukan garam krom (III):
dan dalam alkali dengan pembentukan tetrahidroksikromit, yaitu garam di mana Cr 3+ adalah bagian dari anion:
Sebagai hasil dari kalsinasi Cr (OH) 3, diperoleh kromium oksida (III) Cr 2 O 3 :
![]()
Kromium oksida (III) Cr 2 O 3- bubuk hijau tahan api. Ini dekat dengan korundum dalam kekerasan, oleh karena itu dimasukkan ke dalam komposisi bahan pemoles. Itu diperoleh dengan menggabungkan elemen pada suhu tinggi.
Cr 2 O 3 adalah kristal hijau, praktis tidak larut dalam air. Cr 2 O 3 juga dapat diperoleh dengan mengkalsinasi kalium dan amonium dikromat:

Ketika Cr2O3 dilebur dengan alkali, soda, dan garam asam, diperoleh senyawa Cr3+ yang larut dalam air:

Kromium(VI) oksida- asam oksida, anhidrida asam kromat H 2 CrO 4 dan dikromat H 2 Cr 2 O 7.
Ini diperoleh dengan mereaksikan asam sulfat pekat dengan larutan jenuh natrium atau kalium dikromat:
CrO 3 bersifat asam: mudah larut dalam air, membentuk asam kromat. Dengan kelebihan air, membentuk asam kromat H 2 CrO 4:
Pada konsentrasi tinggi CrO 3, asam dikromat H 2 Cr 2 O 7 terbentuk:
yang, ketika diencerkan, menjadi asam kromat:
Asam kromat hanya ada dalam larutan berair. Namun, garam mereka cukup stabil.
CrO 3 adalah kristal merah cerah, mudah larut dalam air. Oksidator kuat: mengoksidasi yodium, belerang, fosfor, batubara, sementara berubah menjadi Cr 2 O 3 . Sebagai contoh:
Ketika dipanaskan hingga 250 ° C, ia terurai:
Bereaksi dengan basa membentuk warna kuning kromat CrO 4 2-:
Dalam lingkungan asam, ion CrO 4 2- berubah menjadi ion Cr 2 O 7 2-.
Dalam lingkungan basa, reaksi ini berlangsung dalam arah yang berlawanan:

DI DALAM lingkungan asam ion dikromat direduksi menjadi Cr3+:
Jika kita membandingkan kromium hidroksida dengan derajat oksidasi yang berbeda
Cr 2+ (OH) 2, Cr 3+ (OH) 3 dan H 2 Cr 6+ O 4, mudah untuk menyimpulkan bahwa dengan peningkatan derajat oksidasi, sifat dasar hidroksida melemah, dan sifat asam meningkat.
Cr(OH) 2 menunjukkan sifat basa, Cr(OH) 3 bersifat amfoter, dan H 2 CrO 4 bersifat asam.
Kromat dan dikromat (VI). Senyawa kromium terpenting dalam bilangan oksidasi tertinggi 6+ adalah kalium kromat (VI) K 2 CrO 4 dan kalium dikromat (VI) K 2 Cr 2 O 7 .
Asam kromat membentuk dua seri garam: kromat, yang disebut garam asam kromat, dan dikromat, yang disebut garam asam dikromat. Kromat berwarna kuning (warna ion kromat CrO 4 2-), dikromat berwarna oranye (warna ion dikromat Cr 2 O 7 2-).
Dikromat Na 2 Cr 2 O 7 × 2H 2 O dan K 2 Cr 2 O 7 disebut puncak krom. Mereka digunakan sebagai oksidator dalam industri kulit (tanning), cat dan pernis, korek api dan tekstil. Campuran kromium - ini adalah nama larutan 3% kalium dikromat dalam asam sulfat pekat - digunakan di laboratorium kimia untuk mencuci barang pecah belah.
Garam dari asam kromat dalam lingkungan asam adalah oksidator kuat:
Senyawa krom (III) dalam lingkungan basa berperan sebagai agen pereduksi. Di bawah aksi berbagai zat pengoksidasi - Cl 2, Br 2, H 2 O 2, KmnO 4, dll. - mereka berubah menjadi senyawa kromium (IV) - kromat:
Di sini, senyawa Cr (III) ditampilkan dalam bentuk Na, karena ia ada dalam bentuk ion Na + dan - dalam larutan alkali berlebih.
Oksidator kuat, seperti KMnO 4, (NH 4) 2 S 2 O 8 dalam suasana asam, mengubah senyawa Cr (III) menjadi dikromat:
Dengan demikian, sifat pengoksidasi secara konsisten ditingkatkan dengan perubahan bilangan oksidasi dalam deret: Cr 2+ ® Cr 3+ ® Cr 6+ . Senyawa Cr(II) merupakan reduktor kuat, mudah teroksidasi, berubah menjadi senyawa kromium. (AKU AKU AKU). Senyawa kromium (VI) merupakan oksidator kuat, mudah direduksi menjadi senyawa kromium (III). Senyawa dengan tingkat oksidasi menengah, yaitu senyawa krom (III), dapat menunjukkan sifat pengoksidasi ketika berinteraksi dengan zat pereduksi kuat, berubah menjadi senyawa kromium (II), dan ketika berinteraksi dengan zat pengoksidasi kuat (misalnya, brom, KMnO 4) mereka dapat menunjukkan sifat pereduksi, berubah menjadi senyawa kromium (VI).
Garam krom (III) sangat beragam warnanya: ungu, biru, hijau, coklat, oranye, merah dan hitam. Semua asam kromat dan garamnya, serta kromium (VI) oksida, beracun: mereka mempengaruhi kulit, saluran pernapasan, menyebabkan radang mata, oleh karena itu, ketika bekerja dengannya, semua tindakan pencegahan harus diperhatikan.
Kromium adalah unsur kimia dengan nomor atom 24. Ini adalah logam keras, mengkilap, abu-abu baja yang memoles dengan baik dan tidak ternoda. Digunakan dalam paduan seperti baja tahan karat dan sebagai pelapis. Tubuh manusia membutuhkan sejumlah kecil kromium trivalen untuk memetabolisme gula, tetapi Cr(VI) sangat beracun.
Berbagai senyawa kromium, seperti kromium(III) oksida dan timbal kromat, berwarna cerah dan digunakan dalam cat dan pigmen. Warna merah pada batu rubi disebabkan oleh adanya unsur kimia ini. Beberapa zat, terutama natrium, adalah zat pengoksidasi yang digunakan untuk mengoksidasi senyawa organik dan (bersama dengan asam sulfat) untuk membersihkan peralatan gelas laboratorium. Selain itu, kromium oksida (VI) digunakan dalam produksi pita magnetik.
Penemuan dan etimologi
Sejarah penemuan unsur kimia kromium adalah sebagai berikut. Pada tahun 1761, Johann Gottlob Lehmann menemukan mineral merah jingga di Pegunungan Ural dan menamakannya "timbal merah Siberia". Meskipun salah diidentifikasi sebagai senyawa timbal dengan selenium dan besi, bahan tersebut sebenarnya adalah timbal kromat dengan rumus kimia PbCrO 4 . Hari ini dikenal sebagai mineral croconte.
Pada tahun 1770, Peter Simon Pallas mengunjungi tempat di mana Leman menemukan mineral timbal merah yang memiliki sifat pigmen yang sangat berguna dalam cat. Penggunaan timbal merah Siberia sebagai cat berkembang pesat. Selain itu, kuning cerah dari croconte telah menjadi mode.
Pada 1797, Nicolas-Louis Vauquelin memperoleh sampel merah Dengan mencampur croconte dengan asam klorida, ia memperoleh oksida CrO 3 . Kromium sebagai unsur kimia diisolasi pada tahun 1798. Vauquelin mendapatkannya dengan memanaskan oksida dengan arang. Ia juga mampu mendeteksi jejak kromium pada batu permata seperti ruby dan zamrud.
Pada 1800-an, Cr terutama digunakan dalam cat dan garam kulit. Saat ini, 85% logam digunakan dalam paduan. Sisanya digunakan dalam industri kimia, produksi bahan tahan api dan industri pengecoran.
Pengucapan unsur kimia kromium sesuai dengan bahasa Yunani , yang berarti "warna", karena banyak senyawa berwarna yang dapat diperoleh darinya.

Pertambangan dan produksi
Unsur tersebut terbuat dari kromit (FeCr 2 O 4). Sekitar setengah dari bijih ini di dunia ditambang di Afrika Selatan. Selain itu, Kazakhstan, India, dan Turki adalah produsen utamanya. Ada cukup banyak endapan kromit yang dieksplorasi, tetapi secara geografis mereka terkonsentrasi di Kazakhstan dan Afrika bagian selatan.
Deposit logam kromium asli jarang terjadi, tetapi memang ada. Misalnya, ditambang di tambang Udachnaya di Rusia. Ini kaya akan berlian, dan lingkungan yang tereduksi membantu membentuk kromium dan berlian murni.
Untuk produksi industri logam, bijih kromit diperlakukan dengan alkali cair (soda api, NaOH). Dalam hal ini, natrium kromat (Na 2 CrO 4) terbentuk, yang direduksi oleh karbon menjadi Cr 2 O 3 oksida. Logam diperoleh dengan memanaskan oksida dengan adanya aluminium atau silikon.
Pada tahun 2000, sekitar 15 Mt bijih kromit ditambang dan diproses menjadi 4 Mt ferrochromium, 70% chromium-besi, dengan perkiraan nilai pasar sebesar US$2,5 miliar.

Karakter utama
Karakteristik unsur kimia kromium disebabkan oleh fakta bahwa itu adalah logam transisi dari periode keempat tabel periodik dan terletak di antara vanadium dan mangan. Termasuk dalam golongan VI. Meleleh pada suhu 1907 °C. Di hadapan oksigen, kromium dengan cepat membentuk lapisan tipis oksida, yang melindungi logam dari interaksi lebih lanjut dengan oksigen.
Sebagai unsur transisi, ia bereaksi dengan zat dalam berbagai proporsi. Dengan demikian, ia membentuk senyawa di mana ia memiliki berbagai keadaan oksidasi. Kromium adalah unsur kimia dengan keadaan dasar +2, +3 dan +6, di mana +3 adalah yang paling stabil. Selain itu, status +1, +4 dan +5 diamati dalam kasus yang jarang terjadi. Senyawa kromium dalam keadaan oksidasi +6 adalah oksidator kuat.
chrome warna apa? Unsur kimia memberikan rona ruby. Cr 2 O 3 yang digunakan juga digunakan sebagai pigmen yang disebut "chrome green". Warna garamnya kaca dalam warna hijau zamrud. Chromium adalah unsur kimia yang kehadirannya membuat ruby berwarna merah. Oleh karena itu, digunakan dalam produksi batu rubi sintetis.

isotop
Isotop kromium memiliki berat atom dari 43 hingga 67. Biasanya, unsur kimia ini terdiri dari tiga bentuk stabil: 52 Cr, 53 Cr, dan 54 Cr. Dari jumlah tersebut, 52 Cr adalah yang paling umum (83,8% dari semua kromium alami). Selain itu, 19 radioisotop telah dideskripsikan, di mana 50 Cr adalah yang paling stabil, dengan waktu paruh melebihi 1,8 x 10 17 tahun. 51 Cr memiliki waktu paruh 27,7 hari, dan untuk semua isotop radioaktif lainnya tidak melebihi 24 jam, dan sebagian besar berlangsung kurang dari satu menit. Elemen ini juga memiliki dua metastatis.
Isotop kromium di kerak bumi, sebagai aturan, menyertai isotop mangan, yang menemukan aplikasi dalam geologi. 53 Cr terbentuk selama peluruhan radioaktif 53 Mn. Rasio isotop Mn/Cr memperkuat informasi lain tentang sejarah awal tata surya. Perubahan rasio 53 Cr/52 Cr dan Mn/Cr dari meteorit yang berbeda membuktikan bahwa inti atom baru diciptakan tepat sebelum pembentukan tata surya.

Unsur kimia kromium: sifat, rumus senyawa
Kromium oksida (III) Cr 2 O 3, juga dikenal sebagai sesquioxide, adalah salah satu dari empat oksida unsur kimia ini. Itu diperoleh dari kromit. Senyawa hijau umumnya disebut sebagai "hijau krom" bila digunakan sebagai pigmen untuk lukisan enamel dan kaca. Oksida dapat larut dalam asam, membentuk garam, dan dalam alkali cair, kromit.
Kalium bikromat
K 2 Cr 2 O 7 adalah oksidator kuat dan lebih disukai sebagai bahan pembersih untuk peralatan gelas laboratorium dari bahan organik. Untuk ini, larutan jenuh digunakan, tetapi kadang-kadang diganti dengan natrium dikromat, berdasarkan kelarutan yang lebih tinggi dari natrium dikromat. Selain itu, dapat mengatur proses oksidasi senyawa organik, mengubah alkohol primer menjadi aldehida, dan kemudian menjadi karbon dioksida.
Kalium dikromat dapat menyebabkan dermatitis kromium. Kromium mungkin merupakan penyebab sensitisasi yang mengarah pada perkembangan dermatitis, terutama pada tangan dan lengan bawah, yang kronis dan sulit diobati. Seperti senyawa Cr(VI) lainnya, kalium bikromat bersifat karsinogenik. Itu harus ditangani dengan sarung tangan dan peralatan pelindung yang sesuai.

asam kromat
Senyawa tersebut memiliki struktur hipotetis H 2 CrO 4 . Baik asam kromat maupun dikromat tidak ditemukan di alam, tetapi anionnya ditemukan dalam berbagai zat. "Asam kromat", yang dapat ditemukan di pasar, sebenarnya adalah asam anhidridanya - CrO 3 trioksida.
Timbal(II) kromat
PbCrO 4 memiliki warna kuning cerah dan praktis tidak larut dalam air. Untuk alasan ini, telah ditemukan aplikasi sebagai pigmen pewarna dengan nama "mahkota kuning".
Cr dan ikatan pentavalen
Kromium dibedakan oleh kemampuannya untuk membentuk ikatan pentavalen. Senyawa ini dibuat oleh Cr(I) dan radikal hidrokarbon. Ikatan pentavalen terbentuk antara dua atom kromium. Rumusnya dapat ditulis sebagai Ar-Cr-Cr-Ar di mana Ar adalah gugus aromatik tertentu.

Aplikasi
Kromium adalah unsur kimia yang sifatnya telah memberikan banyak kegunaan yang berbeda, beberapa di antaranya tercantum di bawah ini.
Ini memberikan ketahanan logam terhadap korosi dan permukaan yang mengkilap. Oleh karena itu, kromium termasuk dalam paduan seperti baja tahan karat, yang digunakan dalam peralatan makan, misalnya. Ini juga digunakan untuk pelapisan krom.
Kromium adalah katalis untuk berbagai reaksi. Ini digunakan untuk membuat cetakan untuk menembakkan batu bata. Garamnya membuat kulit menjadi cokelat. Kalium dikromat digunakan untuk mengoksidasi senyawa organik seperti alkohol dan aldehida, serta untuk membersihkan peralatan gelas laboratorium. Ini berfungsi sebagai agen pengikat untuk mewarnai kain dan juga digunakan dalam fotografi dan pencetakan foto.
CrO 3 digunakan untuk membuat pita magnetik (misalnya, untuk perekaman audio), yang memiliki karakteristik lebih baik daripada film oksida besi.
Peran dalam biologi
Kromium trivalen adalah elemen kimia penting untuk metabolisme gula dalam tubuh manusia. Sebaliknya, Cr heksavalen sangat beracun.
Tindakan pencegahan
Logam kromium dan senyawa Cr(III) umumnya tidak dianggap berbahaya bagi kesehatan, tetapi zat yang mengandung Cr(VI) dapat menjadi racun jika tertelan atau terhirup. Sebagian besar zat ini mengiritasi mata, kulit dan selaput lendir. Dengan paparan kronis, senyawa kromium(VI) dapat menyebabkan kerusakan mata jika tidak ditangani dengan benar. Selain itu, ini adalah karsinogen yang diakui. Dosis mematikan dari unsur kimia ini adalah sekitar setengah sendok teh. Menurut rekomendasi Organisasi Kesehatan Dunia, konsentrasi maksimum Cr (VI) yang diizinkan dalam air minum adalah 0,05 mg per liter.
Karena senyawa kromium digunakan dalam pewarna dan penyamakan kulit, senyawa ini sering ditemukan di tanah dan air tanah di lokasi industri yang ditinggalkan yang memerlukan pembersihan dan perbaikan lingkungan. Primer yang mengandung Cr(VI) masih banyak digunakan dalam industri dirgantara dan otomotif.
Properti Elemen
Sifat fisik utama kromium adalah sebagai berikut:
- Nomor atom: 24.
- Berat atom: 51.996.
- Titik lebur: 1890 °C.
- Titik didih: 2482 °C.
- Keadaan oksidasi: +2, +3, +6.
- Konfigurasi elektron: 3d 5 4s 1 .
Kromium (II) hidroksida Cr (OH) 2 diperoleh dalam bentuk endapan kuning dengan memperlakukan larutan garam krom (II) dengan alkali tanpa oksigen:
CrCl 2 + 2NaOH \u003d Cr (OH) 2 + 2NaCl
Cr(OH) 2 memiliki sifat dasar yang khas dan merupakan zat pereduksi kuat:
2Cr(OH) 2 +H 2 O+1/2O 2 =2Cr(OH) 3
Larutan berair dari garam kromium (II) diperoleh tanpa akses ke udara dengan melarutkan logam kromium dalam asam encer dalam atmosfer hidrogen atau dengan mereduksi garam kromium trivalen dengan seng dalam media asam. Garam kromium (II) anhidrat berwarna putih, dan larutan berair serta hidrat kristal berwarna biru.
Dalam hal sifat kimianya, garam krom (II) mirip dengan garam besi, tetapi berbeda dari yang terakhir dalam sifat pereduksi yang lebih jelas, mis. lebih mudah dari senyawa besi yang sesuai untuk mengoksidasi. Itulah mengapa sangat sulit untuk mendapatkan dan menyimpan senyawa kromium divalen.
Kromium hidroksida (III) Cr (OH) 3 - endapan abu-abu-hijau agar-agar, diperoleh dengan aksi alkali pada larutan garam krom (III):
Cr 2 (SO 4) 3 + 6NaOH \u003d 2Cr (OH) 3 + 3Na 2 SO 4
Kromium (III) hidroksida memiliki sifat amfoter, larut baik dalam asam dengan pembentukan garam krom (III):
2Cr (OH) 3 + 3H 2 SO 4 \u003d Cr 2 (SO 4) 3 + 6H 2 O dan dalam basa dengan pembentukan hidroksikromit: Cr (OH) 3 + NaOH \u003d Na 3
Ketika Cr (OH) 3 menyatu dengan alkali, metakromit dan ortokromit terbentuk:
Cr (OH) 3 + NaOH \u003d NaCrO 2 + 2H 2 O Cr (OH) 3 + 3NaOH \u003d Na 3 CrO 3 + 3H 2 O
Saat mengkalsinasi kromium (III) hidroksida, kromium (III) oksida terbentuk:
2Cr (OH) 3 \u003d Cr 2 O 3 + 3H 2 O
Garam kromium trivalen diwarnai baik dalam keadaan padat maupun dalam larutan berair. Misalnya, kromium (III) sulfat anhidrat Cr 2 (SO 4) 3 berwarna ungu-merah, larutan kromium (III) sulfat dalam air, tergantung pada kondisinya, dapat berubah warna dari ungu menjadi hijau. Hal ini dijelaskan oleh fakta bahwa dalam larutan berair kation Cr 3+ hanya ada dalam bentuk ion 3+ terhidrasi karena kecenderungan kromium trivalen untuk membentuk senyawa kompleks. Warna ungu larutan berair garam kromium (III) justru disebabkan oleh kation 3+. Ketika dipanaskan, garam kompleks krom (III) dapat
sebagian kehilangan air, membentuk garam berbagai warna, hingga hijau.
Garam kromium trivalen mirip dengan garam aluminium dalam komposisi, struktur kisi kristal, dan kelarutan; jadi, untuk krom (III), serta untuk aluminium, pembentukan kalium kromium tawas KCr (SO 4) 2 12H 2 O khas, mereka digunakan untuk penyamakan kulit dan sebagai mordan dalam bisnis tekstil.
Garam krom (III)Cr 2 (SO 4) 3, CrCl 3, dll. ketika disimpan di udara, mereka stabil, dan dalam larutan mereka mengalami hidrolisis:
Cr 3+ + 3Cl - + NON "Cr (OH) 2+ + 3Cl - + H +
Hidrolisis berjalan sesuai dengan tahap I, tetapi ada garam yang sepenuhnya terhidrolisis:
Cr 2 S 3 + H 2 O \u003d Cr (OH) 3 + H 2 S
Dalam reaksi redoks dalam media basa, garam krom (III) berperilaku sebagai zat pereduksi:
Perlu dicatat bahwa dalam rangkaian kromium hidroksida dari berbagai keadaan oksidasi Cr (OH) 2 - Cr (OH) 3 - H 2 CrO 4, sifat dasar secara alami melemah dan sifat asam meningkat. Perubahan sifat seperti itu disebabkan oleh peningkatan derajat oksidasi dan penurunan jari-jari ion kromium. Dalam seri yang sama, sifat pengoksidasi ditingkatkan secara konsisten. Senyawa Cr(II) merupakan reduktor kuat, mudah teroksidasi, berubah menjadi senyawa krom (III). Senyawa kromium(VI) adalah oksidator kuat, mudah direduksi menjadi senyawa kromium(III). Senyawa dengan keadaan oksidasi antara, mis. senyawa kromium (III), ketika berinteraksi dengan zat pereduksi kuat, dapat menunjukkan sifat pengoksidasi, berubah menjadi senyawa kromium (II), dan ketika berinteraksi dengan zat pengoksidasi kuat, mereka dapat menunjukkan sifat pereduksi, berubah menjadi senyawa kromium (VI).
Kromium membentuk tiga oksida: CrO, Cr 2 O 3 , CrO 3 .
Kromium oksida (II) CrO - bubuk hitam piroforik. Memiliki sifat dasar.
Dalam reaksi redoks, ia berperilaku sebagai agen pereduksi:
CrO diperoleh dengan dekomposisi vakum kromium karbonil Cr(CO) 6 pada 300 °C.
Kromium oksida (III) Cr 2 O 3 - bubuk hijau tahan api. Ini dekat dengan korundum dalam kekerasan, oleh karena itu dimasukkan ke dalam komposisi bahan pemoles. Dibentuk oleh interaksi Cr dan O2 pada suhu tinggi. Di laboratorium, kromium (III) oksida dapat diperoleh dengan memanaskan amonium dikromat:
(N -3 H 4) 2 Cr +6 2 O 7 \u003d Cr +3 2 O 3 + N 0 2 + 4H 2 O
Kromium(III) oksida memiliki sifat amfoter. Saat berinteraksi dengan asam, garam kromium (III) terbentuk: Cr 2 O 3 + 3H 2 SO 4 \u003d Cr 2 (SO 4) 3 + 3H 2 O
Saat berinteraksi dengan alkali dalam lelehan, senyawa kromium (III) terbentuk - kromit (tanpa oksigen): Cr 2 O 3 + 2NaOH \u003d 2NaCrO 2 + H 2 O
Kromium(III) oksida tidak larut dalam air.
Dalam reaksi redoks, kromium (III) oksida berperilaku sebagai zat pereduksi:

Chromium oxide (VI) CrO 3 - chromic anhydride, adalah kristal seperti jarum berwarna merah tua. Ketika dipanaskan sampai sekitar 200 ° C, terurai:
4CrO 3 \u003d 2Cr 2 O 3 + 3O 2
Mudah larut dalam air, bersifat asam, membentuk asam kromat. Dengan kelebihan air, asam kromat H 2 CrO 4 terbentuk:
CrO 3 + H 2 O \u003d H 2 CrO 4
Pada konsentrasi tinggi CrO 3, asam dikromat H 2 Cr 2 O 7 terbentuk:
2CrO 3 + H 2 O \u003d H 2 Cr 2 O 7
yang, ketika diencerkan, menjadi asam kromat:
H 2 Cr 2 O 7 + H 2 O \u003d 2H 2 CrO 4
Asam kromat hanya ada dalam larutan berair; tidak satupun dari asam ini telah diisolasi dalam keadaan bebas. Namun, garam mereka sangat stabil.
Kromium(VI) oksida adalah oksidator kuat:
3S + 4CrO 3 \u003d 3SO 2 + 2Cr 2 O 3
Mengoksidasi yodium, belerang, fosfor, batu bara, berubah menjadi Cr 2 O 3. CrO 3 diperoleh dengan aksi kelebihan asam sulfat pekat pada larutan jenuh natrium dikromat: Na 2 Cr 2 O 7 + 2H 2 SO 4 \u003d 2CrO 3 + 2NaHSO 4 + H 2 O Harus diperhatikan toksisitas kuat kromium oksida (VI).
DEFINISI
kromium adalah elemen kedua puluh empat dari Tabel Periodik. Penunjukan - Cr dari bahasa Latin "kromium". Berada di periode keempat, grup VIB. Mengacu pada logam. Biaya inti adalah 24.
Kromium terkandung dalam kerak bumi dalam jumlah 0,02% (berat). Di alam, itu terjadi terutama dalam bentuk besi kromium FeO×Cr 2 O 3 .
Kromium adalah logam padat mengkilap (Gbr. 1), meleleh pada 1890 o C; massa jenisnya adalah 7,19 g / cm3. Pada suhu kamar, kromium tahan terhadap air dan udara. Asam sulfat dan asam klorida encer melarutkan kromium, melepaskan hidrogen. Dalam asam nitrat pekat dingin, kromium tidak larut dan menjadi pasif setelah perawatan dengannya.
Beras. 1. Krom. Penampilan.
Berat atom dan molekul kromium
DEFINISI
Berat molekul relatif suatu zat(M r) adalah angka yang menunjukkan berapa kali massa molekul tertentu lebih besar dari 1/12 massa atom karbon, dan massa atom relatif suatu unsur(A r) - berapa kali massa rata-rata atom suatu unsur kimia lebih besar dari 1/12 massa atom karbon.
Karena kromium ada dalam keadaan bebas dalam bentuk molekul Cr monoatomik, nilai massa atom dan molekulnya adalah sama. Mereka sama dengan 51.9962.
Isotop kromium
Diketahui bahwa kromium dapat ditemukan di alam dalam bentuk empat isotop stabil 50Cr, 52Cr, 53Cr, dan 54Cr. Nomor massanya masing-masing adalah 50, 52, 53, dan 54. Inti atom dari isotop kromium 50 Cr mengandung dua puluh empat proton dan dua puluh enam neutron, dan isotop yang tersisa berbeda darinya hanya dalam jumlah neutron.
Ada isotop buatan kromium dengan nomor massa dari 42 hingga 67, di antaranya yang paling stabil adalah 59 Cr dengan waktu paruh 42,3 menit, serta satu isotop nuklir.
Ion kromium
Pada tingkat energi terluar atom kromium, terdapat enam elektron yang bervalensi:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Sebagai hasil interaksi kimia, kromium melepaskan elektron valensinya, yaitu adalah donor mereka, dan berubah menjadi ion bermuatan positif:
Cr 0 -2e → Cr 2+;
Cr 0 -3e → Cr 3+;
Cr 0 -6e → Cr 6+.
Molekul dan atom kromium
Dalam keadaan bebas, kromium ada dalam bentuk molekul Cr monoatomik. Berikut adalah beberapa sifat yang mencirikan atom dan molekul kromium:
Paduan kromium
Logam kromium digunakan untuk pelapisan krom, dan juga sebagai salah satu komponen terpenting dari baja paduan. Pengenalan kromium ke dalam baja meningkatkan ketahanannya terhadap korosi baik dalam media berair pada suhu biasa dan dalam gas pada suhu tinggi. Selain itu, baja kromium telah meningkatkan kekerasan. Kromium adalah bagian dari baja tahan karat tahan asam dan tahan panas.
Contoh pemecahan masalah
CONTOH 1
CONTOH 2
| Tugas | Kromium oksida (VI) seberat 2 g dilarutkan dalam air seberat 500 g. Hitung fraksi massa asam kromat H 2 CrO 4 dalam larutan yang dihasilkan. |
| Larutan | Mari kita tulis persamaan reaksi untuk memperoleh asam kromat dari kromium (VI) oksida: CrO 3 + H 2 O \u003d H 2 CrO 4. Tentukan massa larutan: m solusi \u003d m (CrO 3) + m (H 2 O) \u003d 2 + 500 \u003d 502 g. n (CrO 3) \u003d m (CrO 3) / M (CrO 3); n (CrO 3) \u003d 2/100 \u003d 0,02 mol. Berdasarkan persamaan reaksi n(CrO 3) :n(H 2 CrO 4) = 1:1, maka n (CrO 3) \u003d n (H 2 CrO 4) \u003d 0,02 mol. Maka massa asam kromat akan sama dengan (massa molar - 118 g / mol): m (H 2 CrO 4) \u003d n (H 2 CrO 4) × M (H 2 CrO 4); m (H 2 CrO 4) \u003d 0,02 × 118 \u003d 2,36 g. Fraksi massa asam kromat dalam larutan adalah: = zat terlarut / larutan × 100%; (H 2 CrO 4) \u003d m zat terlarut (H 2 CrO 4) / m larutan × 100%; (H 2 CrO 4) \u003d 2,36 / 502 × 100% \u003d 0,47%. |
| Menjawab | Fraksi massa asam kromat adalah 0,47%. |