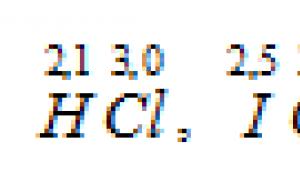Legături chimice. Terminologie de bază. Legătura chimică într-o moleculă cu Legătura chimică într-o moleculă de gaz râd
Legătură covalentă. Structura unei molecule de apă
Sarcina 61.
Ce legătură chimică se numește covalentă? Cum putem explica direcția unei legături covalente? Cum explică metoda legăturii de valență (BC) structura moleculei de apă?
Soluţie:
Comunicarea realizată prin formarea perechilor de electroni aparținând în mod egal ambilor atomi se numește nepolar covalent. Legăturile covalente sunt orientate în spațiu într-un anumit fel, adică au o direcție. Motivul pentru care moleculele pot avea o structură liniară, plată sau altă structură este că atomii folosesc diferiți orbitali și numere diferite ale acestora pentru a forma legături. Moleculele care au un moment dipol nu sunt liniare, iar moleculele care nu au un moment dipol sunt liniare.
Molecula de apă H 2 O are un moment dipol, ceea ce înseamnă că are o structură neliniară. Formarea legăturilor dintre atomii de oxigen și hidrogen implică un atom de oxigen și doi atomi de hidrogen. Oxigenul este atomul central din molecula de apă și are patru perechi de electroni, două perechi singure și două perechi comune, care sunt formate dintr-un electron s și un electron p de oxigen. O astfel de moleculă are o structură tetraedrică; în centrul tetraedrului există un atom de oxigen, iar la colțurile tetraedrului sunt doi atomi de hidrogen și două perechi de electroni de oxigen. Într-o astfel de moleculă, unghiul dintre legături ar trebui să fie egal cu 109,5 0. Dacă molecula de apă ar fi plată, atunci unghiul HOH ar trebui să fie de 90 0. Dar analiza de difracție cu raze X a moleculelor de apă arată că unghiul HOH este egal cu 104,5 0. Aceasta explică faptul că molecula de apă nu are o formă liniară, ci are forma unui tetraedru distorsionat. Acest lucru se explică prin faptul că atomul de oxigen suferă hibridizare sp 3, atunci când un orbital s și trei orbitali p ai atomului de oxigen hibridizează, formând patru orbitali hibrid sp 3 echivalenți. Din cei patru orbitali hibrizi sp 3, doi sunt ocupați de orbitalii s ai atomului de hidrogen. Diferența dintre unghiul de legătură și unghiul tetraedric se explică prin faptul că repulsia între perechile de electroni singuri este mai mare decât între perechile de electroni de legătură.
Legătură covalentă polară
Sarcina 62.
Care legătură covalentă se numește polară? Care este o măsură cantitativă a polarității unei legături covalente? Pe baza valorilor electronegativității atomilor elementelor corespondente, determinați care dintre legăturile: HCl, ICl, BrF este cea mai polară.
Soluţie:
O legătură covalentă care este formată din diferiți atomi se numește polară. De exemplu, H - CI; Centrul de greutate al sarcinii negative (asociat cu electronii) nu coincide cu centrul de greutate al sarcinii pozitive (asociat cu sarcina nucleului atomic). Densitatea de electroni a electronilor partajați este deplasată într-o măsură mai mare către unul dintre atomii care au o valoare mai mare a electronegativității. În H:Cl, perechea de electroni partajată este deplasată către atomul de clor cel mai electronegativ. Polaritatea legăturii este cuantificată de momentul dipol (), care este produsul lungimii dipolului (l) - distanța dintre două sarcini egale și opuse +g și –g și valoarea absolută a sarcinii: = lg. Momentele dipolare HCI, HBr, HI sunt egale cu 1,04, respectiv; 0,79; 0,38 D. Momentele dipolare ale moleculelor sunt de obicei măsurate în debyes (D)*: 1D = 3,33 .
10 -30 Kl .
m.
Momentul dipol este o mărime vectorială și este direcționat de-a lungul axei dipolului de la sarcina negativă la cea pozitivă. Momentul dipol al legăturii oferă informații valoroase despre comportamentul moleculei în ansamblu. Împreună cu momentul dipol, o caracteristică numită electronegativitatea unui element (EO) este utilizată pentru a evalua gradul de polaritate a legăturii. EO este capacitatea unui atom de a atrage electroni de valență de la alți atomi. Valorile EO ale elementelor sunt date în scale speciale (tabele).
Valorile EO ale hidrogenului, clorului, bromului, iodului, fluorului sunt, respectiv: 2,1; 3,0; 2,8; 2,5; 4.0. Pe baza valorilor EO ale elementelor din conexiuni
![]()
cea mai polară legătură din molecula BrF, deoarece diferența de electronegativitate dintre fluor și brom este cea mai mare - 1,2 (4,0 - 2,8 = 1,2) decât cea a HCl și IСl.
Legătura donor-acceptor
Sarcina 63.
Ce metodă de formare a unei legături covalente se numește donor-acceptor? Ce legături chimice sunt prezente în ionii NH 4+ și BF 4-? Specificați donatorul și acceptorul.
Soluţie:
O legătură donor-acceptor este o legătură covalentă în care doar unul dintre atomii care participă la legătură oferă o pereche comună de electroni. În acest caz, unul dintre atomi este un donator - un furnizor al unei perechi de electroni, iar celălalt este un acceptor - un furnizor al unui orbital cuantic liber.
Cationul de amoniu NH4+ se formează conform mecanismului donor-acceptor:

Are forma unui tetraedru regulat:

În ionul de amoniu, fiecare atom de hidrogen este conectat la un atom de azot printr-o pereche de electroni comună, dintre care unul este realizat printr-un mecanism donor-acceptor. Este important de reținut că legăturile H - N formate prin diferite mecanisme nu au nicio diferență, adică toate sunt echivalente. Donatorul este un atom de azot, iar acceptorul este un atom de hidrogen.
Ionul BF 4- este format din BF 3 și ionul F-. Acest ion se formează datorită faptului că perechea de electroni singuratică a ionului F- este „înglobată” în învelișul de valență al atomului de bor al moleculei BF3 legată covalent:

În ionul BF 4, donorul este ionul de fluor, iar acceptorul este atomul de bor al moleculei BF 3.
Legătura donor-acceptor în formulele structurale este reprezentată de o săgeată care este îndreptată de la donor la acceptor.
Metoda legăturii de valență (VB)
Sarcina 64.
Cum explică metoda legăturii de valență (BC) structura liniară a moleculei de BeCl 2 și a CH 4 tetraedric?
Soluţie
a) Conceptele metodei legăturii de valență fac posibilă explicarea geometriei multor molecule. Astfel, molecula BeCl2 este formată dintr-un atom de beriliu și doi atomi de clor. Un atom de beriliu în stare excitată are un electron s și un electron p. Când se formează BeCl 2, apar două legături covalente. Una dintre ele ar trebui să fie o legătură s - p, formată ca urmare a suprapunerii dintre norul s al atomului de beriliu și norul p al atomului de clor, celălalt (legătura p - p) datorită suprapunerii p. -norul atomului de beriliu si norul p al atomului de clor.
Legătura p - p și s - p pot fi situate într-un unghi unul față de celălalt, adică molecula BeCl 2 ar trebui să fie unghiulară, dar este stabilit cu precizie că molecula BeCl 2 are o structură liniară, iar ambele legături sunt egale ca energie si lungime. Pentru a explica geometria moleculei BeCl 2 se folosește conceptul de hibridizare a orbitalilor atomici. Esența conceptului de orbitali atomici este că orbitalii atomici pot fi modificați geometric și amestecați unul cu celălalt în așa fel încât să asigure cea mai mare suprapunere cu orbitalii altor atomi și, prin urmare, cel mai mare câștig de energie. Acest lucru se realizează dacă în loc de orbitali cu forme și energii diferite, apar orbitali hibrizi de aceeași formă și energie, care sunt combinații liniare ale orbitalilor atomici originali. Astfel, în atomul Be, orbitalul s și orbitalul p interacționează, energiile lor sunt egalizate și se formează doi orbitali sp-hibrizi de aceeași formă. Cei doi nori de electroni sp-hibrizi rezultați au aceeași energie și o formă asimetrică, ceea ce asigură o suprapunere mai mare între norii de electroni p ai atomului de clor decât suprapunerea care implică nori s și p puri nehibridați. Doi nori hibrizi sp sunt localizați unul față de celălalt și nucleul atomic la un unghi de 180 0:

Orez. 1. Molecula triatomică BeCl 2
Ca rezultat al acestui aranjament de nori hibrizi, molecula BeCl 2 are o structură liniară.
b) Molecula CH 4 este formată dintr-un atom de carbon și patru atomi de hidrogen, între care iau patru legături covalente. Un atom de carbon în stare excitată are patru electroni nepereche, unul dintre ei în orbital s și trei în orbital p:
Umplerea nivelului de energie exterior al unui atom de carbon în starea fundamentală:
![]()
Umplerea nivelului de energie externă al unui atom de carbon în stare excitată:
![]()
Dintre cele patru legături din molecula CH 4, trebuie să existe una s - s și trei s - p, formate din cauza suprapunerii orbitalilor atomului de carbon cu orbitalul s al atomilor de hidrogen. Ca urmare a acestei suprapuneri, ar trebui să se formeze o legătură s - s, diferită de cele trei legături s - p ca lungime și energie și situată față de oricare dintre ele la un unghi de aproximativ 125 0. Cu toate acestea, s-a stabilit cu precizie că molecula CH 4 are forma unui tetraedru cu un unghi între legături de 109,5 0, iar toate legăturile sunt echivalente ca lungime și energie. Structura tetraedrică a moleculei CH4 poate fi explicată prin hibridizarea sp3. Atomul de carbon conține patru orbitali hibrizi sp 3, rezultați dintr-o combinație liniară a unui orbital s și a trei orbitali p. Cei patru orbitali hibrizi sp3 sunt situati la un unghi de 109,5 0 unul fata de celalalt. Ele sunt îndreptate către vârfurile tetraedrului, în centrul căruia se află nucleul atomului de carbon (Fig. 2.).
Orez. 2. Schema structurii moleculei CH4;
Metan, nu există perechi de electroni fără legături.
Astfel, în molecula CH4 se formează patru legături chimice echivalente datorită suprapunerii orbitalilor hibrizi sp3 ai atomului de carbon cu orbitalii s ai atomilor de carbon.
Formarea legăturii sigma și a legăturii pi
Sarcina 65.
Care legătură covalentă se numește legătură - și care legătură -? Explicați structura moleculei de azot ca exemplu.
Soluţie:
O legătură formată prin suprapunere de-a lungul unei linii care leagă doi atomi se numește -legatura (orice legatura simpla) sau „Daca suprapunerea orbitalilor atomici are loc pe axa internucleara, atunci se formeaza o legatura sigma (-conexiune). O legătură sigma este formată prin suprapunerea a doi orbitali s (legatura s - s), unul s și unul p (legatura s - p), doi orbitali p (legatura p - p), unul s și un orbital d ( legătură s - d), un orbital p și unul d (legatură p - d).
Variante de suprapunere a orbitalilor atomici care duc la formare
C 2s 2 2p 2 C +1e = C -
О 2s 2 2p 4 О -1е = О +
O altă explicație pentru formarea unei legături triple în molecula de CO este posibilă.
Un atom de carbon neexcitat are 2 electroni neperechi, care pot forma 2 perechi de electroni comuni cu 2 electroni neperechi ai atomului de oxigen (conform mecanismului de schimb). Cu toate acestea, cei 2 electroni p perechi prezenți în atomul de oxigen pot forma o legătură chimică triplă, deoarece atomul de carbon are o celulă neumplută care poate accepta această pereche de electroni.
O legătură triplă este formată printr-un mecanism donor-acceptor, direcția săgeții este de la donorul de oxigen la acceptorul - carbon.
La fel ca N 2 - CO are o energie de disociere mare (1069 kJ), este slab solubil în apă și inert chimic. CO este un gaz incolor și inodor, indiferent, care nu formează sare și nu interacționează cu alcalii acizi și apa în condiții normale. Otrăvitoare, pentru că interacționează cu fierul, care face parte din hemoglobină. Când temperatura este crescută sau iradiată, aceasta prezintă proprietățile unui agent reducător.
Chitanță:
în industrie
CO 2 + C « 2CO
2C + O2®2CO
in laborator: H2S04, t
HCOOH® CO + H20;
H2SO4t
H2C2O4® CO + CO2 + H2O.
CO reacționează numai la temperaturi ridicate.
Molecula de CO are o afinitate mare pentru oxigen și arde pentru a forma CO2:
CO + 1/2O 2 = CO 2 + 282 kJ/mol.
Datorită afinității sale mari pentru oxigen, CO este utilizat ca agent reducător pentru oxizii multor metale grele (Fe, Co, Pb etc.).
CO + Cl 2 = COCl 2 (fosgen)
CO + NH3® HCN + H2O H – Cº N
CO + H 2 O « CO 2 + H 2
CO+S®COS
De cel mai mare interes sunt carbonilii metalici (folositi pentru a obtine metale pure). Legătura chimică are loc conform mecanismului donor-acceptor; suprapunerea p are loc conform mecanismului dativ.
5CO + Fe ® (pentacarbonil de fier)
Toți carbonilii sunt substanțe diamagnetice, caracterizate prin rezistență scăzută; atunci când sunt încălzite, carbonilii se descompun
→ 4CO + Ni (nichel carbonil).
La fel ca CO, carbonilii metalici sunt toxici.
Legătură chimică într-o moleculă de CO2
Într-o moleculă de CO2 sp- hibridizarea atomilor de carbon. Doi orbitali sp-hibridați formează 2 legături s cu atomii de oxigen, iar orbitalii p nehibridați rămași de carbon formează legături p cu doi orbitali p de atomi de oxigen, care sunt situate în planuri perpendiculare unul pe celălalt.
O ═ C ═ O
Sub presiune 60 atm. iar la temperatura camerei, CO2 se condensează într-un lichid incolor. Cu o răcire puternică, CO 2 lichid se solidifică într-o masă albă asemănătoare zăpezii, sublimându-se la P = 1 atm și t = 195 K (-78 °). Masa solidă comprimată se numește gheață carbonică; CO 2 nu susține arderea. Doar substanțele care au o afinitate mai mare pentru oxigen decât carbonul arde în el: de exemplu,
2Mg + CO2® 2MgO + C.
CO2 reacţionează cu NH3:
CO2 + 2NH3 = CO(NH2)2 + H2O
(carbamidă, uree)
2СО 2 + 2Na 2 O 2 ® 2Na 2 CO 3 +O 2
Ureea este descompusă de apă:
CO(NH 2) 2 + 2H 2 O ® (NH 4) 2 CO 3 → 2NH 3 + CO 2
Celuloza este un carbohidrat care constă din reziduuri de b-glucoză. Se sintetizează în plante după următoarea schemă
clorofilă
6CO 2 + 6H 2 O ® C 6 H 12 O 6 + 6O 2 fotosinteza glucozei
CO 2 se obține folosind tehnologia:
![]()
2NaHCO3® Na2CO3 + H2O + CO2
din cocs C + O 2 ® CO 2
În laborator (în aparatul Kipp):
. 
Acidul carbonic și sărurile sale
Dizolvându-se în apă, dioxidul de carbon interacționează parțial cu acesta, formând acid carbonic H 2 CO 3; în acest caz se stabilesc echilibre:
K 1 = 4 × 10 -7 K 2 = 4,8 × 10 -11 – acid dibazic, slab, instabil, cu oxigen. Hidrocarbonații sunt solubili în H 2 O. Carbonații sunt insolubili în apă, cu excepția carbonaților de metale alcaline, Li 2 CO 3 și (NH 4) 2 CO 3. Sărurile acide ale acidului carbonic sunt preparate prin trecerea excesului de CO2 într-o soluție apoasă de carbonat:
sau prin adăugarea treptată (picătură cu picătură) a unui acid puternic la un exces de soluție apoasă de carbonat:
Na2CO3 + HNO3® NaHCO3 + NaNO3
Când interacționează cu alcalii sau încălzire (calcinare), sărurile acide se transformă în unele medii:
Sărurile sunt hidrolizate conform ecuației:
pun în scenă
Datorită hidrolizei complete, carbonații Gr 3+, Al 3+, Ti 4+, Zr 4+ etc. nu pot fi izolați din soluții apoase.
Sărurile de importanță practică sunt Na 2 CO 3 (sodă), CaCO 3 (cretă, marmură, calcar), K 2 CO 3 (potasă), NaHCO 3 (bicarbonat de sodiu), Ca (HCO 3) 2 și Mg (HCO 3) 2 determinați duritatea carbonatică a apei.
Disulfură de carbon (CS 2)
Când este încălzit (750-1000°C), carbonul reacţionează cu sulful, formând disulfură de carbon, solvent organic (lichid volatil incolor, substanță reactivă), inflamabil și volatil.
![]()
Vaporii CS 2 sunt otrăvitori, utilizați pentru fumigația (fumigația) grânarelor împotriva insectelor dăunătoare, iar în medicina veterinară pentru tratamentul ascariazei la cai. În tehnologie - un solvent pentru rășini, grăsimi, iod.
Cu sulfuri metalice, CS 2 formează săruri ale acidului tiocarbonic - tiocarbonați.
Această reacție este similară cu procesul
Tiocarbonați– substanțe cristaline galbene. Când este expus la acizi, acidul tiocarbonic liber este eliberat.
Este mai stabil decât H 2 CO 3 și la temperaturi scăzute este eliberat din soluție sub formă de lichid uleios galben care se descompune ușor în:
Compuși ai carbonului cu azot (CN) 2 sau C 2 N 2 – cician, gaz incolor foarte inflamabil. Cianură pură uscată este preparată prin încălzire sublimată cu cianură de mercur (II).
HgCl 2 + Hg(CN) 2 ® Hg 2 Cl 2 + (С N) 2
Alte moduri de a primi:
4HCNg + O22(CN)2+2H20
2HCN g + CI2 (CN)2 + 2HCI
![]()
Cicianina are proprietăți similare cu halogenii sub forma moleculară X2. Deci, într-un mediu alcalin, ca și halogenii, este disproporționat:
(CN)2 + 2NaOH = NaCN + NaOCN
Acid cianhidric- HCN (), un compus covalent, un gaz care se dizolvă în apă pentru a forma acid cianhidric (un lichid incolor și sărurile sale sunt extrem de otrăvitoare). A primi:
![]()
Cianură de hidrogen este produsă industrial prin reacții catalitice.
2CH4 + 3O2 + 2NH3® 2HCN + 6H2O.
Sărurile acidului cianhidric - cianurile - sunt supuse unei hidrolize severe. CN - este un ion izoelectronic pentru molecula de CO și este inclus ca ligand într-un număr mare de complexe d-element.
Manipularea cianurii necesită precauții stricte. În agricultură sunt folosite pentru combaterea insectelor deosebit de periculoase - dăunătorii.
Se obțin cianuri:
Compuși de carbon cu stare de oxidare negativă:
1) covalent (carborundum SiC) ![]() ;
;
2) ioncovalent;
3) carburi metalice.
Covalentul ionic se descompune cu apă, eliberând gaz; în funcție de ce fel de gaz este eliberat, ele sunt împărțite în:
metanide(CH 4 este eliberat)
Al4C3 + 12H2O® 4Al(OH)3 + 3CH4
acetilenide(C2H2 este eliberat)
H2C2 + AgNO3® Ag2C2 + HNO3
Carburele metalice sunt compuși de compoziție stoechiometrică formați din elemente din grupele 4, 7, 8 prin introducerea atomilor Me în rețeaua cristalină de carbon.
Chimia siliciului
Diferența dintre chimia siliciului și a carbonului se datorează dimensiunii mari a atomului său și posibilității de a utiliza orbitali 3d. Din această cauză, legăturile Si – O – Si, Si – F sunt mai puternice decât cele ale carbonului.
Pentru siliciu sunt cunoscuţi oxizi de compoziţie SiO şi SiO 2. Monoxidul de siliciu există numai în fază gazoasă la temperaturi ridicate în atmosferă inertă; este ușor oxidat de oxigen pentru a forma oxidul mai stabil SiO2.
2SiO + О 2 t ® 2SiO 2
SiO2– silice, are mai multe modificări cristaline. Temperatură scăzută - cuarț, are proprietăți piezoelectrice. Soiuri naturale de cuarț: cristal de rocă, topaz, ametist. Soiuri de silice - calcedonie, opal, agat, nisip.
Sunt cunoscute o mare varietate de silicați (mai precis, oxosilicați). Structura lor are un model comun: toate constau din tetraedre SiO 4 4, care sunt conectate între ele printr-un atom de oxigen.
Combinațiile de tetraedre pot fi conectate în lanțuri, panglici, ochiuri și rame.
Silicații naturali importanți sunt 3MgO×H2O×4SiO2talcul, 3MgO×2H2O×2SiO2 azbest.
Ca și SiO2, silicații sunt caracterizați printr-o stare sticloasă (amorfă). Cu cristalizare controlată, este posibil să se obțină o stare fin-cristalină - ceramică din sticlă - materiale cu rezistență crescută. Aluminosilicații sunt obișnuiți în natură - ortosilicații cadru; unii atomi de Si sunt înlocuiți cu Al, de exemplu Na 12 [(Si, Al) O 4 ] 12.
Cea mai durabilă halogenură, SiF 4, se descompune numai sub influența unei descărcări electrice.
Acid hexafluorosilic (apropiat ca putere de H2SO4).
(SiS 2) n – substanță polimerică, se descompune cu apă:
Acizi silicici.
Acizii silicici SiO 2 corespunzători nu au o compoziție specifică, ei sunt de obicei scrisi sub forma xH 2 O ySiO 2 - compuși polimerici
Cunoscut:
H 2 SiO 3 (H 2 O×SiO 2) – metasiliciu (nu există cu adevărat)
H 4 SiO 4 (2H 2 O×SiO 2) – ortosiliciu (cel mai simplu existent de fapt doar în soluție)
H 2 Si 2 O 5 (H 2 O×2SiO 2) – dimetacilicon.
Acizii silicici sunt substanțe slab solubile; H 4 SiO 4 se caracterizează printr-o stare coloidală, ca un acid mai slab decât acidul carbonic (Si este mai puțin metalic decât C).
În soluțiile apoase, are loc condensarea acidului ortosilicic, rezultând formarea acizilor polisilicici.

Silicații sunt săruri ale acizilor silicici, insolubile în apă, cu excepția silicaților de metale alcaline.
Silicații solubili se hidrolizează conform ecuației
Soluțiile tip jeleu de săruri de sodiu ale acizilor polisilicici sunt numite „sticlă lichidă”. Folosit pe scară largă ca adeziv silicat și ca conservant pentru lemn.
Prin fuzionarea Na 2 CO 3 , CaCO 3 și SiO 2 se obține sticlă, care este o soluție reciprocă suprarăcită de săruri ale acizilor polisilicici.
6SiO 2 + Na 2 CO 3 + CaCO 3 ® Na 2 O × CaO × 6SiO 2 + 2CO 2 Silicatul se scrie ca un oxid mixt.
Silicații sunt cei mai folosiți în construcții. Locul 1 în lume la producția de produse din silicat - ciment, 2 - cărămidă, 3 - sticlă.
Ceramica de constructii – faianta, tevi ceramice. Pentru fabricarea produselor sanitare - sticla, portelan, faianta, ceramica din argila.
Legătură chimică.
determinarea legăturii chimice;
tipuri de legături chimice;
metoda legăturii de valență;
caracteristicile de bază ale legăturilor covalente;
mecanisme de formare a legăturilor covalente;
compuși complecși;
metoda orbitală moleculară;
interacțiuni intermoleculare.
DEFINIȚIA LEGĂTURII CHIMICE
Legătură chimică numită interacțiunea dintre atomi, ducând la formarea de molecule sau ioni și menținerea puternică a atomilor unul lângă celălalt.
O legătură chimică este de natură electronică, adică se realizează datorită interacțiunii electronilor de valență. În funcție de distribuția electronilor de valență în moleculă, se disting următoarele tipuri de legături: ionice, covalente, metalice etc. O legătură ionică poate fi considerată ca un caz extrem al unei legături covalente între atomi care diferă puternic ca natură.
TIPURI DE LEGĂTURI CHIMICE
Legătură ionică.
Prevederi de bază ale teoriei moderne a legăturii ionice.
O legătură ionică se formează în timpul interacțiunii elementelor care diferă brusc unele de altele în proprietăți, adică între metale și nemetale.
Formarea unei legături chimice se explică prin dorința atomilor de a realiza o înveliș exterioară stabilă de opt electroni (s 2 p 6).
Ca: 1s 2 2s 2 p 6 3s 2 p 6 4s 2
 Ca 2+ : 1s 2 2s 2 p 6 3s 2
p 6
Ca 2+ : 1s 2 2s 2 p 6 3s 2
p 6
Cl: 1s 2 2s 2 p 6 3s 2 p 5
 Cl – : 1s 2 2s 2 p 6 3s 2
p 6
Cl – : 1s 2 2s 2 p 6 3s 2
p 6
Ionii încărcați opus rezultați sunt ținuți unul lângă celălalt datorită atracției electrostatice.
Legătura ionică nu este direcțională.
Nu există nicio legătură pur ionică. Deoarece energia de ionizare este mai mare decât energia afinității electronilor, un transfer complet de electroni nu are loc nici în cazul unei perechi de atomi cu o diferență mare de electronegativitate. Prin urmare, putem vorbi despre fracția de ionicitate a legăturii. Cea mai mare ionicitate a legăturii apare în fluorurile și clorurile elementelor s. Astfel, în cristalele de RbCl, KCl, NaCl și NaF este de 99, 98, 90 și, respectiv, 97%.
Legătură covalentă.
Prevederi de bază ale teoriei moderne a legăturilor covalente.
O legătură covalentă se formează între elemente cu proprietăți similare, adică nemetale.
Fiecare element furnizează 1 electron pentru formarea legăturilor, iar spinurile electronilor trebuie să fie antiparalele.
Dacă o legătură covalentă este formată din atomi ai aceluiași element, atunci această legătură nu este polară, adică perechea de electroni comună nu este deplasată la niciunul dintre atomi. Dacă o legătură covalentă este formată din doi atomi diferiți, atunci perechea de electroni comună este deplasată la atomul cel mai electronegativ, acesta legătură covalentă polară.
Când se formează o legătură covalentă, norii de electroni ai atomilor care interacționează se suprapun; ca urmare, o zonă cu densitate electronică crescută apare în spațiul dintre atomi, atrăgând nucleele încărcate pozitiv ale atomilor care interacționează și ținându-i unul lângă celălalt. Ca urmare, energia sistemului scade (Fig. 14). Cu toate acestea, atunci când atomii sunt foarte apropiați, repulsia nucleelor crește. Prin urmare, există o distanță optimă între miezuri ( lungimea link-ului,l sv), la care sistemul are energie minimă. În această stare, se eliberează energie, numită energie de legare - E St.

Orez. 14. Dependența energiei sistemelor a doi atomi de hidrogen cu rotiri paralele (1) și antiparalele (2) de distanța dintre nuclee (E este energia sistemului, E este energia de legare, r este distanța dintre nuclee). nuclee, l– lungimea comunicării).
Pentru a descrie legăturile covalente, se folosesc două metode: metoda legăturii de valență (VB) și metoda orbitalelor moleculare (MMO).
METODA LEGĂRILOR DE VALENCE.
Metoda BC se bazează pe următoarele prevederi:
1. O legătură chimică covalentă este formată din doi electroni cu spini opuși, iar această pereche de electroni aparține la doi atomi. Combinațiile de astfel de legături cu doi electroni și două centre, care reflectă structura electronică a moleculei, se numesc scheme de valență.
2. Cu cât legătura covalentă este mai puternică, cu atât norii de electroni care interacționează se suprapun.
Pentru a descrie vizual schemele de valență, se utilizează de obicei următoarea metodă: electronii aflați în stratul exterior de electroni sunt desemnați prin puncte situate în jurul simbolului chimic al atomului. Electronii împărțiți de doi atomi sunt indicați prin puncte plasate între simbolurile lor chimice; o legătură dublă sau triplă este indicată de două sau trei perechi de puncte comune, respectiv:
N: 1s 2 2s 2
p 3
;

C: 1s 2 2s 2 p 4
Din diagramele de mai sus este clar că fiecare pereche de electroni care conectează doi atomi corespunde unei linii care ilustrează o legătură covalentă în formulele structurale:

Numărul de perechi de electroni comuni care leagă un atom al unui element dat cu alți atomi sau, cu alte cuvinte, numărul de legături covalente formate de un atom, se numește covalenţa conform metodei BC. Astfel, covalența hidrogenului este 1, cea a azotului este 3.
După metoda suprapunerii norilor de electroni, conexiunile sunt de două tipuri: - conexiune și - conexiune.
- o legătură apare atunci când doi nori de electroni se suprapun de-a lungul axei care leagă nucleele atomilor.
Orez. 15. Schema de formare a - legături.
- o legătură se formează atunci când norii de electroni se suprapun de fiecare parte a liniei care leagă nucleele atomilor care interacționează.

Orez. 16. Schema de formare a legăturilor .
CARACTERISTICI DE BAZĂ ALE LEGĂRII COVALENTE.
1. Lungimea legăturii, ℓ. Aceasta este distanța minimă dintre nucleele atomilor care interacționează, care corespunde celei mai stabile stări a sistemului.
2. Energia de legătură, E min - aceasta este cantitatea de energie care trebuie consumată pentru a rupe o legătură chimică și pentru a elimina atomii dincolo de limitele de interacțiune.
3. Momentul dipol al conexiunii,  ,=qℓ. Momentul dipol servește ca măsură cantitativă a polarității unei molecule. Pentru moleculele nepolare, momentul dipol este 0, pentru moleculele nepolare nu este egal cu 0. Momentul dipol al unei molecule poliatomice este egal cu suma vectorială a dipolilor legăturilor individuale:
,=qℓ. Momentul dipol servește ca măsură cantitativă a polarității unei molecule. Pentru moleculele nepolare, momentul dipol este 0, pentru moleculele nepolare nu este egal cu 0. Momentul dipol al unei molecule poliatomice este egal cu suma vectorială a dipolilor legăturilor individuale:

4. O legătură covalentă se caracterizează prin direcționalitate. Direcția unei legături covalente este determinată de necesitatea suprapunerii maxime în spațiu a norilor de electroni de atomi care interacționează, ceea ce duce la formarea celor mai puternice legături.
Deoarece aceste legături sunt strict orientate în spațiu, în funcție de compoziția moleculei, ele pot fi la un anumit unghi unele față de altele - un astfel de unghi se numește valență.
Moleculele diatomice au o structură liniară. Moleculele poliatomice au o configurație mai complexă. Să luăm în considerare geometria diferitelor molecule folosind exemplul formării hidrurilor.
1. Grupa VI, subgrupa principală (cu excepția oxigenului), H2S, H2Se, H2Te.
S1s 2 2s 2 r 6 3s 2 r 4
Pentru hidrogen, un electron cu s-AO participă la formarea unei legături, pentru sulf – 3p y și 3p z. Molecula de H2S are o structură plată cu un unghi între legături de 90 0. .

Figura 17. Structura moleculei H 2 E
2. Hidruri de elemente din grupa V, subgrupa principală: PH 3, AsH 3, SbH 3.
Р 1s 2 2s 2 р 6 3s 2 р 3 .
La formarea legăturilor participă: pentru hidrogen s-AO, pentru fosfor - p y, p x și p z AO.
Molecula PH 3 are forma unei piramide trigonale (la baza este un triunghi).

Figura 18. Structura moleculei EN 3
5. Saturabilitatea legătura covalentă este numărul de legături covalente pe care le poate forma un atom. Este limitat pentru că un element are un număr limitat de electroni de valență. Numărul maxim de legături covalente pe care le poate forma un anumit atom în starea fundamentală sau excitată se numește al său covalenţa.
Exemplu: hidrogenul este monocovalent, oxigenul este bicovalent, azotul este tricovalent etc.
Unii atomi își pot crește covalența în starea excitată prin disocierea electronilor perechi.
Exemplu. Fii 0 1s 2 2s 2

Un atom de beriliu în stare excitată are un electron de valență pe 2p-AO și un electron pe 2s-AO, adică covalența Be 0 = 0 și covalența Be* = 2. În timpul interacțiunii, are loc hibridizarea orbitalilor.
Hibridizare- aceasta este egalizarea energiei diferitelor AO ca rezultat al amestecării înainte de interacțiunea chimică. Hibridizarea este o tehnică condiționată care permite să se prezică structura unei molecule folosind o combinație de AO. Acele AO ale căror energii sunt apropiate pot lua parte la hibridizare.
Fiecare tip de hibridizare corespunde unei anumite forme geometrice a moleculelor.
În cazul hidrurilor elementelor din grupa II din subgrupul principal, la formarea legăturii participă doi orbitali sp-hibrizi identici. Acest tip de conexiune se numește sp-hibridare.

Figura 19. Molecula BeH2.sp-Hibridare.
Orbitalii sp-hibrizi au o formă asimetrică, părțile alungite ale AO sunt îndreptate spre hidrogen cu un unghi de legătură de 180 o. Prin urmare, molecula BeH 2 are o structură liniară (Fig.).
Să luăm în considerare structura moleculelor de hidruri ale elementelor din grupa III a subgrupului principal folosind exemplul de formare a moleculei BH 3.
B 0 1s 2 2s 2 p 1

Covalența B 0 = 1, covalența B* = 3.
Trei orbitali sp-hibrizi iau parte la formarea legăturilor, care se formează ca urmare a redistribuirii densităților de electroni ai s-AO și a doi p-AO. Acest tip de conexiune se numește sp 2 - hibridizare. Unghiul de legătură la sp 2 - hibridizare este egal cu 120 0, prin urmare molecula BH 3 are o structură triunghiulară plată.

Fig.20. Molecula BH 3. sp 2 -Hibridare.
Folosind exemplul formării moleculei CH4, să luăm în considerare structura moleculelor de hidruri ale elementelor din grupa IV a subgrupului principal.
C 0 1s 2 2s 2 p 2

Covalența C0 = 2, covalența C* = 4.
În carbon, patru orbitali sp-hibrizi participă la formarea unei legături chimice, formată ca urmare a redistribuirii densităților de electroni între s-AO și trei p-AO. Forma moleculei CH 4 este un tetraedru, unghiul de legătură este de 109°28`.

Orez. 21. Molecula CH4.sp3-Hibridare.
Excepții de la regula generală sunt moleculele H2O și NH3.
Într-o moleculă de apă, unghiurile dintre legături sunt de 104,5 grade. Spre deosebire de hidrurile altor elemente din acest grup, apa are proprietăți speciale: este polară și diamagnetică. Toate acestea se explică prin faptul că tipul de legătură într-o moleculă de apă este sp 3. Adică, patru orbitali sp - hibrizi participă la formarea unei legături chimice. Doi orbitali conțin câte un electron fiecare, acești orbitali interacționează cu hidrogenul, iar ceilalți doi orbitali conțin o pereche de electroni. Prezența acestor doi orbitali explică proprietățile unice ale apei.
În molecula de amoniac, unghiurile dintre legături sunt de aproximativ 107,3 o, adică forma moleculei de amoniac este un tetraedru, tipul de legătură este sp 3. Patru orbitali hibrizi sp 3 iau parte la formarea unei legături pe o moleculă de azot. Trei orbitali conțin câte un electron fiecare; acești orbitali sunt asociați cu hidrogen; al patrulea AO conține o pereche de electroni, care determină unicitatea moleculei de amoniac.
MECANISME DE FORMARE LEGĂTURĂ COVALENTE.
MBC permite să distingem trei mecanisme de formare a legăturilor covalente: schimb, donor-acceptor și dativ.
Mecanism de schimb. Include acele cazuri de formare a unei legături chimice când fiecare dintre cei doi atomi legați alocă un electron pentru partajare, ca și cum i-ar schimba. Pentru a lega nucleele a doi atomi, electronii trebuie să fie în spațiul dintre nuclee. Această regiune din moleculă se numește regiune de legare (regiunea în care o pereche de electroni este cel mai probabil să locuiască în moleculă). Pentru ca schimbul de electroni neperechi între atomi să aibă loc, orbitalii atomici trebuie să se suprapună (Fig. 10,11). Aceasta este acțiunea mecanismului de schimb pentru formarea unei legături chimice covalente. Orbitii atomici se pot suprapune numai dacă au aceleași proprietăți de simetrie față de axa internucleară (Fig. 10, 11, 22).

Orez. 22. Suprapunerea AO, care nu duce la formarea unei legături chimice.
Mecanisme donator-acceptator și dativ.
Mecanismul donor-acceptor implică transferul unei perechi singure de electroni de la un atom la un orbital atomic liber al altui atom. De exemplu, formarea ionului -:

P-AO vacant din atomul de bor din molecula BF 3 acceptă o pereche de electroni de la ionul de fluor (donator). În anionul rezultat, patru legături covalente B-F sunt egale ca lungime și energie. În molecula originală, toate cele trei legături B-F au fost formate prin mecanismul de schimb.
Atomii a căror înveliș exterior este format doar din electroni s sau p pot fi fie donatori, fie acceptori ai unei perechi de electroni singure. Atomii ai căror electroni de valență sunt localizați deasupra d-AO pot acționa simultan atât ca donatori, cât și ca acceptori. Pentru a face distincția între aceste două mecanisme, au fost introduse conceptele de mecanism dativ de formare a legăturilor.
Cel mai simplu exemplu de mecanism dativ este interacțiunea a doi atomi de clor.
Doi atomi de clor dintr-o moleculă de clor formează o legătură covalentă printr-un mecanism de schimb, combinând electronii lor 3p nepereche. În plus, atomul de Cl- 1 transferă o pereche de electroni 3r 5 - AO la atomul de Cl- 2 la 3d-AO vacant, iar atomul de Cl- 2 transferă aceeași pereche de electroni la 3d-AO vacant al atomul de Cl- 1. Fiecare atom îndeplinește simultan funcțiile de acceptor și donor. Acesta este mecanismul dativului. Acțiunea mecanismului dativ crește rezistența legăturii, astfel încât molecula de clor este mai puternică decât molecula de fluor.
CONEXIUNI COMPLEXE.
Conform principiului mecanismului donor-acceptor, se formează o clasă uriașă de compuși chimici complecși - compuși complecși.
Compușii complecși sunt compuși care conțin ioni complecși capabili să existe atât sub formă cristalină, cât și în soluție, incluzând un ion central sau atom asociat cu ioni încărcați negativ sau molecule neutre prin legături covalente formate printr-un mecanism donor-acceptor.
Structura compușilor complecși după Werner.
Compușii complecși constau dintr-o sferă interioară (ion complex) și o sferă exterioară. Legătura dintre ionii sferei interioare are loc printr-un mecanism donor-acceptor. Acceptorii sunt numiți agenți de complexare; aceștia pot fi adesea ioni metalici pozitivi (cu excepția metalelor din grupa IA) având orbitali liberi. Capacitatea de a forma complexe crește pe măsură ce sarcina ionului crește și dimensiunea acestuia scade.
Donorii de perechi de electroni se numesc liganzi sau aditivi. Liganzii sunt molecule neutre sau ioni încărcați negativ. Numărul de liganzi este determinat de numărul de coordonare al agentului de complexare, care este de obicei egal cu de două ori valența ionului de complexare. Liganzii pot fi monodentanti sau polidentanti. Dentanța unui ligand este determinată de numărul de situsuri de coordonare pe care le ocupă ligandul în sfera de coordonare a agentului de complexare. De exemplu, F- este un ligand monodentat, S2O32- este un ligand bidentat. Sarcina sferei interioare este egală cu suma algebrică a sarcinilor ionilor ei constitutivi. Dacă sfera interioară are o sarcină negativă, este un complex anionic; dacă este pozitivă, este un complex cationic. Complexele cationice sunt denumite în rusă cu numele ionului de complexare; în complexele anionice, agentul de complexare este numit în latină cu adăugarea sufixului - la. Legătura dintre sferele exterioare și interioare într-un compus complex este ionică.
Exemplu: K 2 – tetrahidroxozincat de potasiu, complex anionic.
2- - sfera interioara
2K+ - sfera exterioară
Zn 2+ - agent de complexare
OH – - liganzi
numărul de coordonare – 4
legătura dintre sferele exterioare și interioare este ionică:
K2 = 2K + + 2-.
legătura dintre ionul Zn 2+ și grupările hidroxil este covalentă, formată după mecanismul donor-acceptor: OH - donatori, Zn 2+ - acceptor.
Zn 0: … 3d 10 4s 2
Zn 2+ : … 3d 10 4s 0 p 0 d 0

Tipuri de compuși complecși:
1. Compușii de amoniac sunt liganzi ai moleculei de amoniac.
Cl 2 – clorură de cupru (II) tetraamină. Compușii de amoniac sunt produși prin acțiunea amoniacului asupra compușilor care conțin un agent de complexare.
2. Compuși hidroxo - OH - liganzi.
Na – tetrahidroxialuminat de sodiu. Complecșii hidroxo se obțin prin acțiunea excesului de alcali asupra hidroxizilor metalici, care au proprietăți amfotere.
3. Complexele acvatice sunt liganzi ai moleculelor de apă.
Cl 3 – clorură de hexaacvacrom (III). Complexele acvatice se obțin prin reacția sărurilor anhidre cu apa.
4. Complexe acide - liganzi ai anionilor acizi - Cl - , F - , CN - , SO 3 2- , I – , NO 2 – , C 2 O 4 – etc.
K 4 – hexacianoferat de potasiu (II). Preparat prin reacția unui exces dintr-o sare care conține un ligand cu o sare care conține un agent de complexare.
METODA ORBITALOR MOLECULARE.
MBC explică destul de bine formarea și structura multor molecule, dar această metodă nu este universală. De exemplu, metoda legăturii de valență nu oferă o explicație satisfăcătoare pentru existența ionului  , deși la sfârșitul secolului al XIX-lea s-a stabilit existența unui ion de hidrogen molecular destul de puternic
, deși la sfârșitul secolului al XIX-lea s-a stabilit existența unui ion de hidrogen molecular destul de puternic  : Energia de rupere a legăturii aici este de 2,65 eV. Cu toate acestea, nu se poate forma nicio pereche de electroni în acest caz, deoarece compoziția ionului
: Energia de rupere a legăturii aici este de 2,65 eV. Cu toate acestea, nu se poate forma nicio pereche de electroni în acest caz, deoarece compoziția ionului  este inclus doar un electron.
este inclus doar un electron.
Metoda orbitală moleculară (MMO) permite explicarea unui număr de contradicții care nu pot fi explicate folosind metoda legăturii de valență.
Prevederi de bază ale MMO.
Când doi orbitali atomici interacționează, se formează doi orbitali moleculari. În consecință, atunci când orbitalii n-atomi interacționează, se formează orbitali n-moleculari.
Electronii dintr-o moleculă aparțin în mod egal tuturor nucleelor moleculei.
Dintre cei doi orbitali moleculari formați, unul are o energie mai mică decât cel original, acesta este orbitalul molecular de legătură, celălalt are energie mai mare decât originalul, asta orbital molecular antibondant.
MMO-urile folosesc diagrame energetice care nu sunt la scară.
La umplerea subnivelurilor de energie cu electroni, se folosesc aceleași reguli ca și pentru orbitalii atomici:
principiul energiei minime, adică subnivelurile cu energie mai mică sunt umplute mai întâi;
Principiul Pauli: la fiecare subnivel energetic nu pot exista mai mult de doi electroni cu spin antiparalel;
Regula lui Hund: umplerea subnivelurilor de energie are loc în așa fel încât rotația totală să fie maximă.
Multiplicitatea comunicării. Multiplicitatea comunicăriiîn MMO este determinată de formula:
 , când K p = 0, nu se formează nicio legătură.
, când K p = 0, nu se formează nicio legătură.
Exemple.
1. Poate exista o moleculă de H2?

Orez. 23. Schema de formare a moleculei de hidrogen H2.
Concluzie: molecula de H2 va exista, deoarece multiplicitatea legăturilor Kp > 0.
2. Poate exista o moleculă He 2?

Orez. 24. Schema formării unei molecule de heliu He 2.
Concluzie: molecula He 2 nu va exista, deoarece multiplicitatea legăturilor Kp = 0.
3. Poate exista o particulă de H 2 +?

Orez. 25. Schema formării unei particule de H 2 +.
Particula H 2 + poate exista, deoarece multiplicitatea legăturilor Kp > 0.
4. Poate exista o moleculă de O2?

Orez. 26. Schema de formare a moleculei de O 2.
Molecula de O 2 există. Din fig. 26 rezultă că molecula de oxigen are doi electroni nepereche. Datorită acestor doi electroni, molecula de oxigen este paramagnetică.
Astfel, metoda orbitală moleculară explică proprietățile magnetice ale moleculelor.
INTERACȚIUNEA INTERMOLECULARĂ.
Toate interacțiunile intermoleculare pot fi împărțite în două grupe: universalȘi specific. Cele universale apar în toate moleculele fără excepție. Aceste interacțiuni sunt adesea numite conexiunea sau forțele van der Waals. Deși aceste forțe sunt slabe (energia nu depășește opt kJ/mol), ele sunt motivul trecerii majorității substanțelor de la starea gazoasă la starea lichidă, adsorbția gazelor pe suprafețele solidelor și alte fenomene. Natura acestor forțe este electrostatică.
Forțele principale de interacțiune:
1). Interacțiunea dipol – dipol (orientare). există între moleculele polare.
Cu cât momentele dipolului sunt mai mari, cu atât distanța dintre molecule este mai mică și cu cât temperatura este mai mică, cu atât interacțiunea orientativă este mai mare. Prin urmare, cu cât energia acestei interacțiuni este mai mare, cu atât temperatura substanței trebuie încălzită pentru ca aceasta să fiarbă.
2). Interacțiune inductivă apare dacă există contact între moleculele polare și nepolare dintr-o substanță. Un dipol este indus într-o moleculă nepolară ca rezultat al interacțiunii cu o moleculă polară.
Cl + - Cl - … Al + Cl - 3
Energia acestei interacțiuni crește odată cu creșterea polarizabilității moleculare, adică a capacității moleculelor de a forma un dipol sub influența unui câmp electric. Energia interacțiunii inductive este semnificativ mai mică decât energia interacțiunii dipol-dipol.
3). Interacțiunea de dispersie- aceasta este interacțiunea moleculelor nepolare datorită dipolilor instantanei care apar din cauza fluctuațiilor densității electronilor în atomi.
Într-o serie de substanțe de același tip, interacțiunea de dispersie crește odată cu creșterea dimensiunilor atomilor care alcătuiesc moleculele acestor substanțe.
4) Forțe de respingere sunt cauzate de interacțiunea norilor de electroni de molecule și apar pe măsură ce se apropie mai departe.
Interacțiunile intermoleculare specifice includ toate tipurile de interacțiuni de natură donor-acceptor, adică asociate cu transferul de electroni de la o moleculă la alta. Legătura intermoleculară formată în acest caz are toate trăsăturile caracteristice unei legături covalente: saturație și direcționalitate.
O legătură chimică formată dintr-un hidrogen polarizat pozitiv care face parte dintr-o grupare sau moleculă polară și un atom electronegativ al altei sau aceleiași molecule se numește legătură de hidrogen. De exemplu, moleculele de apă pot fi reprezentate după cum urmează:

Liniile continue sunt legături polare covalente în interiorul moleculelor de apă între atomii de hidrogen și oxigen; punctele indică legături de hidrogen. Motivul formării legăturilor de hidrogen este că atomii de hidrogen sunt practic lipsiți de învelișuri de electroni: singurii lor electroni sunt deplasați către atomii de oxigen ai moleculelor lor. Acest lucru permite protonilor, spre deosebire de alți cationi, să se apropie de nucleele atomilor de oxigen ai moleculelor învecinate fără a experimenta repulsie din învelișurile de electroni ale atomilor de oxigen.
O legătură de hidrogen este caracterizată printr-o energie de legare de 10 până la 40 kJ/mol. Cu toate acestea, această energie este suficientă pentru a provoca asociere de molecule, acestea. asocierea lor în dimeri sau polimeri, care în unele cazuri există nu numai în stare lichidă a substanței, ci se păstrează și atunci când aceasta trece în vapori.
De exemplu, fluorura de hidrogen în fază gazoasă există sub formă de dimer.

În moleculele organice complexe, există atât legături de hidrogen intermoleculare, cât și legături de hidrogen intramoleculare.

Moleculele cu legături de hidrogen intramoleculare nu pot forma legături de hidrogen intermoleculare. Prin urmare, substanțele cu astfel de legături nu formează asociați, sunt mai volatile și au vâscozități, puncte de topire și de fierbere mai mici decât izomerii lor capabili să formeze legături de hidrogen intermoleculare.
BC Leon este o casă de pariuri online lider pe piața jocurilor de noroc. Compania acordă o atenție deosebită funcționării neîntrerupte a serviciului. Funcționalitatea portalului este, de asemenea, îmbunătățită în mod constant. Pentru confortul utilizatorilor, a fost creată oglinda Leon.
Du-te la oglindă
Ce este o oglindă Leon.
Pentru a obține acces la portalul oficial al lui BC Leon, trebuie să utilizați oglinda. Oglinda de lucru oferă utilizatorului multe avantaje, cum ar fi:
- o gamă diversă de evenimente sportive care au cote mari;
- oferind posibilitatea de a juca în modul Live, vizionarea meciurilor va fi o experiență interesantă;
- material detaliat privind concursurile desfășurate;
- o interfață convenabilă pe care chiar și un utilizator fără experiență o poate înțelege rapid.
Oglinda de lucru este o copie a portalului oficial. Are o funcționalitate identică și o bază de date sincronă. Din acest motiv, informațiile contului dvs. nu se modifică. Dezvoltatorii au oferit capacitatea de a bloca oglinda de lucru; în astfel de cazuri, este furnizat altceva. Aceste copii exacte sunt trimise și controlate de angajații BC Leon. Dacă folosești o oglindă funcțională, poți accesa portalul oficial al BC Leon.
Utilizatorul nu va avea dificultăți în a găsi o oglindă, deoarece lista sa este supusă actualizării. Cu acces închis, vizitatorul site-ului este obligat să instaleze aplicația de telefon mobil Leon pe computer. De asemenea, trebuie să vă schimbați IP-ul într-o altă țară folosind un VPN. Pentru a schimba locația utilizatorului sau a furnizorului, trebuie să utilizați browserul TOP.
Dezvoltatorii au oferit diverse posibilități de utilizare a oglinzii. Pentru a face acest lucru, în partea dreaptă a site-ului există inscripția „Acces la site”; butonul verde „Bypass blocking” permite jucătorului să meargă la submeniu și să adauge un marcaj universal în browser.
Aplicația mobilă oferă, de asemenea, confort utilizatorului. Dacă trebuie să aflați despre noua adresă a oglinzii portalului, puteți apela la numărul gratuit. Canalul @leonbets_official de pe Telegram vă permite să accesați oglinda. Aplicația Leonacsess pentru Windows vă permite să accesați întotdeauna site-ul. Aceste metode permit jucătorului să obțină acces la o oglindă funcțională.
De ce a fost blocat site-ul principal Leon?
Acest lucru se datorează acțiunilor serviciului Roskomnadzor. Acest lucru se datorează lipsei unei licențe pentru a desfășura activități de pariuri. Blue Leon nu a primit licență, astfel încât jucătorul să nu plătească 13% la câștiguri.
Cum să vă înregistrați pe oglinda Leonbets
Înregistrarea pe acest site este mult mai ușoară decât oficial. Utilizatorul nu trebuie să se înregistreze pe două portaluri, ceea ce durează până la două zile. Dacă preferați o oglindă funcțională, atunci această procedură va fi cât se poate de simplă.
Pentru a face acest lucru, utilizatorul va trebui doar să completeze informațiile referitoare la numele complet, contacte. De asemenea, trebuie să decideți asupra monedei, să indicați data nașterii și adresa de domiciliu. De asemenea, trebuie să vă abonați la newsletter. Acest lucru vă va permite să primiți rapid informații de la casele de pariuri. Un utilizator înregistrat are posibilitatea de a avea acces la contul său personal, ceea ce îi permite să parieze pe meciuri și evenimente. Dacă apar dificultăți, puteți contacta asistența tehnică.
Subiectele codificatorului examenului unificat de stat: Legătura chimică covalentă, varietățile și mecanismele de formare ale acesteia. Caracteristicile legăturilor covalente (polaritatea și energia de legătură). Legătură ionică. Conexiune metalica. Legătură de hidrogen
Legături chimice intramoleculare
În primul rând, să ne uităm la legăturile care apar între particulele din molecule. Se numesc astfel de conexiuni intramolecular.
Legătură chimică între atomii elementelor chimice are natură electrostatică și se formează datorită interacțiunea electronilor externi (de valență)., în mai mult sau mai puțin grad deținute de nuclee încărcate pozitiv atomi legați.
Conceptul cheie aici este ELECTRONEGATIVITATE. Acesta este cel care determină tipul de legătură chimică dintre atomi și proprietățile acestei legături.
este capacitatea unui atom de a atrage (reține) extern(valenţă) electroni. Electronegativitatea este determinată de gradul de atracție a electronilor exteriori către nucleu și depinde în primul rând de raza atomului și de sarcina nucleului.
Electronegativitatea este dificil de determinat fără ambiguitate. L. Pauling a întocmit un tabel de electronegativități relative (bazat pe energiile de legătură ale moleculelor diatomice). Cel mai electronegativ element este fluor cu sens 4 .
Este important să rețineți că în diferite surse puteți găsi diferite scale și tabele de valori ale electronegativității. Acest lucru nu ar trebui să fie alarmat, deoarece formarea unei legături chimice joacă un rol atomi și este aproximativ același în orice sistem.
Dacă unul dintre atomii din legătura chimică A:B atrage electronii mai puternic, atunci perechea de electroni se deplasează spre el. Cu atât mai mult diferenta de electronegativitate atomi, cu atât perechea de electroni se deplasează mai mult.
Dacă electronegativitățile atomilor care interacționează sunt egale sau aproximativ egale: EO(A)≈EO(B), atunci perechea de electroni comună nu se deplasează la niciunul dintre atomii: A: B. Această conexiune se numește covalent nepolar.
Dacă electronegativitățile atomilor care interacționează diferă, dar nu foarte mult (diferența de electronegativitate este aproximativ de la 0,4 la 2: 0,4<ΔЭО<2 ), apoi perechea de electroni este deplasată la unul dintre atomi. Această conexiune se numește polar covalent .
Dacă electronegativitățile atomilor care interacționează diferă semnificativ (diferența de electronegativitate este mai mare de 2: ΔEO>2), apoi unul dintre electroni este aproape complet transferat către alt atom, odată cu formarea ionii. Această conexiune se numește ionic.
Tipuri de bază de legături chimice − covalent, ionicȘi metal comunicatii. Să le aruncăm o privire mai atentă.
Legătură chimică covalentă
Legătură covalentă – este o legătură chimică , format din cauza formarea unei perechi de electroni comune A:B . Mai mult, doi atomi suprapune orbitali atomici. O legătură covalentă se formează prin interacțiunea atomilor cu o mică diferență de electronegativitate (de obicei între două nemetale) sau atomi ai unui element.
Proprietățile de bază ale legăturilor covalente
- se concentreze,
- saturabilitate,
- polaritate,
- polarizabilitate.
Aceste proprietăți de legătură influențează proprietățile chimice și fizice ale substanțelor.
Direcția de comunicare caracterizează structura chimică și forma substanțelor. Unghiurile dintre două legături se numesc unghiuri de legătură. De exemplu, într-o moleculă de apă unghiul de legătură H-O-H este 104,45 o, prin urmare molecula de apă este polară, iar într-o moleculă de metan unghiul de legătură H-C-H este 108 o 28′.

Saturabilitatea este capacitatea atomilor de a forma un număr limitat de legături chimice covalente. Numărul de legături pe care le poate forma un atom se numește.
Polaritate legarea are loc datorită distribuției neuniforme a densității electronice între doi atomi cu electronegativitate diferită. Legăturile covalente sunt împărțite în polare și nepolare.
Polarizabilitate conexiunile sunt capacitatea electronilor de legătură de a se deplasa sub influența unui câmp electric extern(în special, câmpul electric al altei particule). Polarizabilitatea depinde de mobilitatea electronilor. Cu cât electronul este mai departe de nucleu, cu atât este mai mobil și, în consecință, molecula este mai polarizabilă.

Legătură chimică covalentă nepolară
Există 2 tipuri de legături covalente - POLARȘi NON-POLARE .
Exemplu . Să luăm în considerare structura moleculei de hidrogen H2. Fiecare atom de hidrogen din nivelul său de energie exterior poartă 1 electron nepereche. Pentru a afișa un atom, folosim structura Lewis - aceasta este o diagramă a structurii nivelului de energie exterior al unui atom, când electronii sunt indicați prin puncte. Modelele de structură a punctelor Lewis sunt destul de utile atunci când lucrați cu elemente din a doua perioadă.
H. + . H = H:H
Astfel, o moleculă de hidrogen are o pereche de electroni comună și o legătură chimică H-H. Această pereche de electroni nu se deplasează la niciunul dintre atomii de hidrogen, deoarece Atomii de hidrogen au aceeași electronegativitate. Această conexiune se numește covalent nepolar .

Legătură covalentă nepolară (simetrică). este o legătură covalentă formată din atomi cu electronegativitate egală (de obicei aceleași nemetale) și, prin urmare, cu o distribuție uniformă a densității electronice între nucleele atomilor.
Momentul dipol al legăturilor nepolare este 0.
Exemple: H2 (H-H), O2 (O=O), S8.
Legătură chimică polară covalentă
Legătură polară covalentă este o legătură covalentă care apare între atomi cu electronegativitate diferită (de obicei, diverse nemetale) și este caracterizată deplasare perechea de electroni partajată la un atom mai electronegativ (polarizare).
Densitatea electronilor este deplasată la atomul mai electronegativ - prin urmare, pe acesta apare o sarcină negativă parțială (δ-), iar pe atomul mai puțin electronegativ apare o sarcină pozitivă parțială (δ+, delta +).
Cu cât diferența de electronegativitate a atomilor este mai mare, cu atât este mai mare polaritate conexiuni și multe altele moment dipol . Forțe de atracție suplimentare acționează între moleculele vecine și sarcinile de semn opus, care crește putere comunicatii.
Polaritatea legăturilor afectează proprietățile fizice și chimice ale compușilor. Mecanismele de reacție și chiar reactivitatea legăturilor învecinate depind de polaritatea legăturii. Polaritatea conexiunii determină adesea polaritatea moleculeiși astfel afectează direct proprietăți fizice precum punctul de fierbere și punctul de topire, solubilitatea în solvenți polari.
Exemple: HCI, C02, NH3.
Mecanisme de formare a legăturilor covalente
Legăturile chimice covalente pot apărea prin două mecanisme:
1. Mecanism de schimb formarea unei legături chimice covalente are loc atunci când fiecare particulă furnizează un electron nepereche pentru a forma o pereche de electroni comună:
A . + . B= A:B
2. Formarea legăturii covalente este un mecanism în care una dintre particule oferă o pereche de electroni singuratică, iar cealaltă particulă oferă un orbital liber pentru această pereche de electroni:
A: + B= A:B

În acest caz, unul dintre atomi oferă o pereche singură de electroni ( donator), iar celălalt atom oferă un orbital vacant pentru acea pereche ( acceptor). Ca urmare a formării ambelor legături, energia electronilor scade, adică. acest lucru este benefic pentru atomi.
O legătură covalentă formată printr-un mecanism donor-acceptor nu este diferitîn proprietăţi din alte legături covalente formate prin mecanismul de schimb. Formarea unei legături covalente prin mecanismul donor-acceptor este tipică pentru atomii fie cu un număr mare de electroni la nivel de energie externă (donatori de electroni), fie, dimpotrivă, cu un număr foarte mic de electroni (acceptori de electroni). Capacitățile de valență ale atomilor sunt discutate mai detaliat în secțiunea corespunzătoare.
O legătură covalentă este formată printr-un mecanism donor-acceptor:
- într-o moleculă monoxid de carbon CO(legatura din molecula este tripla, prin mecanismul de schimb se formeaza 2 legaturi, una prin mecanismul donor-acceptor): C≡O;
- V ion de amoniu NH4+, în ioni amine organice de exemplu, în ionul de metilamoniu CH3-NH2+;
- V compuși complecși, o legătură chimică între atomul central și grupările ligand, de exemplu, în legătura Na de tetrahidroxoaluminat de sodiu între ionii de aluminiu și hidroxid;
- V acid azotic și sărurile sale- nitrați: HNO 3, NaNO 3, în alți compuși de azot;

- într-o moleculă ozon O3.
Caracteristicile de bază ale legăturilor covalente
Legăturile covalente se formează de obicei între atomi nemetalici. Principalele caracteristici ale unei legături covalente sunt lungime, energie, multiplicitate și direcționalitate.
Multiplicitatea legăturii chimice
Multiplicitatea legăturii chimice - Acest numărul de perechi de electroni partajați între doi atomi dintr-un compus. Multiplicitatea unei legături poate fi determinată destul de ușor din valorile atomilor care formează molecula.
De exemplu , în molecula de hidrogen H 2 multiplicitatea legăturilor este 1, deoarece Fiecare hidrogen are doar 1 electron nepereche în nivelul său de energie exterior, prin urmare se formează o pereche de electroni comună.
În molecula de oxigen O 2, multiplicitatea legăturilor este 2, deoarece Fiecare atom de la nivelul energetic exterior are 2 electroni nepereche: O=O.
În molecula de azot N2, multiplicitatea legăturilor este 3, deoarece între fiecare atom există 3 electroni nepereche la nivelul energetic exterior, iar atomii formează 3 perechi de electroni comuni N≡N.
Lungimea legăturii covalente
Lungimea legăturii chimice
este distanța dintre centrele nucleelor atomilor care formează legătura. Se determină prin metode fizice experimentale. Lungimea legăturii poate fi estimată aproximativ folosind regula aditivității, conform căreia lungimea legăturii în molecula AB este aproximativ egală cu jumătate din suma lungimilor legăturilor din moleculele A 2 și B 2: 
Lungimea unei legături chimice poate fi estimată aproximativ prin razele atomice formând o legătură, sau prin multiplicitatea comunicării, dacă razele atomilor nu sunt foarte diferite.
Pe măsură ce razele atomilor care formează o legătură cresc, lungimea legăturii va crește.
De exemplu
Pe măsură ce multiplicitatea legăturilor dintre atomi crește (ale căror raze atomice nu diferă sau diferă doar puțin), lungimea legăturii va scădea.
De exemplu . În seria: C–C, C=C, C≡C, lungimea legăturii scade.
Energia de comunicare
O măsură a puterii unei legături chimice este energia legăturii. Energia de comunicare determinată de energia necesară pentru a rupe o legătură și a îndepărta atomii care formează acea legătură la o distanță infinit de mare unul de celălalt.
O legătură covalentă este foarte rezistent. Energia sa variază de la câteva zeci la câteva sute de kJ/mol. Cu cât energia de legătură este mai mare, cu atât puterea de legătură este mai mare și invers.
Forța unei legături chimice depinde de lungimea legăturii, de polaritatea legăturii și de multiplicitatea legăturii. Cu cât o legătură chimică este mai lungă, cu atât se rupe mai ușor și cu cât energia legăturii este mai mică, cu atât rezistența acesteia este mai mică. Cu cât legătura chimică este mai scurtă, cu atât este mai puternică și energia de legătură este mai mare.
De exemplu, în seria de compuși HF, HCl, HBr de la stânga la dreapta, puterea legăturii chimice scade, deoarece Lungimea conexiunii crește.
Legătură chimică ionică

Legătură ionică este o legătură chimică bazată pe atracția electrostatică a ionilor.
Ioni se formează în procesul de acceptare sau donare de electroni de către atomi. De exemplu, atomii tuturor metalelor rețin slab electronii de la nivelul de energie exterior. Prin urmare, atomii de metal se caracterizează prin proprietăți de restaurare- capacitatea de a dona electroni.

Exemplu. Atomul de sodiu conține 1 electron la nivelul energetic 3. Renunțând cu ușurință la el, atomul de sodiu formează ionul Na + mult mai stabil, cu configurația electronică a gazului nobil neon Ne. Ionul de sodiu conține 11 protoni și doar 10 electroni, deci sarcina totală a ionului este -10+11 = +1:
+11N / A) 2 ) 8 ) 1 - 1e = +11 N / A +) 2 ) 8
Exemplu. Un atom de clor în nivelul său exterior de energie conține 7 electroni. Pentru a obține configurația unui atom de argon inert stabil Ar, clorul trebuie să câștige 1 electron. După adăugarea unui electron, se formează un ion de clor stabil, format din electroni. Sarcina totală a ionului este -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Notă:
- Proprietățile ionilor sunt diferite de proprietățile atomilor!
- Ioni stabili se pot forma nu numai atomi, dar de asemenea grupuri de atomi. De exemplu: ion de amoniu NH 4 +, ion sulfat SO 4 2- etc. Legăturile chimice formate de astfel de ioni sunt de asemenea considerate ionice;
- Legăturile ionice se formează de obicei între ele metaleȘi nemetale(grupe nemetalice);
Ionii rezultați sunt atrași datorită atracției electrice: Na + Cl -, Na 2 + SO 4 2-.
Să rezumam vizual diferența dintre tipurile de legături covalente și ionice:


Conexiune metalica este o legătură care se formează relativ electroni liberiîntre ionii metalici, formând o rețea cristalină.
Atomii de metal sunt de obicei localizați la nivelul energetic exterior unul până la trei electroni. Razele atomilor de metal, de regulă, sunt mari - prin urmare, atomii de metal, spre deosebire de nemetale, renunță destul de ușor la electronii lor exteriori, adică. sunt agenți reducători puternici.
Donând electroni, atomii de metal se transformă în ioni încărcați pozitiv . Electronii detașați sunt relativ liberi se miscaîntre ionii metalici încărcați pozitiv. Între aceste particule apare o conexiune, deoarece electronii în comun dețin cationi metalici aranjați în straturi împreună , creând astfel un destul de puternic rețea cristalină metalică . În acest caz, electronii se mișcă continuu haotic, adică. Apar în mod constant noi atomi neutri și noi cationi.

Interacțiuni intermoleculare
Separat, merită luate în considerare interacțiunile care apar între moleculele individuale dintr-o substanță - interacțiuni intermoleculare . Interacțiunile intermoleculare sunt un tip de interacțiune între atomi neutri în care nu apar noi legături covalente. Forțele de interacțiune dintre molecule au fost descoperite de Van der Waals în 1869 și au fost numite după el. Forțele Van dar Waals. Forțele Van der Waals sunt împărțite în orientare, inducţie Și dispersiv . Energia interacțiunilor intermoleculare este mult mai mică decât energia legăturilor chimice.
Forțele de orientare ale atracției apar între moleculele polare (interacțiunea dipol-dipol). Aceste forțe apar între moleculele polare. Interacțiuni inductive este interacțiunea dintre o moleculă polară și una nepolară. O moleculă nepolară este polarizată datorită acțiunii uneia polare, care generează atracție electrostatică suplimentară.
Un tip special de interacțiune intermoleculară sunt legăturile de hidrogen. - acestea sunt legături chimice intermoleculare (sau intramoleculare) care apar între molecule care au legături covalente foarte polare - H-F, H-O sau H-N. Dacă există astfel de legături într-o moleculă, atunci între molecule vor exista forțe de atracție suplimentare .
Mecanismul educației legăturile de hidrogen sunt parțial electrostatice și parțial donor-acceptor. În acest caz, donorul perechii de electroni este un atom al unui element puternic electronegativ (F, O, N), iar acceptorul sunt atomii de hidrogen conectați la acești atomi. Legăturile de hidrogen se caracterizează prin se concentreze în spaţiu şi saturare
Legăturile de hidrogen pot fi indicate prin puncte: H ··· O. Cu cât electronegativitatea atomului conectat la hidrogen este mai mare și cu cât dimensiunea acestuia este mai mică, cu atât legătura de hidrogen este mai puternică. Este tipic în primul rând pentru conexiuni fluor cu hidrogen , precum și să oxigen si hidrogen , Mai puțin azot cu hidrogen .

Legăturile de hidrogen apar între următoarele substanțe:
— fluorură de hidrogen HF(gaz, soluție de acid fluorhidric în apă - acid fluorhidric), apă H2O (abur, gheață, apă lichidă):
— soluție de amoniac și amine organice- intre amoniac si moleculele de apa;
— compuși organici în care se leagă O-H sau N-H: alcooli, acizi carboxilici, amine, aminoacizi, fenoli, anilina si derivatii ei, proteine, solutii de carbohidrati - monozaharide si dizaharide.
Legăturile de hidrogen afectează proprietățile fizice și chimice ale substanțelor. Astfel, atracția suplimentară între molecule face dificilă fierberea substanțelor. Substanțele cu legături de hidrogen prezintă o creștere anormală a punctului de fierbere.
De exemplu De regulă, odată cu creșterea greutății moleculare, se observă o creștere a punctului de fierbere al substanțelor. Cu toate acestea, într-o serie de substanțe H2O-H2S-H2Se-H2Te nu observăm o modificare liniară a punctelor de fierbere.

Și anume, la punctul de fierbere al apei este anormal de ridicat - nu mai puțin de -61 o C, după cum ne arată linia dreaptă, dar mult mai mult, +100 o C. Această anomalie se explică prin prezența legăturilor de hidrogen între moleculele de apă. Prin urmare, în condiții normale (0-20 o C) apa este lichid după starea de fază.