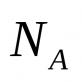Dobivanje fenola. Struktura, svojstva i primjena fenola. Dobivanje fenola: glavne metode Fenol se koristi kao sirovina za dobijanje
Kako doći/>.
1 . Dobivanje iz halobenzena. Kada se hlorobenzen i natrijum hidroksid zagreju pod pritiskom, dobija se natrijum fenolat čijim se daljim tretmanom kiselinom nastaje fenol:
C 6 H 5 - SA l + 2 NaOH → C 6 H 5 - ONa + NaCl + H 2 O.
2. Tokom katalitičke oksidacije izopropilbenzena (kumena) sa atmosferskim kiseonikom nastaju fenol i aceton:
(1)
Ovo je glavna industrijska metoda za proizvodnju fenola.
3. Dobivanje iz aromatičnih sulfonskih kiselina. Reakcija se izvodi spajanjem sulfonskih kiselina sa alkalijama. Početno formirani fenoksidi se tretiraju jakim kiselinama kako bi se dobili slobodni fenoli. Metoda se obično koristi za dobivanje polihidričnih fenola:

Hemijska svojstva/>. U fenolima str - orbitala atoma kiseonika čini jednu jedinicu sa aromatičnim prstenom str -sistem. Zbog ove interakcije, elektronska gustina na atomu kiseonika opada, au benzenskom prstenu raste. Povećava se polaritet O-H veze, a vodik OH grupe postaje reaktivniji i lako se zamjenjuje metalom čak i pod djelovanjem lužina (za razliku od zasićenih monohidričnih alkohola).
1. Kiselost fenola je znatno veća od kiselosti zasićenih alkohola; oba reaguje sa alkalnim metalima:
C 6 H 5 OH + Na → C 6 H 5 ONa + 1/2 H 2,
i sa njihovim hidroksidima (otuda stari naziv "karbolna kiselina"):
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
Međutim, fenol je vrlo slaba kiselina. Prilikom prolaska ugljičnog dioksida ili sumpordioksida kroz otopinu fenolata, oslobađa se fenol; takva reakcija dokazuje da je fenol slabija kiselina od ugljične i sumporne kiseline:
C 6 H 5 ONa + CO 2 + H 2 O → C 6 H 5 OH + NaHC03.
Kisela svojstva fenola su oslabljena uvođenjem supstituenata u prsten I vrste i poboljšane su uvođenjem supstituenata II vrsta.
2. Formiranje estera. Za razliku od alkohola, fenoli ne stvaraju estre kada su izloženi karboksilnim kiselinama; za to se koriste kiseli hloridi:
C 6 H 5 OH + CH 3 - CO - Cl → C 6 H 5 - O - CO - CH 3 + HCl.
3. Reakcije elektrofilne supstitucije u fenolu se odvijaju mnogo lakše nego u aromatičnim ugljovodonicima. Budući da je OH grupa orijentacija tipa I, povećava se reaktivnost benzenskog prstena na orto i para pozicijama u molekulu fenola (tokom halogenacije, nitriranja, polikondenzacije itd.). Dakle, pod djelovanjem bromne vode na fenol, tri atoma vodika zamjenjuju se bromom i formira se talog 2,4,6-tribromofenola:
 (2)
(2)
Ovo je kvalitativna reakcija na fenol.
Kada se fenol nitrira koncentriranom dušičnom kiselinom, tri atoma vodika zamjenjuju se nitro grupom i nastaje 2,4,6-trinitrofenol (pikrinska kiselina):

Kada se fenol zagrije s formaldehidom u prisustvu kiselih ili baznih katalizatora, dolazi do polikondenzacijske reakcije i formira se fenol-formaldehidna smola - visokomolekularno jedinjenje s razgranatom strukturom tipa:

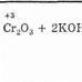
4. Oksidacija. Fenoli se lako oksidiraju čak i pod djelovanjem atmosferskog kisika. Dakle, kada stoji na zraku, fenol postepeno prelazi u ružičasto-crvenu boju. U snažnoj oksidaciji fenola sa smjesom hroma, kinon je glavni proizvod oksidacije. Dihidrični fenoli se još lakše oksidiraju. Kada se hidrokinon oksidira, nastaje i kinon:
 (3)
(3)
U zaključku, napominjemo da se fenol često identificira po njegovoj reakciji s otopinom FeCl3 ; u ovom slučaju nastaje ljubičasti kompleksni jon. Uz reakciju (2), ovo je kvalitativna reakcija za detekciju fenola.
Aplikacija . Fenol se koristi kao međuprodukt u proizvodnji fenol-formaldehidnih smola, sintetičkih vlakana, boja, lijekova i mnogih drugih vrijednih supstanci. Pikrinska kiselina se u industriji koristi kao eksploziv. Krezoli se koriste kao supstance sa jakim dezinfekcionim dejstvom./>
Fenol je bezbojna kristalna supstanca vrlo specifičnog mirisa. Ova tvar se široko koristi u proizvodnji raznih boja, plastike, raznih sintetičkih vlakana (uglavnom najlona). Prije razvoja petrohemijske industrije, proizvodnja fenola se odvijala isključivo od katrana ugljena. Naravno, ova metoda nije bila u stanju da pokrije sve potrebe industrije u brzom razvoju za fenolom, koji je danas postao važna komponenta gotovo svih objekata oko nas.
U procesu sinteze koristi se fenol, čija je proizvodnja postala hitna potreba zbog pojave izuzetno širokog spektra novih materijala i supstanci, čiji je sastavni sastojak. komponenta fenola. Također, velika količina fenola se prerađuje u cikloheksanol, koji je neophodan za proizvodnju u industrijskim razmjerima.

Još jedno važno područje je proizvodnja mješavine kreosola, koja se sintetizira u kreosol formaldehidnu smolu koja se koristi za proizvodnju mnogih lijekova, antiseptika i antioksidansa. Stoga je danas proizvodnja fenola u velikim količinama važan zadatak petrohemije. Već su razvijene mnoge metode za proizvodnju ove supstance u dovoljnim količinama. Hajde da se zadržimo na glavnim.
Najstarija i najprovjerenija metoda je alkalna metoda topljenja, koja se odlikuje velikom potrošnjom sumporne kiseline za i kaustiku, nakon čega slijedi njihovo spajanje u benzensulfonatrijum iz koje se ova tvar direktno odvaja. Dobivanje fenola metodom hloriranja benzena uz saponifikaciju hlorobenzena isplativo je samo ako je potrebna velika količina jeftine električne energije za proizvodnju kaustika i hlora. Glavni nedostaci ove tehnike su potreba za stvaranjem visokog pritiska (najmanje tri stotine atmosfera) i izuzetno značajan stepen korozije opreme.

Modernija metoda je dobivanje fenola razgradnjom izopropilbenzen hidroperoksida. Istina, shema za izolaciju potrebne tvari ovdje je prilično složena, jer uključuje preliminarnu proizvodnju hidroperoksida metodom alkilacije benzena otopinom propilena. Nadalje, tehnologija predviđa oksidaciju rezultirajućeg izopropilbenzena s mješavinom zraka kako bi se formirao hidroperoksid. Kao pozitivan faktor ove tehnike može se navesti stvaranje još jedne važne supstance, acetona, paralelno sa fenolom.
Postoji i metoda za izolaciju fenola iz koksa i polukoksnih katrana čvrstih goriva. Takav postupak je neophodan ne samo za dobivanje vrijednog fenola, već i za poboljšanje kvalitete različitih ugljikovodičnih proizvoda. Jedno od svojstava fenola je brza oksidacija, što dovodi do ubrzanog starenja ulja i stvaranja viskoznih smolastih frakcija u njemu.
Ali najmodernija metoda i najnovije dostignuće petrohemijske industrije je dobijanje fenola iz benzena direktnom oksidacijom.Ceo proces se odvija u posebnom adijabatskom reaktoru, koji sadrži katalizator koji sadrži zeolit. Originalni azot oksid se dobija oksidacijom amonijaka vazduhom ili odvajanjem od, tačnije, njegovih nusproizvoda koji nastaju tokom sinteze. Ova tehnologija je u stanju da proizvede fenol visoke čistoće sa minimalnim ukupnim sadržajem nečistoća.
Opis prezentacije na pojedinačnim slajdovima:
1 slajd
Opis slajda:
2 slajd
Opis slajda:
Svrha: Opisati fizička i hemijska svojstva fenola. Prikazati negativnu i pozitivnu ulogu fenola i njegovih derivata u prirodi i životu ljudi
3 slajd
Opis slajda:
Fenol (oksibenzen, zastarjela karbolna kiselina) C6H5OH je najjednostavniji predstavnik klase fenola. Kristalna, bezbojna supstanca sa karakterističnim mirisom. Lako oksidira na zraku, prvo postaje ružičasta, a zatim smeđa. Igličasti kristali fenola
4 slajd
Opis slajda:
Klasifikacija fenola Postoje jedno-, dvo-, troatomni fenoli u zavisnosti od broja OH grupa u molekulu:
5 slajd
Opis slajda:
Priprema kumonske metode za proizvodnju fenola (SSSR, Sergeev P.G., Udris R.Yu., Kružhalov B.D., 1949). Prednosti metode: neotpadna tehnologija (prinos korisnih proizvoda > 99%) i ekonomičnost. Fuzija soli aromatičnih sulfonskih kiselina sa čvrstim alkalijama: C6H5-SO3Na + NaOH t → Na2SO3 + C6H5 - OH Iz katrana ugljena: C6H5ONa + H2SO4 (dif) → C6H5 - OH + NaHSO4 OH+NaCl
6 slajd
Opis slajda:
Fizička svojstva Rastvorljiv u vodi (6 g na 100 g vode), u alkalnim rastvorima, u alkoholu, u benzenu, u acetonu. Fenol je izuzetno toksičan i opasan za ljudski organizam.
7 slajd
Opis slajda:
Elektronska struktura Hidroksilna grupa -OH je supstituent prve vrste, odnosno doprinosi povećanju elektronske gustine u benzenskom prstenu (posebno u orto i para pozicijama). To je zbog činjenice da jedan od usamljenih parova elektrona atoma kisika OH grupe ulazi u konjugaciju s π-sistemom benzenskog prstena. Pomicanje usamljenog para elektrona atoma kisika prema benzenskom prstenu dovodi do povećanja polariteta O-H veze.
8 slajd
Opis slajda:
Hemijska svojstva Interakcija sa metalnim natrijumom: 2C6H5OH + 2Na 2C6H5ONa + H2 Poseduje svojstva slabe kiseline, formira soli - fenolate pod dejstvom alkalija (na primer, natrijum fenolat - C6H5ONa): C6H5OH + NaOH C6H5ONaqua (reakcija sa brominom vodom + H2O) na fenol) : C6H5OH + 3Br2 C6H2Br3OH + 3HBr (formirajući bijelu čvrstu supstancu 2,4,6-tribromofenol) Reakcija sa koncentrovanom azotnom kiselinom: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (formiranje 2,4,6-trianitrophenol)-tria hlorid željeza(III) (kvalitativne reakcije za fenol): 6C6H5OH + FeCl3 Cl3
9 slajd
Opis slajda:
Biološka uloga Eterična ulja (imaju jaka baktericidna i antivirusna svojstva, stimulišu imuni sistem, povećavaju krvni pritisak: - anetol u kopru, komoraču, anisu - karvakrol i timol u timijanu - eugenol u karanfilićima, bosiljak Flavonoidi (pomažu u uklanjanju radioaktivnih elemenata iz organizma ) Ljekoviti preparati (purgen, paracetamol) Antiseptici (3-5% rastvor - karbolna kiselina) Fenol je jedan od industrijskih zagađivača Fenol je prilično toksičan za životinje i ljude Fenol je štetan za mnoge mikroorganizme, pa stoga industrijske otpadne vode sa visokim sadržajem fenola teško se biološki tretira.
10 slajd
Opis slajda:
Toksična svojstva Odnosi se na veoma opasne supstance (klasa opasnosti II). Kada se udiše, uzrokuje oštećenje funkcija nervnog sistema. Prašina, pare i rastvor fenola iritiraju sluzokožu očiju, respiratornog trakta, kože, izazivajući hemijske opekotine. Došavši na kožu, fenol se vrlo brzo apsorbira čak i kroz netaknuta područja i nakon nekoliko minuta počinje djelovati na moždano tkivo.
11 slajd
Opis slajda:
Toksična svojstva Najprije dolazi do kratkotrajne ekscitacije, a zatim do paralize respiratornog centra. Čak i kada su izloženi minimalnim dozama fenola, primećuju se kihanje, kašalj, glavobolja, vrtoglavica, bledilo, mučnina i gubitak snage. Teže slučajeve trovanja karakteriziraju nesvjestica, cijanoza, otežano disanje, neosjetljivost rožnjače, ubrzan, jedva primjetan puls, hladan znoj, često i konvulzije.
12 slajd
Opis slajda:
Utjecaj na tijelo Kada otopina fenola dospije na kožu, odmah se pojavljuju teške hemijske opekotine koje se pretvaraju u čireve. Ako je četvrtina cijele površine tijela izgorjela izlaganjem fenolu, tada je vjerovatnoća smrti blizu 100%. Unošenje neke supstance u organizam kroz gastrointestinalni trakt doprinosi otežanom kretanju, može izazvati krvarenje, čir. Smrtonosna doza za ljude kada se proguta je 1-10 g, za djecu 0,05-0,5 g. Uprkos brzom eliminaciji iz organizma (samo jedan dan), fenol može uzrokovati nepopravljivu štetu, a liječenje može trajati nekoliko godina. Najteže posljedice su razvoj raka, neplodnost, srčani problemi.
1. Fenoli- derivati aromatičnih ugljovodonika, u čijim molekulima je hidroksilna grupa (-OH) direktno vezana za atome ugljenika u benzenskom prstenu.
2. Klasifikacija fenola
Postoje jedno-, dvo-, troatomni fenoli u zavisnosti od broja OH grupa u molekulu:
U skladu sa brojem spojenih aromatskih ciklusa u molekuli razlikuju se sami fenoli (jedan aromatski prsten - derivati benzena), naftoli (2 spojena prstena - derivati naftalena), antranoli (3 spojena prstena - derivati antracena) i fenantroli:
3. Izomerizam i nomenklatura fenola
Postoje 2 vrste izomerizma:
- izomerizam položaja supstituenata u benzenskom prstenu
- izomerizam bočnog lanca (struktura alkil radikala i broj radikala)
Za fenole se široko koriste trivijalni nazivi koji su se istorijski razvili. Prefiksi se također koriste u nazivima supstituiranih mononuklearnih fenola orto-,meta- i par -, koristi se u nomenklaturi aromatičnih jedinjenja. Za složenije spojeve, atomi koji čine aromatične prstenove su numerisani, a položaj supstituenata je naznačen pomoću digitalnih indeksa.
4. Struktura molekula
Fenil grupa C 6 H 5 - i hidroksil -OH međusobno utiču jedna na drugu
- usamljeni elektronski par atoma kiseonika je privučen oblakom od 6 elektrona benzenskog prstena, zbog čega je O–H veza još više polarizovana. Fenol je jača kiselina od vode i alkohola.
- U benzenskom prstenu narušena je simetrija elektronskog oblaka, povećava se elektronska gustina na pozicijama 2, 4, 6. To čini reaktivnijima C-H veze na pozicijama 2, 4, 6. i - veze benzenskog prstena.
5. Fizička svojstva
Većina monohidričnih fenola u normalnim uslovima su bezbojne kristalne supstance niske tačke topljenja i karakterističnog mirisa. Fenoli su slabo rastvorljivi u vodi, lako rastvorljivi u organskim rastvaračima, toksični i postepeno tamne kada se skladište na vazduhu kao rezultat oksidacije.
Fenol C 6 H 5 OH (karbolna kiselina ) - bezbojna kristalna tvar oksidira na zraku i postaje ružičasta, na uobičajenim temperaturama slabo je rastvorljiva u vodi, iznad 66 °C miješa se s vodom u bilo kojem omjeru. Fenol je toksična supstanca, izaziva opekotine kože, antiseptik je.
6. Toksična svojstva
Fenol je otrovan. Izaziva disfunkciju nervnog sistema. Prašina, pare i rastvor fenola iritiraju sluzokožu očiju, respiratornog trakta i kože. Jednom u tijelu, fenol se vrlo brzo apsorbira čak i kroz netaknute dijelove kože i nakon nekoliko minuta počinje djelovati na moždano tkivo. Prvo dolazi do kratkotrajne ekscitacije, a zatim do paralize respiratornog centra. Čak i kada su izloženi minimalnim dozama fenola, primećuju se kihanje, kašalj, glavobolja, vrtoglavica, bledilo, mučnina i gubitak snage. Teže slučajeve trovanja karakteriziraju nesvjestica, cijanoza, kratak dah, neosjetljivost rožnjače, ubrzan, jedva primjetan puls, hladan znoj, često i konvulzije. Često je fenol uzrok raka.
7. Primjena fenola
1. Proizvodnja sintetičkih smola, plastike, poliamida
2. Lijekovi
3. Boje
4. Surfaktanti
5. Antioksidansi
6. Antiseptici
7. Eksplozivi
8. Dobijanje fenola v industrija
jedan). Metoda kumena za proizvodnju fenola (SSSR, Sergeev P.G., Udris R.Yu., Kružalov B.D., 1949). Prednosti metode: neotpadna tehnologija (prinos korisnih proizvoda > 99%) i ekonomičnost. Trenutno se metoda kumena koristi kao glavna u svjetskoj proizvodnji fenola.

2). Od katrana ugljena (kao nusproizvod - nizak prinos):
C 6 H 5 ONa + H 2 SO 4 (razb) → C 6 H 5 - OH + NaHSO 4
natrijum fenolat
(slika proizvodačizme od smolekausticna soda)
3). Od halobenzena :
Od 6 H 5 -Cl + NaOH t , str→ C 6 H 5 - OH + NaCl
4). Fuzija soli aromatičnih sulfonskih kiselina sa čvrstim alkalijama :
C 6 H 5 -SO 3 Na + NaOH t → Na 2 SO 3 + C 6 H 5 - OH
natrijumove soli
benzensulfonske kiseline
9. Hemijska svojstva fenola (karbolne kiseline)
I . Osobine hidroksilne grupe
Svojstva kiselina- izraženije su od zasićenih alkohola (boja indikatora se ne mijenja):
- sa aktivnim metalima-
2C 6 H 5 -OH + 2Na → 2C 6 H 5 -ONa + H 2
natrijum fenolat
- Sa alkalijama-
C 6 H 5 -OH + NaOH (vodeni rastvor)↔ C 6 H 5 -ONa + H 2 O
! Fenolati - soli slabe karbonske kiseline, razložene ugljičnom kiselinom -
C 6 H 5 -ONa + H 2 O +WITHO 2 → C 6 H 5 -OH + NaHCO 3
U pogledu kiselih svojstava, fenol je 10 puta bolji od etanola. Istovremeno, za istu količinu je inferioran sirćetnoj kiselini. Za razliku od karboksilnih kiselina, fenol ne može istisnuti ugljičnu kiselinu iz njenih soli.
C 6 H 5 - Oh + NaHCO 3 = reakcija ne ide - budući da je savršeno rastvorljiv u vodenim rastvorima alkalija, zapravo se ne otapa u vodenom rastvoru natrijum bikarbonata.
Kisela svojstva fenola su poboljšana pod uticajem grupa koje povlače elektrone povezane sa benzenskim prstenom ( NO 2 - , Br - )
2,4,6-trinitrofenol ili pikrinska kiselina jača je od ugljene
II . Svojstva benzenskog prstena
1). Međusobni utjecaj atoma u molekulu fenola očituje se ne samo u ponašanju hidroksi grupe (vidi gore), već i u većoj reaktivnosti benzenskog prstena. Hidroksilna grupa povećava gustinu elektrona u benzenskom prstenu, posebno u orto- i par- odredbe (+ M-efekat OH-grupe):
Stoga je fenol mnogo aktivniji od benzena u reakcijama elektrofilne supstitucije u aromatičnom prstenu.
- Nitracija. Pod dejstvom 20% azotne kiseline HNO 3, fenol se lako pretvara u smešu orto- i par- nitrofenoli:
Pri upotrebi koncentriranog HNO 3 nastaje 2,4,6-trinitrofenol ( pikrinska kiselina):
- Halogenacija. Fenol lako stupa u interakciju s bromnom vodom na sobnoj temperaturi i formira bijeli talog 2,4,6-tribromofenola (kvalitativne reakcije za fenol):
- Kondenzacija sa aldehidima. Na primjer:
2). Hidrogenacija fenola
C 6 H 5 -OH + 3H 2 Ni, 170ºC→ C 6 H 11 - OH cikloheksil alkohol (cikloheksanol)
Na bazi benzena. U normalnim uslovima, to su čvrste otrovne supstance sa specifičnom aromom. U modernoj industriji ova hemijska jedinjenja igraju važnu ulogu. U smislu upotrebe, fenol i njegovi derivati su među dvadeset najtraženijih hemijskih jedinjenja u svetu. Široko se koriste u hemijskoj i lakoj industriji, farmaciji i energetici. Stoga je proizvodnja fenola u industrijskim razmjerima jedan od glavnih zadataka kemijske industrije.
Oznake fenola
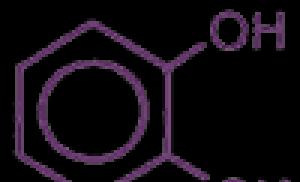
Originalni naziv fenola je karbolna kiselina. Kasnije je ovo jedinjenje naučilo naziv "fenol". Formula ove supstance prikazana je na slici:
Atomi fenola su numerisani počevši od atoma ugljika koji je vezan za OH hidrokso grupu. Niz se nastavlja takvim redoslijedom da ostali supstituirani atomi dobiju najmanje brojeve. Derivati fenola postoje kao tri elementa čije karakteristike se objašnjavaju razlikom u njihovim strukturnim izomerima. Različiti orto-, meta-, parakrezoli su samo modifikacije osnovne strukture spoja benzenskog prstena i hidroksilne grupe čija je osnovna kombinacija fenol. Formula ove supstance u hemijskom zapisu izgleda kao C 6 H 5 OH.
Fizička svojstva fenola
Vizualno, fenol je čvrsti bezbojni kristali. Na otvorenom oksidiraju, dajući tvari karakterističnu ružičastu nijansu. U normalnim uvjetima, fenol je prilično slabo rastvorljiv u vodi, ali s povećanjem temperature na 70 ° C, ova brojka se naglo povećava. U alkalnim otopinama, ova tvar je rastvorljiva u bilo kojoj količini i na bilo kojoj temperaturi.

Ova svojstva su sačuvana i u drugim jedinjenjima, čija su glavna komponenta fenoli.
Hemijska svojstva
Jedinstvena svojstva fenola se objašnjavaju njegovom unutrašnjom strukturom. U molekulu ove hemikalije, p-orbitala kiseonika formira jedan p-sistem sa benzenskim prstenom. Ova čvrsta interakcija povećava gustinu elektrona aromatičnog prstena i snižava gustinu atoma kiseonika. U ovom slučaju, polaritet veza hidrokso grupe značajno se povećava, a vodik u njegovom sastavu lako se zamjenjuje bilo kojim alkalnim metalom. Tako nastaju različiti fenolati. Ova jedinjenja se ne razlažu sa vodom, kao alkoholati, ali su njihovi rastvori veoma slični solima jakih baza i slabih kiselina, pa imaju prilično izraženu alkalnu reakciju. Fenolati stupaju u interakciju s različitim kiselinama, kao rezultat reakcije, fenoli se smanjuju. Hemijska svojstva ovog jedinjenja omogućavaju mu interakciju sa kiselinama, formirajući tako estre. Na primjer, interakcija fenola i octene kiseline dovodi do stvaranja fenil estera (feniacetata).

Nadaleko je poznata reakcija nitriranja u kojoj, pod utjecajem 20% dušične kiseline, fenol stvara smjesu para- i ortonitrofenola. Ako se fenol tretira koncentriranom dušičnom kiselinom, dobiva se 2,4,6-trinitrofenol, koji se ponekad naziva pikrinska kiselina.

Fenol u prirodi
Kao samostalna tvar, fenol se u prirodi nalazi u katranu uglja i u određenim vrstama ulja. Ali za industrijske potrebe ovaj iznos ne igra nikakvu ulogu. Stoga je umjetno dobivanje fenola postalo prioritet mnogih generacija naučnika. Na sreću, ovaj problem je rešen i kao rezultat je dobijen veštački fenol.
svojstva, dobijanje
Upotreba različitih halogena omogućava dobijanje fenolata iz kojih se u daljoj preradi formira benzen. Na primjer, zagrijavanjem natrijevog hidroksida i klorobenzena nastaje natrijum fenolat, koji se razlaže na sol, vodu i fenol kada je izložen kiselini. Formula za ovu reakciju je data ovdje:
C 6 H 5 -CI + 2NaOH -> C 6 H 5 -ONa + NaCl + H 2 O
Aromatične sulfonske kiseline su također izvor za proizvodnju benzena. Hemijska reakcija se odvija uz istodobno otapanje alkalije i sulfonske kiseline. Kao što se može vidjeti iz reakcije, prvo nastaju fenoksidi. Kada se tretiraju jakim kiselinama, redukuju se u polihidrične fenole.
Fenol u industriji
U teoriji, dobivanje fenola na najjednostavniji i najperspektivniji način izgleda ovako: pomoću katalizatora, benzen se oksidira kisikom. Ali do sada, katalizator za ovu reakciju nije pronađen. Stoga se u industriji trenutno koriste druge metode.
Kontinuirana industrijska metoda za proizvodnju fenola sastoji se od interakcije hlorobenzena i 7% rastvora natrijum hidroksida. Dobijena smeša se propušta kroz kilometar i po sistem cevi zagrejanih na temperaturu od 300 C. Pod uticajem temperature i održavanog visokog pritiska, polazni materijali reaguju da bi se dobio 2,4-dinitrofenol i drugi proizvodi.

Ne tako davno razvijena je industrijska metoda za dobivanje tvari koje sadrže fenol metodom kumena. Ovaj proces se sastoji od dvije faze. Prvo, izopropilbenzol (kumen) se dobija iz benzena. Da bi se to postiglo, benzen se alkiluje propilenom. Reakcija izgleda ovako:

Nakon toga, kumen se oksidira kisikom. Izlaz druge reakcije je fenol i još jedan važan proizvod, aceton.
Iz toluena je moguća proizvodnja fenola u industrijskim razmjerima. Da bi se to postiglo, toluen se oksidira na kisiku sadržanom u zraku. Reakcija se odvija u prisustvu katalizatora.
Primjeri fenola
Najbliži homolozi fenola nazivaju se krezoli.

Postoje tri vrste krezola. Meta-krezol u normalnim uslovima je tečnost, para-krezol i orto-krezol su čvrste materije. Svi krezoli su slabo topljivi u vodi, a po svojim hemijskim svojstvima gotovo su slični fenolu. Krezoli se prirodno nalaze u katranu ugljena, koriste se u industriji u proizvodnji boja i nekih vrsta plastike.
Primjeri dihidričnih fenola su para-, orto- i meta-hidrobenzeni. Sve su čvrste materije, lako rastvorljive u vodi.
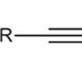
Jedini predstavnik trihidričnog fenola je pirogalol (1,2,3-trihidroksibenzen). Njegova formula je prikazana u nastavku.

Pirogalol je prilično jak redukcijski agens. Lako se oksidira, pa se koristi za dobivanje plinova pročišćenih od kisika. Ova supstanca je dobro poznata fotografima, koristi se kao razvijač.