Dobivanje fenola. Struktura, svojstva i primjena fenola. Opšte karakteristike fenola Metode dobijanja fenola
Postoje jedno-, dvo-, troatomni fenoli u zavisnosti od broja OH grupa u molekuli (slika 1)
Rice. jedan. JEDNO-, DVA- I TRI-ATOMSKI FENOLI
U skladu sa brojem spojenih aromatskih ciklusa u molekuli, postoje (slika 2) sami fenoli (jedan aromatski prsten - derivati benzena), naftoli (2 spojena prstena - derivati naftalena), antranoli (3 spojena prstena - derivati antracena) i fenatroli (slika 2).
Rice. 2. MONO- I POLINUKLEARNI FENOLI
Nomenklatura alkohola.
Za fenole se široko koriste trivijalni nazivi koji su se istorijski razvili. Prefiksi se također koriste u nazivima supstituiranih mononuklearnih fenola orto-,meta- i par -, koristi se u nomenklaturi aromatičnih jedinjenja. Za složenija jedinjenja, atomi koji su deo aromatskih ciklusa su numerisani, a položaj supstituenata je naznačen pomoću digitalnih indeksa (slika 3).
Rice. 3. NOMENKLATURA FENOLA. Grupe supstituenata i odgovarajući numerički indeksi su istaknuti različitim bojama radi jasnoće.
Hemijska svojstva fenola.
Jezgro benzena i OH grupa kombinovane u molekulu fenola utiču jedna na drugu, značajno povećavajući međusobno reaktivnost. Fenil grupa povlači usamljeni elektronski par od atoma kiseonika u OH grupi (slika 4). Kao rezultat, povećava se parcijalni pozitivni naboj na H atomu ove grupe (označen sa d+), povećava se polaritet O–H veze, što se očituje povećanjem kiselih svojstava ove grupe. Dakle, u poređenju sa alkoholima, fenoli su jače kiseline. Djelomični negativni naboj (označen sa d–), prelazeći na fenilnu grupu, koncentriran je u položajima orto- i par-(u odnosu na OH grupu). Ova reakcijska mjesta mogu biti napadnuta reagensima koji imaju tendenciju ka elektronegativnim centrima, takozvanim elektrofilnim ("elektronskim") reagensima.
Rice. 4. DISTRIBUCIJA ELEKTRONSKOG GUSTINA U FENOLU
Kao rezultat, moguće su dvije vrste transformacija za fenole: supstitucija atoma vodika u OH grupi i supstitucija jezgra H-atomobenzena. Par elektrona atoma O, privučen benzenskim prstenom, povećava snagu veze C–O, pa reakcije koje nastaju raskidanjem ove veze, a koje su karakteristične za alkohole, nisu tipične za fenole.
1. Reakcije supstitucije atoma vodika u OH grupi. Kada se fenoli tretiraju alkalijama nastaju fenolati (slika 5A), katalitička reakcija sa alkoholima dovodi do etera (slika 5B), a kao rezultat reakcije sa anhidridima ili kiselim hloridima karboksilnih kiselina nastaju estri ( Slika 5C). Prilikom interakcije s amonijakom (povišena temperatura i tlak), OH grupa se zamjenjuje s NH 2, nastaje anilin (slika 5D), redukcijski reagensi pretvaraju fenol u benzen (slika 5E)
2. Reakcije supstitucije atoma vodika u benzenskom prstenu.
Prilikom halogeniranja, nitriranja, sulfoniranja i alkilacije fenola napadaju se centri sa povećanom gustinom elektrona (slika 4), tj. zamjena se odvija uglavnom u orto- i par- pozicije (sl.6).
Sa dubljom reakcijom, dva i tri atoma vodika se zamjenjuju u benzenskom prstenu.
Od posebnog značaja su kondenzacione reakcije fenola sa aldehidima i ketonima, u suštini je reč o alkilaciji koja se odvija lako i pod blagim uslovima (na 40–50°C, vodeni medij u prisustvu katalizatora), dok se ugljenik atom je u obliku metilenske grupe CH 2 ili je supstituirana metilenska grupa (CHR ili CR 2) umetnuta između dva molekula fenola. Takva kondenzacija često dovodi do stvaranja polimernih proizvoda (slika 7).
Dihidrični fenol (trgovački naziv bisfenol A, slika 7) koristi se kao komponenta u proizvodnji epoksidnih smola. Kondenzacija fenola sa formaldehidom je osnova za proizvodnju široko korištenih fenol-formaldehidnih smola (fenolne plastike).
Metode za dobijanje fenola.
Fenoli se izoluju iz katrana ugljena, kao i iz proizvoda pirolize mrkog uglja i drveta (katran). Sama industrijska metoda za dobijanje C 6 H 5 OH fenola zasniva se na oksidaciji aromatičnog ugljovodonika kumona (izopropilbenzena) sa atmosferskim kiseonikom, nakon čega sledi razlaganje nastalog hidroperoksida razblaženog sa H 2 SO 4 (Sl. 8A). Reakcija se odvija s visokim prinosom i atraktivna je po tome što omogućava da se odjednom dobiju dva tehnički vrijedna proizvoda - fenol i aceton. Druga metoda je katalitička hidroliza halogeniranih benzena (slika 8B).
Rice. osam. METODE ZA DOBIJANJE FENOLA
Upotreba fenola.
Kao dezinfekciono sredstvo (karbolna kiselina) koristi se rastvor fenola. Dvoatomski fenoli - pirokatehol, resorcinol (slika 3), kao i hidrokinon ( par- dihidroksibenzen) koristi se kao antiseptik (antibakterijska dezinfekciona sredstva), unosi se u štavljenje kože i krzna, kao stabilizatori za maziva ulja i gume, kao i za obradu fotografskih materijala i kao reagensi u analitičkoj hemiji.
U obliku pojedinačnih spojeva, fenoli se koriste u ograničenoj mjeri, ali su njihovi različiti derivati u širokoj upotrebi. Fenoli služe kao polazna jedinjenja za proizvodnju različitih polimernih proizvoda, kao što su fenol-aldehidne smole (slika 7), poliamidi i poliepoksidi. Na bazi fenola dobivaju se brojni lijekovi, na primjer, aspirin, salol, fenolftalein, osim toga, boje, parfemi, plastifikatori za polimere i sredstva za zaštitu bilja.
Mikhail Levitsky
Prema broju hidroksilnih grupa:
monoatomski; Na primjer:
dijatomski; Na primjer:

triatomski; Na primjer:

Postoje fenoli i veća atomicnost.
Najjednostavniji monoatomski fenoli
C 6 H 5 OH - fenol (hidroksibenzen), trivijalno ime je karbolna kiselina.

Najjednostavniji dihidrični fenoli

Elektronska struktura molekula fenola. Međusobni utjecaj atoma u molekulu
Hidroksilna grupa -OH (kao alkil radikali) je supstituent 1. vrste, tj. donor elektrona. To je zbog činjenice da jedan od usamljenih elektronskih parova atoma hidroksil kisika ulazi u p, π-konjugaciju sa π-sistemom jezgra benzena.

Rezultat ovoga je:
Povećanje elektronske gustine na atomima ugljika u orto i para pozicijama jezgre benzena, što olakšava zamjenu atoma vodika u tim pozicijama;
Povećanje polariteta O-H veze, što dovodi do povećanja kiselih svojstava fenola u odnosu na alkohole.
Za razliku od alkohola, fenoli se u vodenim rastvorima delimično disociraju na ione:

tj. pokazuju slabo kisela svojstva.
Fizička svojstva
Najjednostavniji fenoli u normalnim uslovima su nisko topljive, bezbojne kristalne supstance sa karakterističnim mirisom. Fenoli su slabo rastvorljivi u vodi, ali lako rastvorljivi u organskim rastvaračima. To su otrovne tvari koje uzrokuju opekline kože.
Hemijska svojstva
I. Reakcije koje uključuju hidroksilnu grupu (kisela svojstva)

(reakcija neutralizacije, za razliku od alkohola)

Fenol je vrlo slaba kiselina, stoga se fenolate razlažu ne samo jakim kiselinama, već čak i tako slabom kiselinom kao što je ugljična:

II. Reakcije koje uključuju hidroksilnu grupu (formiranje estera i etera)
Kao i alkoholi, fenoli mogu formirati etre i estre.
Esteri nastaju interakcijom fenola sa anhidridima ili hloridima karboksilnih kiselina (direktna esterifikacija sa karboksilnim kiselinama je teža):

Eteri (alkilaril) nastaju interakcijom fenolata sa alkil halogenidima:

III. Reakcije supstitucije koje uključuju benzenski prsten

Formiranje bijelog taloga tribromofenola se ponekad smatra kvalitativnom reakcijom na fenol.

IV. Reakcije adicije (hidrogenacija)

V. Kvalitativna reakcija sa željeznim (III) hloridom
Jednoatomni fenoli + FeCl 3 (rastvor) → Plavoljubičasta boja, koja nestaje zakiseljavanjem.
DEFINICIJA
Fenoli- derivati aromatičnih ugljovodonika, u čijim molekulima su hidroksilne grupe direktno vezane za atome ugljenika benzenskog prstena. Funkcionalna grupa, kao i alkoholi, je OH.
Fenol je čvrsta bezbojna kristalna supstanca, niske tačke topljenja, vrlo higroskopna, karakterističnog mirisa. Na vazduhu fenol oksidira, pa njegovi kristali u početku dobijaju ružičastu nijansu (slika 1), a tokom dugotrajnog skladištenja potamne i postaju crveniji. Slabo je rastvorljiv u vodi na sobnoj temperaturi, ali se brzo i dobro rastvara na 60 - 70 o C. Fenol je topljiv, tačka topljenja mu je 43 o C. Otrovan.
Rice. 1. Fenol. Izgled.
Dobivanje fenola
U industrijskim razmjerima, fenol se dobiva iz katrana ugljena. Među laboratorijskim metodama koje se najčešće koriste su sljedeće:
– hidroliza hlorobenzena
C 6 H 5 Cl + NaOH→C 6 H 5 OH + NaCl (kat = Cu, t 0).
— alkalno topljenje soli arenesulfonskih kiselina
C 6 H 5 SO 3 Na + 2NaOH → C 6 H 5 OH + Na 2 SO 3 + H 2 O (t 0).
– metoda kumena (oksidacija izopropilbenzena)
C 6 H 5 -C (CH 3) H-CH 3 + O 2 → C 6 H 5 OH + CH 3 -C (O) -CH 3 (H +, t 0).
Hemijska svojstva fenola
Hemijske transformacije fenola odvijaju se uglavnom cijepanjem:
1) O-N priključci
- interakcija sa metalima
2C 6 H 5 OH + 2Na→ 2C 6 H 5 ONa + H 2 .
- interakcija sa alkalijama
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
— interakcija sa anhidridima karboksilnih kiselina
C 6 H 5 -OH + Cl-C (O) -O-C (O) -CH 3 → C 6 H 5 -O-C (O) -CH 3 + CH 3 COOH (t 0).
- interakcija sa halogenidima karboksilne kiseline
C 6 H 5 -OH + Cl-C (O) -CH 3 → C 6 H 5 -O-C (O) -CH 3 + HCl (t 0).
- interakcija sa FeCl 3 (kvalitativne reakcije na fenol - pojava ljubičaste boje koja nestaje kada se doda kiselina)
6C 6 H 5 OH + FeCl 3 → (C 6 H 5 OH) 3 + 3Cl -.
2) veze C sp 2 -H pretežno u O- i n-odredbe
- bromiranje
C 6 H 5 -OH + 3Br 2 (aq) →Br 3 -C 6 H 2 -OH ↓ + 3HBr.
- nitracija (formiranje pikrinske kiseline)
C 6 H 5 -OH + 3HONO 2 (konc) → (NO 2) 3 -C 6 H 2 -OH + 3H 2 O (H +).
3) jedan oblak od 6π-elektrona benzenskog prstena
– hidrogenacija
C 6 H 5 OH + 3H 2 → C 6 H 11 -OH (kat = Ni, t 0 = 130 - 150, p = 5 - 20 atm).
Primjena fenola
Fenol se u velikim količinama koristi za proizvodnju boja, fenol-formaldehidne plastike i medicinskih supstanci.
Od dvoatomskih fenola, resorcinol se u medicini koristi kao antiseptik i supstanca za neka klinička ispitivanja, a hidrokinon i drugi dvoatomski fenoli se koriste kao razvijači u obradi fotografskih materijala.
U medicini se lizol, koji uključuje razne fenole, koristi za dezinfekciju prostorija i namještaja.
Neki fenoli se koriste kao antioksidansi - supstance koje sprečavaju kvarenje hrane tokom dugotrajnog skladištenja (masti, ulja, koncentrati hrane).
Primjeri rješavanja problema
PRIMJER 1
| Vježba | Vodeni rastvor koji sadrži 32,9 g fenola tretiran je viškom broma. Izračunajte masu rezultirajućeg bromo derivata. |
| Rješenje | Napišimo jednačinu reakcije za interakciju fenola sa bromom: C 6 H 5 OH + 3Br 2 → C 6 H 2 Br 3 OH + 3HBr. Kao rezultat ove interakcije nastaje 2,4,6-tribromofenol. Izračunajte količinu fenolne supstance (molarna masa je 94 g/mol): n (C 6 H 5 OH) \u003d m (C 6 H 5 OH) / M (C 6 H 5 OH); n (C 6 H 5 OH) = 32,9 / 94 = 0,35 mol. Prema jednačini reakcije n(C 6 H 5 OH) :n(C 6 H 2 Br 3 OH) = 1:1, tj. n (C 6 H 2 Br 3 OH) = n (C 6 H 5 OH) = 0,35 mol. Tada će masa 2,4,6-tribromofenola biti jednaka (molarna masa -331 g/mol): m (C 6 H 2 Br 3 OH) = 0,35 × 331 = 115,81 g. |
| Odgovori | Masa dobijenog bromo derivata je 115,81 g. |
PRIMJER 2
| Vježba | Kako dobiti fenol iz jodobenzena? Izračunajte masu fenola koja se može dobiti iz 45,9 g jodobenzena. |
| Rješenje | Zapisujemo reakcijsku jednačinu za proizvodnju fenola iz jodobenzena: C 6 H 5 I + NaOH → C 6 H 5 OH + NaI (kat = Cu, t 0). |
Fenoli- derivati aromatičnih ugljovodonika, koji mogu uključivati jednu ili više hidroksilnih grupa povezanih na benzenski prsten.
Kako se zovu fenoli?
Prema IUPAC pravilima, naziv " fenol". Numeracija atoma dolazi od atoma koji je direktno povezan sa hidroksi grupom (ako je najstarija) i numerisani su tako da supstituenti dobijaju najmanji broj.
Predstavnik - fenol - C 6 H 5 OH:
Struktura fenola.
Atom kiseonika ima nepodeljeni elektronski par na spoljašnjem nivou, koji je "uvučen" u sistem prstenova (+ M-efekat HE-grupe). Kao rezultat, mogu se pojaviti 2 efekta:
1) povećanje elektronske gustine benzenskog prstena do orto i para položaja. U osnovi, ovaj efekat se manifestuje u reakcijama elektrofilne supstitucije.
2) gustoća na atomu kisika se smanjuje, zbog čega je veza HE oslabljen i može se slomiti. Efekat je povezan sa povećanom kiselošću fenola u odnosu na zasićene alkohole.
Monosupstituirani derivati fenol(krezol) može biti u 3 strukturna izomera:

Fizička svojstva fenola.
Fenoli su kristalne supstance na sobnoj temperaturi. Slabo rastvorljiv u hladnoj vodi, ali dobro - u vrućoj i u vodenim rastvorima alkalija. Imaju karakterističan miris. Zbog stvaranja vodoničnih veza imaju visoku tačku ključanja i topljenja.
Dobijanje fenola.
1. Od halobenzena. Kada se hlorobenzen i natrijum hidroksid zagreju pod pritiskom, dobije se natrijum fenolat, koji se nakon interakcije sa kiselinom pretvara u fenol:
2. Industrijska metoda: prilikom katalitičke oksidacije kumena na vazduhu dobijaju se fenol i aceton:

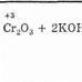
3. Od aromatičnih sulfonskih kiselina fuzijom sa alkalijama. Češće se provodi reakcija za dobivanje polihidričnih fenola:

Hemijska svojstva fenola.
R-orbitala atoma kiseonika formira jedan sistem sa aromatičnim prstenom. Zbog toga se elektronska gustina na atomu kiseonika smanjuje, au benzenskom prstenu se povećava. Polaritet komunikacije HE povećava se, a vodik hidroksilne grupe postaje reaktivniji i lako se može zamijeniti atomom metala čak i pod djelovanjem alkalija.
Kiselost fenola je veća od kiselosti alkohola, pa se mogu izvesti reakcije:
Ali fenol je slaba kiselina. Ako se ugljični dioksid ili sumpordioksid propuštaju kroz njegove soli, tada se oslobađa fenol, što dokazuje da su ugljična i sumporna kiselina jače kiseline:
Kisela svojstva fenola su oslabljena uvođenjem supstituenata prve vrste u prsten, a pojačana su uvođenjem II.
2) Formiranje estera. Proces se odvija pod uticajem kiselih hlorida:
3) Elektrofilna supstitucijska reakcija. Jer HE-grupa je supstituent prve vrste, tada se povećava reaktivnost benzenskog prstena u orto i para pozicijama. Pod djelovanjem bromne vode na fenol, uočava se taloženje - ovo je kvalitativna reakcija na fenol:

4) Nitracija fenola. Reakcija se izvodi sa nitrirajućom smjesom, što rezultira stvaranjem pikrinske kiseline:

5) Polikondenzacija fenola. Reakcija se odvija pod uticajem katalizatora:

6) Oksidacija fenola. Fenoli se lako oksidiraju atmosferskim kisikom:

7) Kvalitativna reakcija na fenol je dejstvo rastvora željeznog hlorida i formiranje ljubičastog kompleksa.
Upotreba fenola.
Fenoli se koriste u proizvodnji fenol-formaldehidnih smola, sintetičkih vlakana, boja i lijekova, te dezinficijensa. Pikrinska kiselina se koristi kao eksploziv.
Opis prezentacije na pojedinačnim slajdovima:
1 slajd
Opis slajda:
2 slajd
Opis slajda:
Svrha: Opisati fizička i hemijska svojstva fenola. Prikazati negativnu i pozitivnu ulogu fenola i njegovih derivata u prirodi i životu ljudi
3 slajd
Opis slajda:
Fenol (oksibenzen, zastarjela karbolna kiselina) C6H5OH je najjednostavniji predstavnik klase fenola. Kristalna, bezbojna supstanca sa karakterističnim mirisom. Lako oksidira na zraku, prvo postaje ružičasta, a zatim smeđa. Igličasti kristali fenola
4 slajd
Opis slajda:
Klasifikacija fenola Postoje jedno-, dvo-, troatomni fenoli u zavisnosti od broja OH grupa u molekulu:
5 slajd
Opis slajda:
Priprema kumonske metode za proizvodnju fenola (SSSR, Sergeev P.G., Udris R.Yu., Kružhalov B.D., 1949). Prednosti metode: neotpadna tehnologija (prinos korisnih proizvoda > 99%) i ekonomičnost. Fuzija soli aromatičnih sulfonskih kiselina sa čvrstim alkalijama: C6H5-SO3Na + NaOH t → Na2SO3 + C6H5 - OH Iz katrana ugljena: C6H5ONa + H2SO4 (dif) → C6H5 - OH + NaHSO4 OH+NaCl
6 slajd
Opis slajda:
Fizička svojstva Rastvorljiv u vodi (6 g na 100 g vode), u alkalnim rastvorima, u alkoholu, u benzenu, u acetonu. Fenol je izuzetno toksičan i opasan za ljudski organizam.
7 slajd
Opis slajda:
Elektronska struktura Hidroksilna grupa -OH je supstituent prve vrste, odnosno doprinosi povećanju elektronske gustine u benzenskom prstenu (posebno u orto i para pozicijama). To je zbog činjenice da jedan od usamljenih parova elektrona atoma kisika OH grupe ulazi u konjugaciju s π-sistemom benzenskog prstena. Pomicanje usamljenog para elektrona atoma kisika prema benzenskom prstenu dovodi do povećanja polariteta O-H veze.
8 slajd
Opis slajda:
Hemijska svojstva Interakcija sa metalnim natrijumom: 2C6H5OH + 2Na 2C6H5ONa + H2 Poseduje svojstva slabe kiseline, formira soli - fenolate pod dejstvom alkalija (na primer, natrijum fenolat - C6H5ONa): C6H5OH + NaOH C6H5ONaqua (reakcija sa brominom vodom + H2O) na fenol) : C6H5OH + 3Br2 C6H2Br3OH + 3HBr (formirajući bijelu čvrstu supstancu 2,4,6-tribromofenol) Reakcija sa koncentrovanom azotnom kiselinom: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (formiranje 2,4,6-trianitrophenol)-tria hlorid željeza(III) (kvalitativne reakcije za fenol): 6C6H5OH + FeCl3 Cl3
9 slajd
Opis slajda:
Biološka uloga Eterična ulja (imaju jaka baktericidna i antivirusna svojstva, stimulišu imuni sistem, povećavaju krvni pritisak: - anetol u kopru, komoraču, anisu - karvakrol i timol u timijanu - eugenol u karanfilićima, bosiljak Flavonoidi (pomažu u uklanjanju radioaktivnih elemenata iz organizma ) Ljekoviti preparati (purgen, paracetamol) Antiseptici (3-5% rastvor - karbolna kiselina) Fenol je jedan od industrijskih zagađivača Fenol je prilično toksičan za životinje i ljude Fenol je štetan za mnoge mikroorganizme, pa stoga industrijske otpadne vode sa visokim sadržajem fenola teško se biološki tretira.
10 slajd
Opis slajda:
Toksična svojstva Odnosi se na veoma opasne supstance (klasa opasnosti II). Kada se udiše, uzrokuje oštećenje funkcija nervnog sistema. Prašina, pare i rastvor fenola iritiraju sluzokožu očiju, respiratornog trakta, kože, izazivajući hemijske opekotine. Došavši na kožu, fenol se vrlo brzo apsorbira čak i kroz netaknuta područja i nakon nekoliko minuta počinje djelovati na moždano tkivo.
11 slajd
Opis slajda:
Toksična svojstva Najprije dolazi do kratkotrajne ekscitacije, a zatim do paralize respiratornog centra. Čak i kada su izloženi minimalnim dozama fenola, primjećuju se kihanje, kašalj, glavobolja, vrtoglavica, bljedilo, mučnina i gubitak snage. Teške slučajeve trovanja karakteriziraju nesvjestica, cijanoza, otežano disanje, neosjetljivost rožnjače, ubrzan, jedva primjetan puls, hladan znoj, često i konvulzije.
12 slajd
Opis slajda:
Utjecaj na tijelo Kada otopina fenola dospije na kožu, odmah se pojavljuju teške hemijske opekotine koje se pretvaraju u čireve. Ako je četvrtina cijele površine tijela izgorjela izlaganjem fenolu, tada je vjerovatnoća smrti blizu 100%. Unošenje neke supstance u organizam kroz gastrointestinalni trakt doprinosi otežanom kretanju, može izazvati krvarenje, čir. Smrtonosna doza za ljude kada se proguta je 1-10 g, za djecu 0,05-0,5 g. Uprkos brzom eliminaciji iz organizma (samo jedan dan), fenol može uzrokovati nepopravljivu štetu, a liječenje može trajati nekoliko godina. Najteže posljedice su razvoj raka, neplodnost, srčani problemi.