Kataliza u hemijskim reakcijama. Katalitičke reakcije: definicija, opis, primjeri Katalizirati kemijske reakcije
Većina procesa koji su u osnovi hemijske tehnologije su katalitičke reakcije. To je zbog činjenice da se s uvođenjem katalizatora brzina interakcije tvari značajno povećava. U ovom slučaju, proizvođači mogu smanjiti troškove ili dobiti više reakcijskih proizvoda u istom vremenskom periodu. Zato se izučavanju katalize posvećuje velika pažnja u obuci tehnologa. Međutim, ovaj fenomen također igra važnu ulogu u prirodi. Dakle, posebne supstance regulišu tok biohemijskih reakcija u živim organizmima, čime utiču na metabolizam.
Koncept katalize
Suština ovog kemijskog fenomena je reguliranje brzine transformacije tvari pomoću posebnih reagensa koji mogu usporiti ili ubrzati ovaj proces. U ovom slučaju se govori o pozitivnoj ili negativnoj katalizi. Postoji i fenomen autokatalize, kada jedan od međuproizvoda hemijske reakcije utiče na brzinu reakcije. Katalitički procesi su raznoliki, razlikuju se po mehanizmima, stanju agregacije jedinjenja i smjeru.
Supstance koje usporavaju hemijske interakcije nazivaju se inhibitori, a one koje ubrzavaju katalitičke reakcije nazivaju se katalizatori. I oni i drugi mijenjaju brzinu reakcije putem ponovljene međuinterakcije sa jednim ili više njenih učesnika. U isto vrijeme, oni nisu uključeni u sastav proizvoda i obnavljaju se nakon završetka ciklusa transformacije tvari. Stoga se učešće katalizatora ne odražava u jednadžbi reakcije stehiometrijski, već je samo naznačeno kao uslov za interakciju supstanci.
Vrste katalitičkih reakcija
Prema stanju agregacije supstanci koje učestvuju u hemijskoj reakciji razlikuju se:
- homogene reakcije - reaktanti, proizvodi i katalizator su u istom agregacijskom stanju (fazi), dok su molekuli tvari ravnomjerno raspoređeni po volumenu;
- međufazne katalitičke reakcije – nastaju na granici tečnosti koje se ne mešaju, a uloga katalizatora se svodi na prenos reagensa kroz njega;
- heterogene katalitičke reakcije - u njima katalizator ima agregacijsko stanje različito od reagensa, a sam se odvija na sučelju;
- heterogeno-homogene reakcije - pokreću se na granici sa katalizatorom, i nastavljaju se u reakcionom volumenu;
- mikroheterogene reakcije - male čestice čvrstog katalizatora formiraju micele po cijelom volumenu tekuće faze.
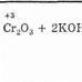
Postoji i redoks kataliza, praćena promjenom oksidacijskog stanja katalizatora pri interakciji s reagensima. Takve transformacije nazivaju se reakcijama katalitičke oksidacije i redukcije. Najčešća u hemijskoj proizvodnji je oksidacija sumpor-dioksida u trioksid u proizvodnji sumporne kiseline.

Vrste katalizatora
Prema agregatnom stanju katalizatori su tečni (H 2 SO 4, H 3 RO 4), čvrsti (Pt, V 2 O 5, Al 2 O 3) i gasoviti (BF 3).
Prema vrsti tvari, katalizatori se dijele na:
- metali - mogu biti čisti, legure, čvrsti ili naneseni na poroznu podlogu (Fe, Pt, Ni, Cu);
- metalna jedinjenja tipa M m E n - najčešći oksidi su MgO, Al 2 O 3, MoO 3 itd.;
- kiseline i baze - koriste se za kiselo-bazne katalitičke reakcije, to mogu biti Lewisove kiseline, Bronsted itd.;
- metalni kompleksi - u ovu grupu spadaju i soli prelaznih metala, kao što su PdCl 2 , Ni(CO) 4 ;
- enzimi (oni su i enzimi) su biokatalizatori koji ubrzavaju reakcije koje se odvijaju u živim organizmima.
Prema specifičnostima elektronske strukture razlikuju se d-katalizatori, koji imaju d-elektrone i d-orbitale, kao i s, p-katalizatori, čiji je centar element sa valentnim s i p-elektronima.

Svojstva katalizatora
Da bi se efikasno koristili, na njih se primjenjuje prilično opsežna lista zahtjeva, koja se razlikuje za određeni proces. Ali najznačajnija su sljedeća dva svojstva katalizatora:
- Specifičnost leži u sposobnosti katalizatora da utiču na samo jednu reakciju ili niz sličnih transformacija i da ne utiču na brzinu drugih. Dakle, platina se najčešće koristi u reakcijama organske hidrogenacije.
- Selektivnost se odlikuje sposobnošću da se ubrza jedna od nekoliko mogućih paralelnih reakcija, čime se povećava prinos najvažnijeg proizvoda.
Brzina katalitičke reakcije
Razlog za ubrzanje interakcije tvari je stvaranje aktivnog kompleksa s katalizatorom, što dovodi do smanjenja energije aktivacije.

Prema osnovnom postulatu hemijske kinetike, brzina bilo koje hemijske reakcije je direktno proporcionalna proizvodu koncentracija polaznih supstanci, koje se uzimaju u moćima koje odgovaraju njihovim stehiometrijskim koeficijentima:
v = k ∙ C A x ∙ C B y ∙ C D z ,
gdje je k konstanta brzine kemijske reakcije, numerički jednaka brzini iste reakcije, pod uvjetom da su koncentracije polaznih spojeva 1 mol/l.
Prema Arrheniusovoj jednačini, k ovisi o energiji aktivacije:
k \u003d A ∙ exp ^ (-E A / RT).
Ove pravilnosti vrijede i za katalitičke reakcije. To potvrđuje jednačina za omjer konstanti brzine:
k K / k = A K /A ∙ exp^((E A -E AK)/RT),
gdje se varijable s indeksom K odnose na katalitičke reakcije.
Faze katalitičkih reakcija
Za homogene katalitičke reakcije dovoljna su dva glavna koraka:
- Formiranje aktiviranog kompleksa: A + K -> AA.
- Interakcija aktiviranog kompleksa sa drugim početnim supstancama: AA + B ―> C + K.
U opštem obliku, jednačina oblika A + B -> C je napisana.
Mehanizam heterogenih katalitičkih reakcija je složen. Razlikuju se sljedećih šest faza:
- Dovođenje početnih jedinjenja na površinu katalizatora.
- Adsorpcija početnih reagensa na površini katalizatora i formiranje intermedijarnog kompleksa: A + B + K ―> AVK.
- Aktivacija rezultirajućeg kompleksa: ΑVC ―> ΑVC * .
- Razlaganje kompleksnog jedinjenja, dok se nastali proizvodi adsorbuju katalizatorom: ΑVK * ―> CDK.
- Desorpcija nastalih proizvoda površinom katalizatora: CDK ―> C + D + K.
- Uklanjanje proizvoda iz katalizatora.

Primjeri katalitičkih reakcija
Katalizatori se ne koriste samo u hemijskoj industriji. Svaka osoba u svom svakodnevnom životu suočava se s raznim katalitičkim reakcijama. To je, na primjer, upotreba vodikovog peroksida u liječenju rana. Vodikov peroksid, u interakciji s krvlju, počinje da se razgrađuje pod utjecajem:
2H 2 O 2 -> O 2 + 2H 2 O.

U modernim automobilima opremljen je posebnim katalitičkim komorama koje doprinose razgradnji štetnih plinovitih tvari. Na primjer, platina ili rodij pomažu u smanjenju zagađenja dušikovim oksidom, koji se razlaže i stvara bezopasne O 2 i N 2 .
Neke paste za zube sadrže enzime koji razgrađuju plak i ostatke hrane.
U ovom članku će se razmotriti katalitičke reakcije. Čitalac će se upoznati s općom idejom katalizatora i njihovim djelovanjem na sistem, te će biti opisane vrste reakcija, karakteristike njihovog toka i još mnogo toga.
Uvod u katalizu
Prije nego što se upoznate s katalitičkim reakcijama, vrijedi znati što je kataliza.
To je selektivni proces ubrzavanja određenog termodinamički dozvoljenog smjera reakcije koji je izložen katalizatoru. On je više puta uključen u interakciju hemijske prirode, i deluje na učesnike u reakciji. Na kraju bilo kojeg ciklusa srednje prirode, katalizator nastavlja svoj izvorni oblik. Koncept katalizatora u opticaj su uveli J. Barzelius i Jens 1835. godine.

Opće informacije
Kataliza je široko rasprostranjena u prirodi i čovjek je naširoko koristi u tehnološkoj industriji. Najveći broj svih reakcija koje se koriste u industriji su katalitičke. Postoji koncept autokatalize - fenomen u kojem akcelerator djeluje kao produkt reakcije ili je dio polaznih spojeva.
Sve vrste hemijskih interakcija reagujućih supstanci dele se na katalitičke i nekatalitičke reakcije. Ubrzanje reakcija koje uključuju katalizatore naziva se pozitivna kataliza. Usporavanje brzine interakcije se odvija uz učešće inhibitora. Reakcije su negativno-katalitičke prirode.
Katalitička reakcija nije samo način povećanja produktivnosti, već i prilika koja poboljšava kvalitetu rezultirajućeg proizvoda. To je zbog sposobnosti posebno odabrane tvari da ubrza glavnu reakciju i uspori brzinu paralelnih.
Katalitičke reakcije također smanjuju cijenu energije koja troši aparat. To je zbog činjenice da ubrzanje omogućava da se proces odvija na nižoj temperaturi, što bi bilo potrebno bez njega.
Primjer katalitičke reakcije je proizvodnja tako vrijednih stvari kao što su: dušična kiselina, vodik, amonijak itd. Ovi procesi se najviše koriste u proizvodnji aldehida, fenola, raznih plastičnih masa, smola i gume itd.
Raznolikost reakcija

Suština katalize leži u prijenosu mehanizma reakcije na najprofitabilniju opciju. To postaje moguće zbog smanjenja energije aktivacije.
Katalizator stvara slabu hemijsku vezu sa specifičnim molekulom reaktanta. Ovo omogućava da se olakša reakcija sa drugim reagensom. Supstance koje su katalitičke ne utiču na promjenu hemijske ravnoteže, jer djeluju reverzibilno u oba smjera.
Kataliza se dijeli na dva glavna tipa: homogena i heterogena. Zajednička karakteristika svih interakcija prvog tipa je prisustvo katalizatora u zajedničkoj fazi sa reaktantom same reakcije. Druga vrsta se razlikuje po ovom pitanju.
Homogene katalitičke reakcije nam pokazuju da akcelerator, u interakciji s određenom supstancom, tvori međuspoj. Ovo će dodatno smanjiti količinu energije potrebne za aktivaciju.
Heterogena kataliza ubrzava proces. U pravilu teče po površini čvrstih tijela. Kao rezultat toga, sposobnosti katalizatora i njegova aktivnost određuju se veličinom površine i pojedinačnim svojstvima. Heterogena katalitička reakcija ima složeniji mehanizam rada od homogene. Njegov mehanizam uključuje 5 faza, od kojih svaka može biti reverzibilna.
U prvoj fazi počinje difuzija reagensa u interakciji na područje čvrste tvari, nakon čega slijedi adsorpcija fizičke prirode, nakon čega slijedi hemisorpcija. Kao rezultat toga, dolazi do treće faze, u kojoj reakcija počinje teći između molekula supstanci koje reaguju. U četvrtoj fazi uočava se desorpcija proizvoda. U petoj fazi dolazi do difuzije konačne supstance u opšte tokove iz ravni katalizatora.
katalitičkih materijala
Postoji koncept nosača katalizatora. To je materijal inertnog ili slabo aktivnog tipa, neophodan da se čestica koja učestvuje u fazi katalize dovede u stabilno stanje.
Heterogeno ubrzanje je neophodno da bi se sprečili procesi sinterovanja i aglomeracije aktivnih komponenti. U najvećem broju slučajeva količina nosača je veća od prisustva deponovane komponente aktivnog tipa. Glavna lista zahtjeva koje nosač mora imati uključuje veliku površinu i poroznost, termičku stabilnost, inertnost i otpornost na mehanička opterećenja.
Hemijska baza. Hemija ubrzavanja toka interakcije između supstanci omogućava nam da razlikujemo dvije vrste supstanci, naime katalizatore i inhibitore. Potonji, zauzvrat, usporavaju brzinu reakcije. Jedna od vrsta katalizatora su enzimi.
Katalizatori ne stupaju u stehiometrijsku interakciju s produktom same reakcije i uvijek se na kraju regenerišu. U moderno doba postoji mnogo načina da se utiče na proces molekularne aktivacije. Međutim, kataliza je osnova hemijske proizvodnje.
Priroda katalizatora omogućava im da se podijele na homogene, heterogene, međufazne, enzimske i micelarne. Hemijska reakcija uz sudjelovanje katalizatora smanjit će energiju potrebnu za njegovu aktivaciju. Na primjer, nekatalitička razgradnja NH3 na dušik i vodonik zahtijevala bi oko 320 kJ/mol. Ista reakcija, ali pod uticajem platine, smanjiće ovaj broj na 150 kJ/mol.
Proces hidrogenacije

Najveći broj reakcija koje uključuju katalizatore zasniva se na aktivaciji atoma vodika i određene molekule, što potom dovodi do interakcije kemijske prirode. Ovaj fenomen se naziva hidrogenacija. On je u osnovi većine faza prerade nafte i stvaranja tečnog goriva iz uglja. Proizvodnja potonjeg otvorena je u Njemačkoj, zbog nedostatka nalazišta nafte u zemlji. Stvaranje takvog goriva naziva se Bergiusov proces. Sastoji se od direktne kombinacije vodonika i uglja. Ugalj se podvrgava zagrevanju u uslovima određenog pritiska i prisustva vodonika. Kao rezultat, formira se proizvod tekućeg tipa. Katalizatori su oksidi željeza. Ali ponekad se koriste i tvari na bazi metala kao što su molibden i kalaj.
Postoji još jedan način da se dobije isto gorivo, koji se zove Fischer-Tropsch proces. Sastoji se od dvije faze. U prvoj fazi, ugalj se podvrgava gasifikaciji tretiranjem interakcijom vodene pare i O 2 . Ova reakcija dovodi do stvaranja smjese vodika i ugljičnog monoksida. Nadalje, uz pomoć katalizatora, dobivena smjesa se prenosi u stanje tekućeg goriva.
Odnos između kiselosti i katalitičkog kapaciteta

Katalitička reakcija je pojava koja ovisi o kiselim svojstvima samog katalizatora. Prema definiciji J. Bronsteda, kiselina je supstanca koja može donirati protone. Jaka kiselina će lako donirati svoj proton bazi. G. Lewis je definisao kiselinu kao supstancu koja je sposobna da prihvati elektronske parove iz donorskih supstanci i, kao rezultat, formira kovalentnu vezu. Ove dvije ideje omogućile su čovjeku da odredi suštinu mehanizma katalize.
Snaga kiseline određuje se korištenjem skupova baza koje mogu promijeniti svoju boju zbog dodavanja protona. Neki katalitički agensi koji se koriste u industriji mogu se ponašati kao izuzetno jake kiseline. Njihova snaga određuje brzinu protonacije i stoga je vrlo važna karakteristika.
Kiselinska aktivnost katalizatora je posljedica njegove sposobnosti da reagira s ugljovodonicima, formirajući tako međuproizvod - karbenijum ion.
Proces dehidrogenacije
Dehidrogenacija je također katalitička reakcija. Često se koristi u raznim industrijama. Uprkos činjenici da se katalitički procesi bazirani na dehidrogenaciji koriste rjeđe od reakcija hidrogenacije, oni ipak zauzimaju važno mjesto u ljudskoj djelatnosti. Primjer ove vrste katalitičke reakcije je proizvodnja stirena, važnog monomera. Za početak, dehidrogenacija etilbenzena se događa uz sudjelovanje tvari koje sadrže željezni oksid. Čovjek često koristi ovaj fenomen za dehidrogenaciju mnogih alkana.
dvostruko djelovanje

Postoje katalizatori dvostrukog djelovanja koji mogu ubrzati dvije vrste reakcija odjednom. Kao rezultat, oni dovode do boljih rezultata, u poređenju sa propuštanjem reaktanata naizmjenično kroz 2 reaktora koji sadrže samo jednu vrstu katalizatora. To je zbog činjenice da je aktivno mjesto akceleratora dvostrukog djelovanja u bliskoj poziciji s drugim istim mjestom, kao i sa međuproizvodom. Dobar rezultat se postiže, na primjer, kombinacijom katalizatora koji aktiviraju vodik sa supstancom koja omogućava da se proces izomerizacije ugljovodonika odvija. Aktivaciju često provode metali, a izomerizacija se odvija uz sudjelovanje kiselina.
Specifičnost glavnih katalitičkih reakcija
Sposobnost i efikasnost katalizatora određuju i njegova osnovna svojstva. Upečatljiv primjer je natrijum hidroksid, koji se koristi tokom hidrolize masti za proizvodnju sapuna. Ove vrste katalizatora se također koriste u proizvodnji pjenastih i poliuretanskih ploča. Uretan se dobija interakcijom alkohola i izocijanata. Do ubrzanja reakcije dolazi kada se izloži određenom bazičnom aminu. Baza je vezana za atom ugljika koji se nalazi u molekuli izocijanata. Kao rezultat, atom dušika postaje negativno nabijen. To dovodi do povećanja aktivnosti u odnosu na alkohol.
Stereospecifična polimerizacija

Od velikog istorijskog značaja u istoriji proučavanja katalize je otkriće polimerizacije olefina praćeno proizvodnjom stereoregularnih polimernih supstanci. Otkriće katalizatora, koje karakterizira stereospecifična polimerizacija, pripada K. Ziegleru. Zieglerov rad na proizvodnji polimera privukao je interesovanje J. Natta, koji je sugerisao da jedinstvenost polimera treba da bude određena njegovom stereoregularnošću. Veliki broj eksperimenata koji su uključivali rendgenske zrake podvrgnute difrakciji dokazali su da je polimer dobiven iz propilena pod utjecajem Zieglerovog katalizatora visoko kristaliničan. Učinak djelovanja je stereoregularne prirode.
Reakcije ovog tipa odvijaju se na ravni čvrstog katalizatora koji sadrži prelazne metale, kao što su Ti, Cr, V, Zr. Moraju biti u nepotpunoj oksidaciji. Jednačina za katalitičku reakciju između TiCl 4 i Al(C 2 H 5) 3 u interakciji, tokom koje se formira talog, je živopisan primjer za to. Ovdje je titan sveden u 3-valentno stanje. Ovaj tip aktivnog sistema omogućava polimerizaciju propilena pod normalnim uslovima temperature i pritiska.
Oksidacija u katalitičkoj reakciji
Reakcije katalitičke oksidacije su u širokoj upotrebi od strane čovjeka, zbog sposobnosti određenih tvari da reguliraju brzinu same reakcije. Neke primjene zahtijevaju potpunu oksidaciju, kao što je neutralizacija CO i zagađivača koji sadrže ugljovodonike. Međutim, velika većina reakcija zahtijeva nepotpunu oksidaciju. Ovo je neophodno za dobijanje industrijski vrednih, ali međuproizvoda koji mogu sadržati određenu i važnu međugrupu: COOH, CN, CHO, C-CO. U ovom slučaju, osoba koristi i heterogene i monogene vrste katalizatora.
Među svim supstancama koje mogu ubrzati tok kemijskih reakcija, važno mjesto zauzimaju oksidi. Uglavnom u čvrstom stanju. Tok oksidacije podijeljen je u 2 faze. U prvoj fazi, kisik oksid je zarobljen molekulom ugljikovodika adsorbiranog oksida. Kao rezultat, oksid se reducira, a ugljikovodik oksidira. Obnovljeni oksid stupa u interakciju sa O 2 i vraća se u prvobitno stanje.
Veliki broj enzima je već početkom 20. stoljeća postavljao pitanja istraživačima o nomenklaturi i klasifikaciji enzima. Posebnost enzima početkom 20. stoljeća bila je završetak "aza", koji se koristio tako što se prvo dodavao nazivu supstrata (amilum - škrob - amilaza), a zatim i nazivu reakcije ( dehidrogenacija - dehidrogenaza). Komisija za enzime (EC), koju je stvorila Međunarodna unija hemičara i biohemičara, razvila je osnovne principe za klasifikaciju i nomenklaturu enzima, koji su usvojeni 1961. godine. Klasifikacija se zasnivala na vrsti reakcije koju enzim katalizira. Svi enzimi po ovom osnovu podijeljeni su u 6 klasa, od kojih svaka ima nekoliko podklasa.
1. Oksidoreduktaza - enzimi koji kataliziraju reakcije redukcije ili oksidacije. Primjer je alkohol dehidrogenaza, enzim koji oksidira etil alkohol u acetaldehid. Drugi enzim poznat kao aldehid dehidrogenaza zatim pretvara acetaldehid u acetil CoA. Oksidoreduktaze često zahtevaju učešće kofaktora koji deluju kao srednji akceptori vodonika u primeru ispod, ovo je NAD + .
 oksidaze - vrsta oksidoreduktaze. Ovo je ime dato enzimima koji koriste kiseonik kao konačni akceptor vodonika. Primjer je glukozna oksidaza, koja oksidira glukozu u glukonsku kiselinu. .
FAD služi kao srednji akceptor vodonika.
oksidaze - vrsta oksidoreduktaze. Ovo je ime dato enzimima koji koriste kiseonik kao konačni akceptor vodonika. Primjer je glukozna oksidaza, koja oksidira glukozu u glukonsku kiselinu. .
FAD služi kao srednji akceptor vodonika.
2. Transferaze - enzimi koji prenose funkcionalne grupe sa molekula donora na molekul akceptora. Primjer su metiltransferaze, koje prenose metil grupu sa S-adenozilmetionina na akceptor. U nastavku je prikazana reakcija koju katalizira katehol-O-metiltransferaza, enzim uključen u metabolizam neurotransmitera epinefrina i norepinefrina. .

Drugi vrlo važan primjer transferaza su enzimi koji katalizuju prijenos amino grupe α-transaminaze.
Transaminaze koriste aminokiselinu kao donora amino grupe, koju prenose u α-keto kiselinu, pretvarajući donorsku aminokiselinu u α-keto kiselinu, odnosno keto kiselinu akceptora u aminokiselinu. Ovo se koristi za međusobnu konverziju određenih aminokiselina i omogućavanje aminokiselinama da uđu u puteve ugljikohidrata ili lipida.
Transferaze koje će se često spominjati u biohemiji su kinaze koje kataliziraju prijenos fosfata sa visokoenergetskog ATP molekula na supstrat. Postoje mnoge kinaze koje igraju važnu ulogu u metabolizmu ćelija.
3. Hidrolaze-enzimi koji katalizuju biološke reakcije hidrolize. Razbijaju kovalentne veze. pričvršćivanje elemenata od vode na mjestu rupture. Lipaze, fosfataze, acetilkolinesteraza i proteaze su svi primjeri hidrolitičkih enzima.
4. Liaze (desmolaze)- enzimi koji kataliziraju razgradnju C-C, C-O i C-N veza na nehidrolitički način sa stvaranjem dvostrukih veza. Primjer bi bio enzim DOPA dekarboksilaza, koji je ključni enzim u sintezi biogenih amina epinefrina i norepinefrina.

5. Izomeraze- enzimi koji katalizuju intramolekularne rearanžmane. U ovom slučaju dolazi do interkonverzije optičkih geometrijskih i pozicijskih izomera. Epimeraze i racemaze su primjeri ove klase enzima.
6. Ligaze kataliziraju stvaranje C-O, C-S, C-N ili C-C veza koristeći energiju hidrolize ATP-a. Fosfat se može ili ne mora kovalentno vezati za produkt reakcije.
Enzimska komisija je također predložila principe za nomenklaturu enzima. Preporučuje se korištenje sistematske i radne nomenklature. Sistematska nomenklatura se zasniva na istom principu kao i za klasifikaciju - tip katalizirane reakcije. Na prvi pogled nazivi postaju glomazni, ali iz naziva postaje jasno šta enzim radi. Naziv se sastoji iz dva dijela: imena učesnika u reakciji (u zavisnosti od klase, to mogu biti supstrati, međuakceptori) i vrste katalizirane reakcije sa završetkom "aza".
Svaki enzim dobija određeni broj koda enzima, koji odražava njegovu poziciju u klasifikaciji: prva cifra karakteriše klasu enzima, druga podklasu, a treća podklasu. Svaka pod-podklasa je lista enzima. Redni broj enzima na ovoj listi je četvrta cifra koda. Slika 1-1 prikazuje kod za kreatin fosfokinazu - CP.2.7.3.2. Ovaj enzim katalizuje reakciju fosforilacije kreatina. Sistematski naziv za enzim ATP je kreatin fosfotransferaza. Radni naziv za ovaj enzim je kreatin kinaza ili kreatin fokinaza.
R  je 2-1. Šifra kreatin fosfokinaze i mjesto enzima u klasifikaciji enzima
je 2-1. Šifra kreatin fosfokinaze i mjesto enzima u klasifikaciji enzima
Brzine hemijskih reakcija mogu se dramatično povećati u prisustvu različitih supstanci koje nisu reaktanti i nisu deo produkta reakcije. Ovaj izuzetan fenomen se zove kataliza(od grčkog "katalysis" - uništenje). Tvar koja povećava brzinu reakcije u smjesi naziva se katalizator. Njegova količina prije i nakon reakcije ostaje nepromijenjena. Katalizatori ne predstavljaju nikakvu posebnu klasu supstanci. U različitim reakcijama, metali, oksidi, kiseline, soli i složeni spojevi mogu pokazati katalitičko djelovanje. Hemijske reakcije u živim stanicama odvijaju se pod kontrolom katalitičkih proteina tzv enzimi. Katalizu treba smatrati pravim hemijskim faktorom u povećanju brzine hemijskih reakcija, budući da je katalizator direktno uključen u reakciju. Kataliza je često snažnija i manje rizična u ubrzavanju reakcije od podizanja temperature. To se jasno očituje na primjeru hemijskih reakcija u živim organizmima. Reakcije, kao što je hidroliza proteina, koje se u laboratorijima moraju izvoditi uz produženo zagrijavanje do tačke ključanja, u procesu probave se odvijaju bez zagrijavanja na tjelesnoj temperaturi.
Po prvi put je fenomen katalize uočio francuski hemičar L. J. Tenard (1777-1857) 1818. godine. Otkrio je da oksidi određenih metala, kada se vodikov peroksid doda u rastvor, izazivaju njegovu razgradnju. Takvo iskustvo je lako reproducirati dodavanjem kristala kalijevog permanganata u 3% otopinu vodikovog peroksida. Sol KMp0 4 prelazi u Mn0 2, a kiseonik se brzo oslobađa iz rastvora pod dejstvom oksida:
Direktan učinak katalizatora na brzinu reakcije povezan je sa smanjenjem energije aktivacije. Pri normalnom padu temperature? i za 20 kJ/mol povećava konstantu brzine za približno 3000 puta. downgrade E L može biti mnogo jači. Međutim, smanjenje energije aktivacije je vanjska manifestacija djelovanja katalizatora. Reakciju karakterizira određena vrijednost E. v koji se može promijeniti samo ako se promijeni sama reakcija. Dajući iste produkte, reakcija uz učešće dodane supstance teče drugačijim putem, kroz različite faze i sa različitom energijom aktivacije. Ako je na ovom novom putu energija aktivacije manja i reakcija je shodno tome brža, onda kažemo da je ova supstanca katalizator.
Katalizator stupa u interakciju s jednim od reaktanata, tvoreći neki međuspojni spoj. U jednoj od sljedećih faza reakcije, katalizator se regenerira - ostavlja reakciju u izvornom obliku. Reagensi, koji sudjeluju u katalitičkoj reakciji, nastavljaju međusobnu interakciju i sporim putem bez sudjelovanja katalizatora. Stoga, katalitičke reakcije spadaju u niz složenih reakcija koje se nazivaju serijski paralelne. Na sl. 11.8 prikazuje ovisnost konstante brzine o koncentraciji katalizatora. Graf zavisnosti ne prolazi kroz nulu, jer u odsustvu katalizatora, reakcija se ne zaustavlja.

Rice. 11.8.
vidljiva konstanta k izraženo kao zbir k u+ & k c(k)
Primjer 11.5. Na temperaturi od -500 °C, reakcija oksidacije sumpor-oksida (IV)
koja je jedna od faza industrijske proizvodnje sumporne kiseline, teče vrlo sporo. Dalje povećanje temperature je neprihvatljivo, jer se ravnoteža pomiče ulijevo (egzotermna reakcija) i prinos proizvoda previše opada. Ali ovu reakciju ubrzavaju različiti katalizatori, od kojih jedan može biti dušikov oksid (II). Prvo, katalizator reagira s kisikom: ![]()
a zatim prenosi atom kisika na sumporov oksid (IV):
Tako se formira konačni proizvod reakcije i katalizator se regeneriše. Za reakciju je otvorena mogućnost strujanja novom putanjom, u kojoj su se konstante brzine značajno povećale:

Dijagram ispod prikazuje oba puta procesa oksidacije S0 2. U odsustvu katalizatora, reakcija se odvija samo sporim putem, a u prisustvu katalizatora duž oba.
Postoje dvije vrste katalize - homogena i heterogena. U prvom slučaju, katalizator i reagensi formiraju homogeni sistem u obliku gasne mešavine ili rastvora. Primjer oksidacije sumpor oksida je homogena kataliza. Brzina homogene katalitičke reakcije ovisi i o koncentraciji reaktanata i o koncentraciji katalizatora.
U heterogenoj katalizi, katalizator je čvrsta tvar u čistom obliku ili na podlozi nosilac. Na primjer, platina kao katalizator može se fiksirati na azbest, aluminij itd. Molekuli reagensa se adsorbuju (apsorbuju) iz gasa ili rastvora na određenim tačkama na površini katalizatora – aktivnim centrima i istovremeno se aktiviraju. Nakon kemijske transformacije, rezultirajući molekuli proizvoda se desorbiraju s površine katalizatora. Akti transformacije čestica se ponavljaju u aktivnim centrima. Između ostalih faktora, brzina heterogene katalitičke reakcije ovisi o površini katalitičkog materijala.
Heterogena kataliza se posebno široko koristi u industriji. To je zbog lakoće izvođenja kontinuiranog katalitičkog procesa s prolaskom mješavine reagensa kroz kontaktni aparat s katalizatorom.
Katalizatori djeluju selektivno, ubrzavajući vrlo specifičnu vrstu reakcije ili čak jednu reakciju bez utjecaja na druge. To omogućava korištenje katalizatora ne samo za ubrzavanje reakcija, već i za namjerno pretvaranje početnih materijala u željene proizvode. Metan i voda na 450°C na Fe 2 0 3 katalizatoru se pretvaraju u ugljični dioksid i vodonik:
Iste tvari na 850 °C reagiraju na površini nikla i formiraju ugljični monoksid (II) i vodik:

Kataliza spada u one oblasti hemije u kojima još nije moguće napraviti tačna teorijska predviđanja. Svi industrijski katalizatori za preradu naftnih derivata, prirodnog plina, proizvodnju amonijaka i mnogi drugi razvijeni su na temelju mukotrpnih i dugotrajnih eksperimentalnih studija.
Sposobnost kontrole brzine hemijskih procesa je od neprocjenjive važnosti u ljudskoj ekonomskoj aktivnosti. U industrijskoj proizvodnji hemijskih proizvoda obično je potrebno povećati stope tehnoloških hemijskih procesa, a kod skladištenja proizvoda potrebno je smanjiti brzinu razgradnje ili izlaganja kiseoniku, vodi itd. Poznate supstance koje mogu usporiti hemijske reakcije. Zovu se inhibitori, ili negativni katalizatori. Inhibitori se suštinski razlikuju od pravih katalizatora po tome što reaguju sa aktivnim vrstama (slobodnim radikalima) koji, iz ovog ili onog razloga, nastaju u supstanci ili njenoj okolini i izazivaju vredne reakcije razgradnje i oksidacije. Inhibitori se postepeno troše, završavajući njihovo zaštitno djelovanje. Najvažnija vrsta inhibitora su antioksidansi, koji štite različite materijale od djelovanja kisika.
Treba podsjetiti i šta se ne može postići uz pomoć katalizatora. Sposobni su da ubrzaju samo spontane reakcije. Ako se reakcija ne odvija spontano, tada je katalizator neće moći ubrzati. Na primjer, nijedan katalizator ne može uzrokovati razgradnju vode na vodik i kisik. Ovaj proces se može izvesti samo elektrolizom, uz trošenje električnog rada.
Katalizatori također mogu aktivirati neželjene procese. Poslednjih decenija dolazi do postepenog uništavanja ozonskog omotača atmosfere na visini od 20-25 km. Pretpostavlja se da su neke tvari uključene u raspadanje ozona, na primjer, halogenirani ugljovodonici koje industrijska poduzeća emituju u atmosferu, kao i koji se koriste u domaće svrhe.
S. I. LEVCHENKOV
FIZIČKA I KOLOIDNA HEMIJA
Sažetak predavanja za studente Biološkog fakulteta Južnog federalnog univerziteta (RSU)
2.3 KATALITIČKI PROCESI
Brzina hemijske reakcije na datoj temperaturi određena je brzinom formiranja aktiviranog kompleksa, koja zauzvrat zavisi od vrednosti energije aktivacije. U mnogim hemijskim reakcijama, struktura aktiviranog kompleksa može uključivati supstance koje nisu stehiometrijski reaktanti; Očigledno, u ovom slučaju se mijenja i vrijednost energije aktivacije procesa. U slučaju prisustva nekoliko prelaznih stanja, reakcija će se odvijati uglavnom duž putanje sa najnižom aktivacionom barijerom.
Kataliza je fenomen promjene brzine kemijske reakcije u prisustvu tvari čije stanje i količina ostaju nepromijenjeni nakon reakcije.
Razlikovati pozitivno i negativan kataliza (odnosno, povećanje i smanjenje brzine reakcije), iako često izraz "kataliza" znači samo pozitivnu katalizu; negativna kataliza se naziva inhibicija.
Supstanca koja je dio strukture aktiviranog kompleksa, ali nije stehiometrijski reaktant, naziva se katalizator. Sve katalizatore karakteriziraju takva opća svojstva kao što su specifičnost i selektivnost djelovanja.
Specifičnost Katalizator leži u njegovoj sposobnosti da ubrza samo jednu reakciju ili grupu reakcija istog tipa i ne utiče na brzinu drugih reakcija. Na primjer, mnogi prijelazni metali (platina, bakar, nikal, željezo, itd.) su katalizatori za procese hidrogenacije; aluminij oksid katalizuje reakcije hidratacije, itd.
Selektivnost katalizator - sposobnost da se ubrza jedna od paralelnih reakcija mogućih pod datim uslovima. Zbog toga je moguće, korištenjem različitih katalizatora, dobiti različite proizvode od istih polaznih materijala:
|
: CO + H 2 ––> CH 3 OH |
: C 2 H 5 OH -> C 2 H 4 + H 2 O |
|
: CO + H 2 -> CH 4 + H 2 O |
: C 2 H 5 OH -> CH 3 CHO + H 2 |
Razlog za povećanje brzine reakcije kod pozitivne katalize je smanjenje energije aktivacije kada se reakcija odvija kroz aktivirani kompleks uz učešće katalizatora (slika 2.8).
Budući da, prema Arrheniusovoj jednačini, konstanta brzine kemijske reakcije eksponencijalno ovisi o energiji aktivacije, smanjenje potonje uzrokuje značajno povećanje konstante brzine. Zaista, ako pretpostavimo da su predeksponencijalni faktori u Arrheniusovoj jednačini (II.32) za katalitičke i nekatalitičke reakcije bliski, tada za omjer konstanti brzine možemo napisati:
Ako je ΔE A = –50 kJ/mol, tada će odnos konstanti brzine biti 2,7·10 6 puta (zaista, u praksi, takvo smanjenje E A povećava brzinu reakcije za približno 10 5 puta).
Treba napomenuti da prisustvo katalizatora ne utječe na veličinu promjene termodinamičkog potencijala kao rezultat procesa i, stoga, nijedan katalizator ne može termodinamički nemoguć proces učiniti spontanim (procesa čiji je ΔG (ΔF) veći od nule). Katalizator ne mijenja vrijednost konstante ravnoteže za reverzibilne reakcije; efekat katalizatora u ovom slučaju se sastoji samo u ubrzavanju postizanja ravnotežnog stanja.
U zavisnosti od faznog stanja reaktanata i katalizatora, razlikuju se homogena i heterogena kataliza.

Rice. 2.8 Energetski dijagram hemijske reakcije bez katalizatora (1)
i u prisustvu katalizatora (2).
2.3.1 Homogena kataliza.
Homogena kataliza je katalitička reakcija u kojoj su reaktanti i katalizator u istoj fazi. U slučaju homogenih katalitičkih procesa, katalizator sa reagensima stvara međureaktivne produkte. Razmislite o nekoj reakciji
A + B ––> C
U prisustvu katalizatora, izvode se dva brza koraka, koji rezultiraju formiranjem čestica intermedijarnog jedinjenja AA, a zatim (putem aktiviranog kompleksa AVK #) konačnog produkta reakcije sa regeneracijom katalizatora:
A + K ––> AK
AK + V -> C + K
Primjer takvog procesa je razgradnja acetaldehida, čija je energija aktivacije E A = 190 kJ/mol:
CH 3 CHO -> CH 4 + CO
U prisustvu jodnih para, ovaj proces se odvija u dvije faze:
CH 3 CHO + I 2 ––> CH 3 I + HI + CO
CH 3 I + HI -> CH 4 + I 2
Smanjenje energije aktivacije ove reakcije u prisustvu katalizatora je 54 kJ/mol; u ovom slučaju, konstanta brzine reakcije raste otprilike za faktor 105. Najčešći tip homogene katalize je kisela kataliza, u kojoj vodikovi joni H+ djeluju kao katalizator.
2.3.2 Autokataliza.
Autokataliza- proces katalitičkog ubrzanja hemijske reakcije jednim od njenih proizvoda. Primjer je hidroliza estera katalizirana vodikovim jonima. Kiselina nastala tokom hidrolize disocira stvaranjem protona, koji ubrzavaju reakciju hidrolize. Karakteristika autokatalitičke reakcije je da se ova reakcija odvija uz konstantno povećanje koncentracije katalizatora. Stoga, u početnom periodu reakcije, njegova brzina se povećava, au narednim fazama, kao rezultat smanjenja koncentracije reagensa, brzina počinje opadati; kinetička kriva produkta autokatalitičke reakcije ima karakterističan oblik u obliku slova S (slika 2.9).

Rice. 2.9 Kinetička kriva produkta autokatalitičke reakcije
2.3.3 Heterogena kataliza.
heterogena kataliza - katalitičke reakcije koje se odvijaju na granici između faza formiranih od katalizatora i reaktanata. Mehanizam heterogenih katalitičkih procesa je mnogo složeniji nego u slučaju homogene katalize. U svakoj heterogenoj katalitičkoj reakciji može se razlikovati najmanje šest faza:
1. Difuzija polaznih materijala na površinu katalizatora.
2. Adsorpcija polaznih materijala na površini sa stvaranjem nekog međuspoja:
A + B + K -–> AVK
3. Aktivacija adsorbiranog stanja (potrebna energija za to je prava energija aktivacije procesa):
AVK ––> AVK #
4. Razgradnja aktiviranog kompleksa sa stvaranjem adsorbiranih produkta reakcije:
ABK # ––> CDK
5. Desorpcija produkta reakcije sa površine katalizatora.
SDK ––> S + D + K
6. Difuzija produkta reakcije sa površine katalizatora.
Specifičnost heterokatalitičkih procesa je sposobnost katalizatora da se promoviše i otruje.
Promocija– povećanje aktivnosti katalizatora u prisustvu supstanci koje same po sebi nisu katalizatori ovog procesa (promotori). Na primjer, za reakciju koju katalizira metalni nikl
CO + H 2 -> CH 4 + H 2 O
uvođenje male nečistoće cerija u nikl katalizator dovodi do naglog povećanja aktivnosti katalizatora.
Trovanje- naglo smanjenje aktivnosti katalizatora u prisustvu određenih supstanci (tzv. katalitički otrovi). Na primjer, za reakciju sinteze amonijaka (katalizator - spužvasto željezo), prisutnost kisika ili spojeva sumpora u reakcijskoj smjesi uzrokuje naglo smanjenje aktivnosti željeznog katalizatora; u isto vrijeme, sposobnost katalizatora da adsorbira početne tvari vrlo se blago smanjuje.
Da bi objasnio ove karakteristike heterogenih katalitičkih procesa, G. Taylor je napravio sljedeću pretpostavku: nije katalitički aktivna cijela površina katalizatora, već samo neki njegovi dijelovi – tzv. aktivni centri , što mogu biti različiti defekti u kristalnoj strukturi katalizatora (na primjer, izbočine ili udubljenja na površini katalizatora). Trenutno ne postoji jedinstvena teorija heterogene katalize. Za metalne katalizatore, a teorija multipleta . Glavne odredbe teorije multipleta su sljedeće:
1. Aktivni centar katalizatora je skup određenog broja adsorpcionih centara koji se nalaze na površini katalizatora u geometrijskom skladu sa strukturom molekula koji prolazi kroz transformaciju.
2. Kada se reagujući molekuli adsorbuju na aktivnom mestu, formira se multiplet kompleks, usled čega se veze redistribuiraju, što dovodi do stvaranja produkta reakcije.
Teorija multipleta se ponekad naziva teorijom geometrijske sličnosti između aktivnog centra i reagujućih molekula. Za različite reakcije, broj adsorpcijskih centara (od kojih je svaki identificiran s atomom metala) u aktivnom centru je različit - 2, 3, 4, itd. Takvi aktivni centri se nazivaju dublet, triplet, kvadruplet itd. (u opštem slučaju, multiplet, kome teorija duguje ime).
Na primjer, prema teoriji multipleta, dehidrogenacija zasićenih monohidričnih alkohola odvija se na dubletu, a dehidrogenacija cikloheksana - na sekstetu (sl. 2.10 - 2.11); Teorija multipleta je omogućila da se katalitička aktivnost metala poveže sa njihovim atomskim radijusom.
 Rice. 2.10 Dehidrogenacija alkohola na dubletu
Rice. 2.10 Dehidrogenacija alkohola na dubletu
 Rice. 2.11 Dehidrogenacija cikloheksana na sekstetu
Rice. 2.11 Dehidrogenacija cikloheksana na sekstetu
2.3.4 Enzimska kataliza.
Enzimska kataliza - katalitičke reakcije koje se odvijaju uz učešće enzima - bioloških katalizatora proteinske prirode. Enzimska kataliza ima dvije karakteristične karakteristike:
1. visoka aktivnost , što je nekoliko redova veličine veće od aktivnosti neorganskih katalizatora, što se objašnjava vrlo značajnim smanjenjem energije aktivacije procesa enzimima. Dakle, konstanta brzine reakcije razgradnje vodikovog peroksida katalizirane Fe 2+ jonima je 56 s -1 ; konstanta brzine iste reakcije koju katalizira enzim katalaza je 3,5·10 7 , tj. reakcija u prisustvu enzima teče milion puta brže (energije aktivacije procesa su 42 i 7,1 kJ/mol, respektivno). Konstante brzine hidrolize uree u prisustvu kiseline i ureaze razlikuju se za trinaest redova veličine i iznose 7,4·10 -7 i 5·10 6 s -1 (energija aktivacije je 103 i 28 kJ/mol, respektivno).
2. Visoka specifičnost . Na primjer, amilaza katalizira razgradnju škroba, koji je lanac identičnih jedinica glukoze, ali ne katalizira hidrolizu saharoze, čiji se molekul sastoji od fragmenata glukoze i fruktoze.
Prema opšte prihvaćenim idejama o mehanizmu enzimske katalize, supstrat S i enzim F su u ravnoteži sa veoma brzo formiranim kompleksom enzim-supstrat FS, koji se relativno sporo razgrađuje do produkta reakcije P uz oslobađanje slobodnog enzima; dakle, faza razgradnje kompleksa enzim-supstrat u produkte reakcije je determinirajuća (ograničavajuća).
F+S<––>FS ––> F+P
Proučavanje ovisnosti brzine enzimske reakcije o koncentraciji supstrata pri konstantnoj koncentraciji enzima pokazalo je da s povećanjem koncentracije supstrata brzina reakcije prvo raste, a zatim prestaje da se mijenja (Sl. 2.12), a ovisnost brzine reakcije od koncentracije supstrata opisana je sljedećom jednadžbom:
 (II.45)
(II.45)