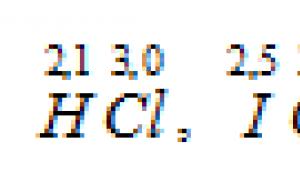Ikatan kimia. Terminologi dasar. Ikatan kimia dalam suatu molekul dengan Ikatan kimia dalam molekul gas ketawa
Ikatan kovalen. Struktur molekul air
Tugas 61.
Ikatan kimia apa yang disebut kovalen? Bagaimana kita menjelaskan arah ikatan kovalen? Bagaimana metode ikatan valensi (BC) menjelaskan struktur molekul air?
Larutan:
Komunikasi dilakukan melalui pembentukan pasangan elektron Kepunyaan yang sama pada kedua atom disebut kovalen nonpolar. Ikatan kovalen berorientasi dalam ruang dengan cara tertentu, yaitu mempunyai arah. Alasan mengapa molekul dapat memiliki struktur linier, datar, atau struktur lainnya adalah karena atom menggunakan orbital yang berbeda dan jumlah orbital yang berbeda untuk membentuk ikatan. Molekul yang memiliki momen dipol tidaklah linier, dan molekul yang tidak memiliki momen dipol adalah linier.
Molekul air H 2 O mempunyai momen dipol yang berarti mempunyai struktur nonlinier. Pembentukan ikatan antara atom oksigen dan hidrogen melibatkan satu atom oksigen dan dua atom hidrogen. Oksigen adalah atom pusat dalam molekul air, dan memiliki empat pasangan elektron, dua pasangan mandiri dan dua pasangan bersama, yang dibentuk oleh satu elektron s dan satu elektron p oksigen. Molekul semacam itu memiliki struktur tetrahedral; di tengah tetrahedron terdapat atom oksigen, dan di sudut tetrahedron terdapat dua atom hidrogen dan dua pasangan elektron bebas oksigen. Dalam molekul seperti itu, sudut antara ikatan harus sama dengan 109,5 0. Jika molekul air berbentuk datar, maka sudut HOH harus 90 0. Namun analisis difraksi sinar-X terhadap molekul air menunjukkan bahwa sudut HOH sama dengan 104,5 0. Hal ini menjelaskan bahwa molekul air tidak mempunyai bentuk linier, melainkan berbentuk tetrahedron yang terdistorsi. Hal ini dijelaskan oleh fakta bahwa atom oksigen mengalami hibridisasi sp 3, ketika satu orbital s dan tiga orbital p atom oksigen berhibridisasi, membentuk empat orbital hibrid sp 3 yang setara. Dari empat orbital hibrid sp 3, dua ditempati oleh orbital s atom hidrogen. Perbedaan antara sudut ikatan dan sudut tetrahedral dijelaskan oleh fakta bahwa tolakan antara pasangan elektron bebas lebih besar dibandingkan antara pasangan elektron ikatan.
Ikatan kovalen polar
Tugas 62.
Ikatan kovalen manakah yang disebut polar? Apa ukuran kuantitatif polaritas ikatan kovalen? Berdasarkan nilai keelektronegatifan atom-atom unsur yang bersesuaian, tentukan ikatan mana: HCl, ICl, BrF yang paling polar.
Larutan:
Ikatan kovalen yang dibentuk oleh atom-atom yang berbeda disebut polar. Misalnya, H - Cl; Pusat gravitasi muatan negatif (berhubungan dengan elektron) tidak bertepatan dengan pusat gravitasi muatan positif (berhubungan dengan muatan inti atom). Kerapatan elektron dari elektron bersama bergeser ke arah salah satu atom yang memiliki nilai keelektronegatifan lebih tinggi. Dalam H:Cl, pasangan elektron bersama bergeser ke arah atom klor yang paling elektronegatif. Polaritas ikatan diukur dengan momen dipol (), yang merupakan hasil kali panjang dipol (l) - jarak antara dua muatan yang sama besar dan berlawanan +g dan –g dan nilai absolut muatan: = lg. Momen dipol HCI, HBr, HI masing-masing sama dengan 1,04; 0,79; 0,38 D. Momen dipol molekul biasanya diukur dalam debyes (D)*: 1D = 3,33 .
10 -30 Kl .
M.
Momen dipol merupakan besaran vektor dan arahnya sepanjang sumbu dipol dari muatan negatif ke positif. Momen dipol ikatan memberikan informasi berharga tentang perilaku molekul secara keseluruhan. Seiring dengan momen dipol, karakteristik yang disebut keelektronegatifan suatu unsur (EO) digunakan untuk menilai derajat polaritas ikatan. EO adalah kemampuan suatu atom untuk menarik elektron valensi dari atom lain. Nilai EO suatu unsur diberikan dalam skala khusus (tabel).
Nilai EO hidrogen, klor, brom, yodium, fluor masing-masing adalah: 2.1; 3.0; 2.8; 2.5; 4.0. Berdasarkan nilai EO elemen-elemen dalam sambungannya
![]()
ikatan paling polar dalam molekul BrF, karena perbedaan elektronegativitas antara fluor dan brom adalah yang terbesar - 1,2 (4,0 - 2,8 = 1,2) dibandingkan HCl dan IСl.
Ikatan donor-akseptor
Tugas 63.
Cara pembentukan ikatan kovalen manakah yang disebut donor-akseptor? Ikatan kimia apa yang terdapat pada ion NH 4+ dan BF 4-? Tentukan donor dan akseptor.
Larutan:
Ikatan donor-akseptor adalah ikatan kovalen di mana hanya satu atom yang berpartisipasi dalam ikatan tersebut menyediakan pasangan elektron bersama. Dalam hal ini, salah satu atom adalah donor - pemasok pasangan elektron, dan yang lainnya adalah akseptor - pemasok orbital kuantum bebas.
Kation amonium NH 4+ terbentuk menurut mekanisme donor-akseptor:

Ini memiliki bentuk tetrahedron biasa:

Dalam ion amonium, setiap atom hidrogen dihubungkan ke atom nitrogen melalui pasangan elektron yang sama, salah satunya diwujudkan melalui mekanisme donor-akseptor. Penting untuk dicatat bahwa ikatan H - N yang dibentuk oleh mekanisme yang berbeda tidak memiliki perbedaan, yaitu semuanya setara. Donornya adalah atom nitrogen, dan akseptornya adalah atom hidrogen.
Ion BF 4- terbentuk dari BF 3 dan ion F-. Ion ini terbentuk karena fakta bahwa pasangan elektron bebas dari ion F- “tertanam” dalam kulit valensi atom boron dari molekul BF 3 yang terikat secara kovalen:

Pada ion BF 4, donornya adalah ion fluor, dan akseptornya adalah atom boron dari molekul BF 3.
Ikatan donor-akseptor dalam rumus struktur diwakili oleh panah yang diarahkan dari donor ke akseptor.
Metode ikatan valensi (VB)
Tugas 64.
Bagaimana metode ikatan valensi (BC) menjelaskan struktur linier molekul BeCl 2 dan tetrahedral CH 4?
Larutan
a) Konsep metode ikatan valensi memungkinkan penjelasan geometri banyak molekul. Jadi, molekul BeCl2 terdiri dari satu atom berilium dan dua atom klor. Sebuah atom berilium dalam keadaan tereksitasi memiliki satu elektron s dan satu elektron p. Ketika BeCl 2 terbentuk, muncul dua ikatan kovalen. Salah satunya harus berupa ikatan s - p, terbentuk karena tumpang tindih awan s atom berilium dan awan p atom klor, yang lain (ikatan p - p) karena tumpang tindih p -awan atom berilium dan awan p dari atom klor.
ikatan p - p dan s - p dapat terletak pada sudut relatif satu sama lain, mis. molekul BeCl 2 harus bersudut, tetapi diketahui secara pasti bahwa molekul BeCl 2 memiliki struktur linier, dan kedua ikatan memiliki energi yang sama dan panjang. Untuk menjelaskan geometri molekul BeCl 2 digunakan konsep hibridisasi orbital atom. Inti dari konsep orbital atom adalah bahwa orbital atom dapat dimodifikasi secara geometris dan dicampur satu sama lain sedemikian rupa sehingga menghasilkan tumpang tindih terbesar dengan orbital atom lain dan, oleh karena itu, perolehan energi terbesar. Hal ini tercapai jika alih-alih orbital yang memiliki bentuk dan energi berbeda, muncul orbital hibrid dengan bentuk dan energi yang sama, yang merupakan kombinasi linier dari orbital atom aslinya. Jadi, dalam atom Be, orbital s dan orbital p berinteraksi, energinya seimbang dan dua orbital hibrid sp dengan bentuk yang sama terbentuk. Dua awan elektron hibrid sp yang dihasilkan memiliki energi yang sama dan bentuk asimetris, sehingga menghasilkan tumpang tindih yang lebih besar antara awan elektron p pada atom klor daripada tumpang tindih yang melibatkan awan s dan p murni yang tidak terhibridisasi. Dua awan hibrid sp terletak relatif satu sama lain dan inti atom pada sudut 180 0:

Beras. 1. Molekul triatomik BeCl 2
Akibat susunan awan hibrid ini, molekul BeCl 2 memiliki struktur linier.
b) Molekul CH 4 terdiri dari satu atom karbon dan empat atom hidrogen, di antaranya timbul empat ikatan kovalen. Sebuah atom karbon dalam keadaan tereksitasi memiliki empat elektron tidak berpasangan, satu di antaranya berada di orbital s dan tiga di orbital p:
Mengisi tingkat energi terluar atom karbon pada keadaan dasar:
![]()
Mengisi tingkat energi eksternal atom karbon dalam keadaan tereksitasi:
![]()
Dari empat ikatan pada molekul CH 4, seharusnya terdapat satu ikatan s - s dan tiga ikatan s - p, yang terbentuk karena tumpang tindih orbital atom karbon dengan orbital s atom hidrogen. Sebagai hasil dari tumpang tindih ini, ikatan s - s harus terbentuk, berbeda dari ketiga ikatan s - p dalam hal panjang dan energi dan terletak pada salah satu ikatan tersebut pada sudut sekitar 125 0. Namun, telah diketahui secara pasti bahwa molekul CH 4 berbentuk tetrahedron dengan sudut antar ikatan 109,5 0, dan semua ikatan memiliki panjang dan energi yang setara. Struktur tetrahedral molekul CH 4 dapat dijelaskan dengan hibridisasi sp 3. Atom karbon mengandung empat orbital hibrid sp 3, yang dihasilkan dari kombinasi linier orbital s dan tiga orbital p. Keempat orbital hibrid sp3 terletak pada sudut 109,5 0 relatif satu sama lain. Mereka diarahkan ke simpul tetrahedron, yang di tengahnya terdapat inti atom karbon (Gbr. 2.).
Beras. 2. Skema struktur molekul CH 4;
Metana, tidak ada pasangan elektron yang tidak terikat.
Jadi, empat ikatan kimia setara terbentuk dalam molekul CH4 karena tumpang tindih orbital hibrid sp3 atom karbon dengan orbital s atom karbon.
Pembentukan ikatan sigma dan ikatan pi
Tugas 65.
Ikatan kovalen manakah yang disebut ikatan -dan ikatan -yang mana? Jelaskan struktur molekul nitrogen dengan contoh.
Larutan:
Ikatan yang terbentuk karena tumpang tindih sepanjang garis yang menghubungkan dua atom disebut -ikatan (ikatan sederhana apa pun) atau “Jika tumpang tindih orbital atom terjadi pada sumbu antar inti, maka terbentuklah ikatan sigma (-koneksi). Ikatan sigma terbentuk dari tumpang tindih dua orbital s (ikatan s - s), satu orbital s dan satu orbital p (ikatan s - p), dua orbital p (ikatan p - p), satu orbital s dan satu d ( ikatan s - d), satu orbital p dan satu d (ikatan p - d).
Varian tumpang tindih orbital atom yang mengarah pada pembentukan
C 2s 2 2p 2 C +1e = C -
О 2s 2 2p 4 О -1е = О +
Penjelasan lain tentang pembentukan ikatan rangkap tiga pada molekul CO juga dimungkinkan.
Atom karbon yang tidak tereksitasi memiliki 2 elektron tidak berpasangan, yang dapat membentuk 2 pasangan elektron yang sama dengan 2 elektron atom oksigen yang tidak berpasangan (sesuai dengan mekanisme pertukaran). Namun, 2 pasangan elektron p yang ada dalam atom oksigen dapat membentuk ikatan kimia rangkap tiga, karena atom karbon memiliki satu sel kosong yang dapat menerima pasangan elektron ini.
Ikatan rangkap tiga dibentuk oleh mekanisme donor-akseptor, arah panahnya adalah dari donor oksigen ke akseptor – karbon.
Seperti N 2 - CO memiliki energi disosiasi yang tinggi (1069 kJ), sulit larut dalam air, dan bersifat inert secara kimia. CO adalah gas yang tidak berwarna dan tidak berbau, acuh tak acuh, tidak membentuk garam, dan tidak berinteraksi dengan asam basa dan air dalam kondisi normal. Beracun, karena berinteraksi dengan zat besi, yang merupakan bagian dari hemoglobin. Ketika suhu dinaikkan atau disinari, ia menunjukkan sifat-sifat zat pereduksi.
Kuitansi:
di industri
BERSAMA 2 + C « 2CO
2C + O 2 ® 2CO
di laboratorium: H 2 JADI 4, t
HCOOH ® CO + H 2 O;
H2SO4t
H 2 C 2 O 4 ® CO + CO 2 + H 2 O.
CO hanya bereaksi pada suhu tinggi.
Molekul CO memiliki afinitas tinggi terhadap oksigen dan terbakar membentuk CO 2:
CO + 1/2O 2 = CO 2 + 282 kJ/mol.
Karena afinitasnya yang tinggi terhadap oksigen, CO digunakan sebagai zat pereduksi oksida banyak logam berat (Fe, Co, Pb, dll.).
CO + Cl 2 = COCl 2 (fosgen)
CO + NH 3 ® HCN + H 2 O H – C º N
CO + H 2 O « CO 2 + H 2
CO+S®COS
Yang paling menarik adalah karbonil logam (digunakan untuk memperoleh logam murni). Ikatan kimia terjadi menurut mekanisme donor-akseptor; tumpang tindih p terjadi menurut mekanisme datif.
5CO + Fe ® (besi pentakarbonil)
Semua karbonil adalah zat diamagnetik, ditandai dengan kekuatan rendah, ketika dipanaskan, karbonil terurai
→ 4CO + Ni (nikel karbonil).
Seperti CO, karbonil logam bersifat racun.
Ikatan kimia dalam molekul CO 2
Dalam molekul CO2 sp- hibridisasi atom karbon. Dua orbital terhibridisasi sp membentuk 2 ikatan s dengan atom oksigen, dan sisa orbital p karbon yang tidak terhibridisasi membentuk ikatan p dengan dua orbital p atom oksigen, yang terletak pada bidang yang tegak lurus satu sama lain.
O ═ C ═ O
Di bawah tekanan 60 atm. dan pada suhu kamar, CO 2 mengembun menjadi cairan tidak berwarna. Dengan pendinginan yang kuat, CO 2 cair membeku menjadi massa putih seperti salju, menyublim pada P = 1 atm dan t = 195 K (-78 °). Massa padat terkompresi disebut es kering; CO 2 tidak mendukung pembakaran. Hanya zat yang memiliki afinitas lebih tinggi terhadap oksigen daripada karbon yang terbakar di dalamnya: misalnya,
2Mg + CO 2 ® 2MgO + C.
CO 2 bereaksi dengan NH 3:
CO 2 + 2NH 3 = CO(NH 2) 2 + H 2 O
(karbamid, urea)
2СО 2 + 2Na 2 O 2 ® 2Na 2 CO 3 +O 2
Urea terurai oleh air:
CO(NH 2) 2 + 2H 2 O ® (NH 4) 2 CO 3 → 2NH 3 + CO 2
Selulosa adalah karbohidrat yang terdiri dari residu b-glukosa. Ini disintesis pada tanaman sesuai dengan skema berikut
klorofil
6CO 2 + 6H 2 O ® C 6 H 12 O 6 + 6O 2 fotosintesis glukosa
CO 2 diperoleh dengan menggunakan teknologi:
![]()
2NaHCO 3 ® Na 2 CO 3 + H 2 O + CO 2
dari kokas C + O 2 ® CO 2
Di laboratorium (dalam peralatan Kipp):
. 
Asam karbonat dan garamnya
Melarutkan dalam air, karbon dioksida sebagian berinteraksi dengannya, membentuk asam karbonat H 2 CO 3; dalam hal ini keseimbangan ditetapkan:
K 1 = 4 × 10 -7 K 2 = 4,8 × 10 -11 – asam dibasa lemah, tidak stabil, mengandung oksigen. Hidrokarbonat larut dalam H 2 O. Karbonat tidak larut dalam air, kecuali karbonat logam alkali, Li 2 CO 3 dan (NH 4) 2 CO 3. Garam asam dari asam karbonat dibuat dengan melewatkan kelebihan CO 2 ke dalam larutan karbonat berair:
atau dengan secara bertahap (setetes demi setetes) menambahkan asam kuat ke dalam larutan karbonat encer berlebih:
Na 2 CO 3 + HNO 3 ® NaHCO 3 + NaNO 3
Saat berinteraksi dengan alkali atau pemanasan (kalsinasi), garam asam berubah menjadi garam sedang:
Garam dihidrolisis menurut persamaan:
saya panggung
Karena hidrolisis sempurna, karbonat Gr 3+, Al 3+, Ti 4+, Zr 4+, dll. tidak dapat diisolasi dari larutan berair.
Garam yang penting secara praktis adalah Na 2 CO 3 (soda), CaCO 3 (kapur, marmer, batu kapur), K 2 CO 3 (kalium), NaHCO 3 (soda kue), Ca (HCO 3) 2 dan Mg (HCO 3) 2 menentukan kesadahan karbonat air.
Karbon disulfida (CS 2)
Ketika dipanaskan (750-1000°C), karbon bereaksi dengan belerang, membentuk karbon disulfida, pelarut organik (cairan mudah menguap tidak berwarna, zat reaktif), mudah terbakar dan mudah menguap.
![]()
Uap CS 2 beracun, digunakan untuk pengasapan (fumigasi) lumbung terhadap serangga hama, dan dalam kedokteran hewan untuk pengobatan ascariasis pada kuda. Dalam teknologi - pelarut resin, lemak, yodium.
Dengan logam sulfida, CS 2 membentuk garam asam tiokarbonat - tiokarbonat.
Reaksi ini mirip dengan prosesnya
Tiokarbonat– zat kristal kuning. Saat terkena asam, asam tiokarbonat bebas dilepaskan.
Ia lebih stabil dibandingkan H 2 CO 3 dan pada suhu rendah dilepaskan dari larutan dalam bentuk cairan berminyak berwarna kuning yang mudah terurai menjadi:
Senyawa karbon dengan nitrogen (CN) 2 atau C 2 N 2 – cician, gas tidak berwarna yang sangat mudah terbakar. Sianida kering murni dibuat dengan memanaskan sublimat dengan merkuri(II) sianida.
HgCl 2 + Hg(CN) 2 ® Hg 2 Cl 2 + (С N) 2
Cara lain untuk menerima:
4HCN g + O 2 2(CN) 2 +2H 2 O
2HCN g + Cl 2 (CN) 2 + 2HCl
![]()
Cicyanin memiliki sifat yang mirip dengan halogen dalam bentuk molekul X2. Jadi dalam lingkungan basa, seperti halogen, menjadi tidak proporsional:
(CN) 2 + 2NaOH = NaCN + NaOCN
Hidrogen sianida- HCN (), senyawa kovalen, gas yang larut dalam air membentuk asam hidrosianat (cairan tidak berwarna dan garamnya sangat beracun). Menerima:
![]()
Hidrogen sianida diproduksi secara industri melalui reaksi katalitik.
2CH 4 + 3O 2 + 2NH 3 ® 2HCN + 6H 2 O.
Garam asam hidrosianat - sianida - mengalami hidrolisis parah. CN - adalah ion isoelektronik terhadap molekul CO dan termasuk sebagai ligan dalam sejumlah besar kompleks elemen d.
Penanganan sianida memerlukan tindakan pencegahan yang ketat. Di bidang pertanian, mereka digunakan untuk memerangi serangga - hama yang sangat berbahaya.
Sianida diperoleh:
Senyawa karbon dengan bilangan oksidasi negatif:
1) kovalen (SiC karborundum) ![]() ;
;
2) ionkovalen;
3) karbida logam.
Kovalen ionik terurai dengan air, melepaskan gas; tergantung pada jenis gas yang dilepaskan, mereka dibagi menjadi:
metanida(CH 4 dilepaskan)
Al 4 C 3 + 12H 2 O ® 4Al(OH) 3 + 3CH 4
asetilenida(C 2 H 2 dilepaskan)
H 2 C 2 + AgNO 3 ® Ag 2 C 2 + HNO 3
Karbida logam adalah senyawa komposisi stoikiometri yang dibentuk oleh unsur golongan 4, 7, 8 melalui pemasukan atom Me ke dalam kisi kristal karbon.
Kimia silikon
Perbedaan antara kimia silikon dan karbon disebabkan oleh ukuran atomnya yang besar dan kemungkinan penggunaan orbital 3d. Oleh karena itu, ikatan Si – O - Si, Si - F lebih kuat dibandingkan ikatan karbon.
Untuk silikon, oksida dengan komposisi SiO dan SiO 2 diketahui.Silikon monoksida hanya ada dalam fase gas pada suhu tinggi di atmosfer inert; mudah teroksidasi oleh oksigen untuk membentuk oksida SiO 2 yang lebih stabil.
2SiO + О 2 t ® 2SiO 2
SiO2– silika, memiliki beberapa modifikasi kristal. Suhu rendah - kuarsa, memiliki sifat piezoelektrik. Varietas kuarsa alami: kristal batu, topas, batu kecubung. Varietas silika - kalsedon, opal, batu akik, pasir.
Berbagai macam silikat (lebih tepatnya, oksosilikat) telah dikenal. Strukturnya memiliki pola yang sama: semuanya terdiri dari SiO 4 4 tetrahedra, yang dihubungkan satu sama lain melalui atom oksigen.
Kombinasi tetrahedra dapat dihubungkan menjadi rantai, pita, jaring dan bingkai.
Silikat alami yang penting adalah bedak 3MgO×H 2 O×4SiO 2, asbes 3MgO×2H 2 O×2SiO 2.
Seperti SiO 2, silikat dicirikan oleh keadaan seperti kaca (amorf). Dengan kristalisasi terkontrol, dimungkinkan untuk memperoleh keadaan kristal halus - keramik kaca - bahan dengan kekuatan yang meningkat. Aluminosilikat umum ditemukan di alam—ortosilikat kerangka; beberapa atom Si digantikan oleh Al, misalnya Na 12 [(Si,Al)O 4 ] 12.
Halida yang paling tahan lama, SiF 4, hanya terurai di bawah pengaruh aliran listrik.
Asam heksafluorosilikat (kekuatannya mendekati H 2 SO 4).
(SiS 2) n – zat polimer, terurai dengan air:
Asam silikat.
Asam silikat SiO 2 yang sesuai tidak memiliki komposisi tertentu, biasanya ditulis dalam bentuk xH 2 O ySiO 2 - senyawa polimer
Diketahui:
H 2 SiO 3 (H 2 O×SiO 2) – metasilikon (sebenarnya tidak ada)
H 4 SiO 4 (2H 2 O×SiO 2) – ortosilikon (yang paling sederhana sebenarnya hanya ada dalam larutan)
H 2 Si 2 O 5 (H 2 O×2SiO 2) – dimetasilikon.
Asam silikat adalah zat yang sukar larut; H 4 SiO 4 dicirikan oleh keadaan koloid, seperti asam yang lebih lemah dari asam karbonat (Si lebih sedikit logam daripada C).
Dalam larutan berair, terjadi kondensasi asam ortosilikat, menghasilkan pembentukan asam polisilat.

Silikat adalah garam asam silikat, tidak larut dalam air, kecuali silikat logam alkali.
Silikat terlarut terhidrolisis menurut persamaan
Larutan garam natrium dari asam polisilat yang berbentuk jeli disebut “gelas cair”. Banyak digunakan sebagai lem silikat dan sebagai pengawet kayu.
Dengan menggabungkan Na 2 CO 3 , CaCO 3 dan SiO 2 , diperoleh kaca, yang merupakan larutan garam asam polisilat yang sangat dingin.
6SiO 2 + Na 2 CO 3 + CaCO 3 ® Na 2 O × CaO × 6SiO 2 + 2CO 2 Silikat ditulis sebagai oksida campuran.
Silikat paling banyak digunakan dalam konstruksi. Tempat pertama di dunia dalam produksi produk silikat - semen, ke-2 - batu bata, ke-3 - kaca.
Keramik bangunan – ubin menghadap, pipa keramik. Untuk pembuatan produk sanitasi - kaca, porselen, gerabah, keramik tanah liat.
Ikatan kimia.
penentuan ikatan kimia;
jenis ikatan kimia;
metode ikatan valensi;
ciri-ciri dasar ikatan kovalen;
mekanisme pembentukan ikatan kovalen;
senyawa kompleks;
metode orbital molekul;
interaksi antarmolekul.
DEFINISI OBLIGASI KIMIA
Ikatan kimia disebut interaksi antar atom, yang mengarah pada pembentukan molekul atau ion dan ikatan kuat atom-atom di dekat satu sama lain.
Ikatan kimia bersifat elektronik, yaitu terjadi karena interaksi elektron valensi. Tergantung pada distribusi elektron valensi dalam molekul, jenis ikatan berikut dibedakan: ionik, kovalen, logam, dll. Ikatan ionik dapat dianggap sebagai kasus ekstrim dari ikatan kovalen antara atom-atom yang sifatnya sangat berbeda.
JENIS-JENIS OBLIGASI KIMIA
Ikatan ionik.
Ketentuan dasar teori modern ikatan ion.
Ikatan ionik terbentuk selama interaksi unsur-unsur yang sifatnya sangat berbeda satu sama lain, yaitu antara logam dan non-logam.
Pembentukan ikatan kimia dijelaskan oleh keinginan atom untuk mencapai kulit terluar delapan elektron yang stabil (s 2 p 6).
Ca: 1s 2 2s 2 hal 6 3s 2 hal 6 4s 2
 Ca 2+ : 1s 2 2s 2 hal 6 3 detik 2
P 6
Ca 2+ : 1s 2 2s 2 hal 6 3 detik 2
P 6
Kl: 1s 2 2s 2 hal 6 3s 2 hal 5
 Cl – : 1s 2 2s 2 hal 6 3 detik 2
P 6
Cl – : 1s 2 2s 2 hal 6 3 detik 2
P 6
Ion-ion yang bermuatan berlawanan akan saling berdekatan karena adanya gaya tarik-menarik elektrostatis.
Ikatan ionik tidak terarah.
Tidak ada ikatan ion murni. Karena energi ionisasi lebih besar daripada energi afinitas elektron, transfer elektron lengkap tidak terjadi bahkan dalam kasus sepasang atom dengan perbedaan keelektronegatifan yang besar. Oleh karena itu, kita dapat membicarakan tentang fraksi ionisitas ikatan. Ionisitas tertinggi dari ikatan terjadi pada fluorida dan klorida dari unsur s. Jadi, dalam kristal RbCl, KCl, NaCl dan NaF masing-masing adalah 99, 98, 90 dan 97%.
Ikatan kovalen.
Ketentuan dasar teori modern tentang ikatan kovalen.
Ikatan kovalen terbentuk antara unsur-unsur yang mempunyai sifat serupa, yaitu nonlogam.
Setiap unsur menyediakan 1 elektron untuk pembentukan ikatan, dan putaran elektron harus antiparalel.
Jika ikatan kovalen dibentuk oleh atom-atom dari unsur yang sama, maka ikatan tersebut tidak polar, yaitu pasangan elektron yang sama tidak berpindah ke atom mana pun. Jika ikatan kovalen dibentuk oleh dua atom yang berbeda, maka pasangan elektron yang sama dialihkan ke atom yang paling elektronegatif, hal ini ikatan kovalen polar.
Ketika ikatan kovalen terbentuk, awan elektron dari atom-atom yang berinteraksi saling tumpang tindih; akibatnya, zona peningkatan kerapatan elektron muncul di ruang antar atom, menarik inti atom yang berinteraksi yang bermuatan positif dan menjaganya tetap dekat satu sama lain. Akibatnya energi sistem berkurang (Gbr. 14). Namun, ketika atom-atom berada sangat berdekatan, gaya tolak menolak inti atom meningkat. Oleh karena itu, terdapat jarak optimal antar inti ( panjang tautan,aku sv), dimana sistem mempunyai energi minimal. Dalam keadaan ini, energi dilepaskan, yang disebut energi ikat - E St.

Beras. 14. Ketergantungan energi sistem dua atom hidrogen dengan spin paralel (1) dan antiparalel (2) pada jarak antar inti (E adalah energi sistem, E adalah energi ikat, r adalah jarak antar inti). inti, aku– panjang komunikasi).
Untuk menggambarkan ikatan kovalen, digunakan dua metode: metode ikatan valensi (VB) dan metode orbital molekul (MMO).
METODE OBLIGASI VALENSI.
Metode BC didasarkan pada ketentuan sebagai berikut:
1. Ikatan kimia kovalen dibentuk oleh dua elektron dengan spin berlawanan, dan pasangan elektron ini dimiliki oleh dua atom. Kombinasi ikatan dua pusat dua elektron yang mencerminkan struktur elektronik molekul disebut skema valensi.
2. Semakin kuat ikatan kovalen, semakin banyak awan elektron yang berinteraksi yang tumpang tindih.
Untuk menggambarkan skema valensi secara visual, biasanya digunakan metode berikut: elektron yang terletak di lapisan elektron terluar ditandai dengan titik-titik yang terletak di sekitar simbol kimia atom. Elektron yang digunakan bersama oleh dua atom ditunjukkan oleh titik-titik yang ditempatkan di antara simbol kimianya; ikatan rangkap dua atau rangkap tiga masing-masing ditunjukkan oleh dua atau tiga pasang titik persekutuan:
N: 1s 2 2 detik 2
P 3
;

C: 1s 2 2 detik 2 P 4
Dari diagram di atas jelas bahwa setiap pasangan elektron yang menghubungkan dua atom berhubungan dengan satu garis yang menggambarkan ikatan kovalen dalam rumus struktur:

Banyaknya pasangan elektron yang sama yang menghubungkan suatu atom suatu unsur dengan atom lain, atau dengan kata lain, jumlah ikatan kovalen yang dibentuk oleh suatu atom, disebut kovalensi menurut metode BC. Jadi, kovalen hidrogen adalah 1, dan nitrogen adalah 3.
Menurut metode tumpang tindih awan elektron, ikatan ada dua jenis: - koneksi dan - koneksi.
- ikatan terjadi ketika dua awan elektron tumpang tindih sepanjang sumbu yang menghubungkan inti atom.
Beras. 15. Skema pembentukan - koneksi.
- ikatan terbentuk ketika awan elektron tumpang tindih di kedua sisi garis yang menghubungkan inti atom yang berinteraksi.

Beras. 16. Skema pembentukan - koneksi.
KARAKTERISTIK DASAR IKATAN KOVALEN.
1. Panjang tautan, ℓ. Ini adalah jarak minimum antara inti atom yang berinteraksi, yang sesuai dengan keadaan paling stabil dari sistem.
2. Energi ikatan, E min - ini adalah jumlah energi yang harus dikeluarkan untuk memutus ikatan kimia dan mengeluarkan atom melampaui batas interaksi.
3. Momen sambungan dipol,  ,=qℓ. Momen dipol berfungsi sebagai ukuran kuantitatif polaritas suatu molekul. Untuk molekul nonpolar momen dipolnya adalah 0, untuk molekul nonpolar tidak sama dengan 0. Momen dipol molekul poliatomik sama dengan jumlah vektor dipol ikatan individu:
,=qℓ. Momen dipol berfungsi sebagai ukuran kuantitatif polaritas suatu molekul. Untuk molekul nonpolar momen dipolnya adalah 0, untuk molekul nonpolar tidak sama dengan 0. Momen dipol molekul poliatomik sama dengan jumlah vektor dipol ikatan individu:

4. Ikatan kovalen dicirikan oleh arah. Arah ikatan kovalen ditentukan oleh kebutuhan tumpang tindih maksimum dalam ruang awan elektron dari atom-atom yang berinteraksi, yang mengarah pada pembentukan ikatan terkuat.
Karena ikatan ini berorientasi ketat dalam ruang, bergantung pada komposisi molekulnya, ikatan tersebut dapat berada pada sudut tertentu satu sama lain - sudut seperti itu disebut valensi.
Molekul diatomik memiliki struktur linier. Molekul poliatomik memiliki konfigurasi yang lebih kompleks. Mari kita perhatikan geometri berbagai molekul dengan menggunakan contoh pembentukan hidrida.
1. Golongan VI, subgrup utama (kecuali oksigen), H 2 S, H 2 Se, H 2 Te.
S1s 2 2s 2 r 6 3s 2 r 4
Untuk hidrogen, elektron dengan s-AO berpartisipasi dalam pembentukan ikatan, untuk belerang – 3p y dan 3p z. Molekul H2S mempunyai struktur datar dengan sudut antar ikatan 90 0. .

Gambar 17. Struktur molekul H 2 E
2. Hidrida unsur golongan V, subgrup utama: PH 3, AsH 3, SbH 3.
Р 1s 2 2s 2 р 6 3s 2 р 3 .
Berpartisipasi dalam pembentukan ikatan adalah: untuk hidrogen s-AO, untuk fosfor - p y, p x dan p z AO.
Molekul PH 3 berbentuk piramida trigonal (pada alasnya terdapat segitiga).

Gambar 18. Struktur molekul EN 3
5. Saturasi ikatan kovalen adalah jumlah ikatan kovalen yang dapat dibentuk oleh suatu atom. Itu terbatas karena suatu unsur mempunyai jumlah elektron valensi yang terbatas. Jumlah maksimum ikatan kovalen yang dapat dibentuk oleh suatu atom dalam keadaan dasar atau keadaan tereksitasi disebut nya kovalensi.
Contoh: hidrogen bersifat monokovalen, oksigen bersifat bikovalen, nitrogen bersifat trikovalen, dan seterusnya.
Beberapa atom dapat meningkatkan kovalensinya dalam keadaan tereksitasi dengan memisahkan pasangan elektron.
Contoh. Menjadi 0 1s 2 2 detik 2

Sebuah atom berilium dalam keadaan tereksitasi memiliki satu elektron valensi pada 2p-AO dan satu elektron pada 2s-AO, yaitu kovalen Be 0 = 0 dan kovalen Be* = 2. Selama interaksi, terjadi hibridisasi orbital.
Hibridisasi- ini adalah pemerataan energi AO yang berbeda sebagai hasil pencampuran sebelum interaksi kimia. Hibridisasi adalah teknik bersyarat yang memungkinkan seseorang memprediksi struktur molekul menggunakan kombinasi AO. AO yang energinya dekat dapat mengambil bagian dalam hibridisasi.
Setiap jenis hibridisasi berhubungan dengan bentuk geometris molekul tertentu.
Dalam kasus hidrida unsur Golongan II dari subkelompok utama, dua orbital hibrid sp yang identik berpartisipasi dalam pembentukan ikatan. Jenis koneksi ini disebut hibridisasi sp.

Gambar 19. Molekul BeH 2 .sp-Hibridisasi.
Orbital hibrid sp mempunyai bentuk asimetris, bagian AO yang memanjang mengarah ke hidrogen dengan sudut ikatan 180 o. Oleh karena itu, molekul BeH 2 memiliki struktur linier (Gbr.).
Mari kita perhatikan struktur molekul hidrida unsur golongan III subkelompok utama menggunakan contoh pembentukan molekul BH 3.
B 0 1s 2 2 detik 2 P 1

Kovalensi B 0 = 1, kovalen B* = 3.
Tiga orbital hibrid sp mengambil bagian dalam pembentukan ikatan, yang terbentuk sebagai hasil redistribusi kerapatan elektron s-AO dan dua p-AO. Jenis koneksi ini disebut sp 2 - hibridisasi. Sudut ikatan pada sp 2 - hibridisasi adalah 120 0, sehingga molekul BH 3 mempunyai struktur segitiga datar.

Gambar.20. Molekul BH3. sp 2 -Hibridisasi.
Dengan menggunakan contoh pembentukan molekul CH 4, mari kita perhatikan struktur molekul hidrida unsur golongan IV subkelompok utama.
C 0 1s 2 2 detik 2 P 2

Kovalensi C0 = 2, kovalensi C* = 4.
Dalam karbon, empat orbital hibrid sp berpartisipasi dalam pembentukan ikatan kimia, yang terbentuk sebagai hasil redistribusi kerapatan elektron antara s-AO dan tiga p-AO. Bentuk molekul CH 4 adalah tetrahedron, sudut ikatan 109°28`.

Beras. 21. Molekul CH 4 .sp 3 -Hibridisasi.
Pengecualian terhadap aturan umum adalah molekul H 2 O dan NH 3.
Dalam molekul air, sudut antar ikatan adalah 104,5 derajat. Tidak seperti hidrida unsur lain dalam golongan ini, air memiliki sifat khusus: bersifat polar dan diamagnetik. Semua ini dijelaskan oleh fakta bahwa jenis ikatan dalam molekul air adalah sp 3. Artinya, empat orbital sp - hibrid berpartisipasi dalam pembentukan ikatan kimia. Dua orbital masing-masing berisi satu elektron, orbital ini berinteraksi dengan hidrogen, dan dua orbital lainnya berisi sepasang elektron. Kehadiran kedua orbital ini menjelaskan sifat unik air.
Pada molekul amonia sudut antar ikatan kurang lebih 107,3 o, yaitu bentuk molekul amonia adalah tetrahedron, jenis ikatan sp 3. Empat orbital hibrid sp 3 berperan dalam pembentukan ikatan pada molekul nitrogen. Tiga orbital masing-masing berisi satu elektron; orbital ini berasosiasi dengan hidrogen; AO keempat berisi pasangan elektron bebas, yang menentukan keunikan molekul amonia.
MEKANISME PEMBENTUKAN OBLIGASI KOVALEN.
MBC memungkinkan seseorang untuk membedakan tiga mekanisme pembentukan ikatan kovalen: pertukaran, donor-akseptor, dan datif.
Mekanisme pertukaran. Ini mencakup kasus-kasus pembentukan ikatan kimia ketika masing-masing dari dua atom yang terikat melepaskan satu elektron untuk digunakan bersama, seolah-olah menukarnya. Untuk mengikat inti dua atom, elektron harus berada di ruang antar inti. Daerah dalam molekul ini disebut daerah pengikatan (daerah di mana pasangan elektron paling mungkin berada di dalam molekul). Agar pertukaran elektron tidak berpasangan antar atom dapat terjadi, orbital atom harus tumpang tindih (Gbr. 10,11). Ini adalah tindakan mekanisme pertukaran pembentukan ikatan kimia kovalen. Orbital atom dapat tumpang tindih hanya jika mereka memiliki sifat simetri yang sama terhadap sumbu antar inti (Gbr. 10, 11, 22).

Beras. 22. Tumpang tindih AO, yang tidak menyebabkan terbentuknya ikatan kimia.
Mekanisme donor-akseptor dan datif.
Mekanisme donor-akseptor melibatkan transfer pasangan elektron bebas dari satu atom ke orbital atom kosong di atom lain. Misalnya pembentukan ion - :

P-AO yang kosong pada atom boron pada molekul BF 3 menerima sepasang elektron dari ion fluorida (donor). Dalam anion yang dihasilkan, empat ikatan kovalen B-F memiliki panjang dan energi yang sama. Dalam molekul aslinya, ketiga ikatan B-F dibentuk melalui mekanisme pertukaran.
Atom yang kulit terluarnya hanya terdiri dari elektron s atau p dapat menjadi donor atau akseptor pasangan elektron bebas. Atom yang elektron valensinya terletak di atas d-AO dapat bertindak sebagai donor dan akseptor secara bersamaan. Untuk membedakan kedua mekanisme ini, konsep mekanisme datif pembentukan ikatan diperkenalkan.
Contoh paling sederhana dari mekanisme datif adalah interaksi dua atom klor.
Dua atom klor dalam molekul klor membentuk ikatan kovalen melalui mekanisme pertukaran, menggabungkan elektron 3p yang tidak berpasangan. Selain itu, atom Cl- 1 mentransfer pasangan elektron bebas 3р 5 - AO ke atom Cl- 2 ke 3d-AO yang kosong, dan atom Cl- 2 mentransfer pasangan elektron yang sama ke 3d-AO yang kosong dari atom Cl- 1. Setiap atom secara bersamaan menjalankan fungsi akseptor dan donor. Ini adalah mekanisme datif. Kerja mekanisme datif meningkatkan kekuatan ikatan, sehingga molekul klor lebih kuat dibandingkan molekul fluor.
KONEKSI KOMPLEKS.
Menurut prinsip mekanisme donor-akseptor, sejumlah besar senyawa kimia kompleks terbentuk - senyawa kompleks.
Senyawa kompleks adalah senyawa yang mengandung ion kompleks yang mampu berada baik dalam bentuk kristal maupun larutan, termasuk ion pusat atau atom yang terikat dengan ion bermuatan negatif atau molekul netral melalui ikatan kovalen yang dibentuk melalui mekanisme donor-akseptor.
Struktur senyawa kompleks menurut Werner.
Senyawa kompleks terdiri dari bola dalam (ion kompleks) dan bola luar. Hubungan antara ion-ion pada bola bagian dalam terjadi melalui mekanisme donor-akseptor. Akseptor disebut zat pengompleks; seringkali berupa ion logam positif (kecuali logam golongan IA) yang mempunyai orbital kosong. Kemampuan untuk membentuk kompleks meningkat seiring dengan meningkatnya muatan ion dan ukurannya berkurang.
Donor pasangan elektron disebut ligan atau tambahan. Ligan adalah molekul netral atau ion bermuatan negatif. Jumlah ligan ditentukan oleh bilangan koordinasi zat pengompleks, yang biasanya sama dengan dua kali valensi ion pengompleks. Ligan dapat bersifat monodentan atau polidentan. Dentensi suatu ligan ditentukan oleh jumlah situs koordinasi yang ditempati ligan dalam bidang koordinasi zat pengompleks. Misalnya, F - adalah ligan monodentat, S 2 O 3 2- adalah ligan bidentat. Muatan bola bagian dalam sama dengan jumlah aljabar muatan ion-ion penyusunnya. Jika bola bagian dalam mempunyai muatan negatif, maka ia merupakan kompleks anionik; jika positif, ia merupakan kompleks kationik. Kompleks kationik disebut dengan nama ion pengompleks dalam bahasa Rusia; dalam kompleks anionik, zat pengompleks disebut dalam bahasa Latin dengan penambahan akhiran - pada. Hubungan antara bola luar dan dalam dalam suatu senyawa kompleks bersifat ionik.
Contoh: K 2 – kalium tetrahydroxozincate, kompleks anionik.
2- - bola bagian dalam
2K+ - bola luar
Zn 2+ - zat pengompleks
OH – - ligan
nomor koordinasi – 4
hubungan antara bola luar dan dalam bersifat ionik:
K 2 = 2K + + 2- .
ikatan antara ion Zn 2+ dan gugus hidroksil bersifat kovalen, terbentuk menurut mekanisme donor-akseptor: OH - donor, Zn 2+ - akseptor.
Zn 0: … 3d 10 4s 2
Zn 2+ : … 3d 10 4s 0 hal 0 d 0

Jenis senyawa kompleks:
1. Senyawa amonia adalah ligan dari molekul amonia.
Cl 2 – tetraamina tembaga (II) klorida. Senyawa amonia dihasilkan oleh aksi amonia pada senyawa yang mengandung zat pengompleks.
2. Senyawa hidrokso - OH - ligan.
Na – natrium tetrahidroksialuminat. Kompleks hidrokso diperoleh dengan aksi alkali berlebih pada logam hidroksida, yang memiliki sifat amfoter.
3. Aqua kompleks adalah ligan molekul air.
Cl 3 – heksaaquakrom (III) klorida. Aqua kompleks diperoleh dengan mereaksikan garam anhidrat dengan air.
4. Kompleks asam - ligan anion asam - Cl - , F - , CN - , SO 3 2- , I – , NO 2 – , C 2 O 4 – dst.
K 4 – kalium heksasianoferrat (II). Dibuat dengan mereaksikan kelebihan garam yang mengandung ligan dengan garam yang mengandung zat pengompleks.
METODE ORBITAL MOLEKULER.
MBC menjelaskan pembentukan dan struktur banyak molekul dengan cukup baik, namun metode ini tidak universal. Misalnya, metode ikatan valensi tidak memberikan penjelasan yang memuaskan mengenai keberadaan ion  , meskipun pada akhir abad ke-19 keberadaan molekul ion hidrogen yang cukup kuat telah diketahui
, meskipun pada akhir abad ke-19 keberadaan molekul ion hidrogen yang cukup kuat telah diketahui  : Energi pemutusan ikatan di sini adalah 2,65 eV. Namun, tidak ada pasangan elektron yang dapat terbentuk dalam kasus ini, karena komposisinya adalah ion
: Energi pemutusan ikatan di sini adalah 2,65 eV. Namun, tidak ada pasangan elektron yang dapat terbentuk dalam kasus ini, karena komposisinya adalah ion  hanya satu elektron yang disertakan.
hanya satu elektron yang disertakan.
Metode orbital molekul (MMO) memungkinkan seseorang menjelaskan sejumlah kontradiksi yang tidak dapat dijelaskan dengan metode ikatan valensi.
Ketentuan dasar MMO.
Ketika dua orbital atom berinteraksi, dua orbital molekul terbentuk. Oleh karena itu, ketika orbital n-atom berinteraksi, orbital n-molekul terbentuk.
Elektron dalam suatu molekul dimiliki secara merata oleh semua inti molekul.
Dari dua orbital molekul yang terbentuk, salah satu mempunyai energi yang lebih rendah dari orbital aslinya, ini adalah orbital molekul ikatan, yang lain memiliki energi lebih tinggi dari yang asli, ini orbital molekul anti ikatan.
MMO menggunakan diagram energi yang tidak berskala.
Saat mengisi sublevel energi dengan elektron, aturan yang sama digunakan untuk orbital atom:
prinsip energi minimum, yaitu. sublevel dengan energi lebih rendah diisi terlebih dahulu;
Prinsip Pauli: pada setiap sublevel energi tidak boleh terdapat lebih dari dua elektron dengan spin antiparalel;
Aturan Hund: pengisian sublevel energi terjadi sedemikian rupa sehingga putaran totalnya maksimal.
Multiplisitas komunikasi. Multiplisitas komunikasi dalam MMO ditentukan dengan rumus:
 , ketika K p = 0, tidak ada ikatan yang terbentuk.
, ketika K p = 0, tidak ada ikatan yang terbentuk.
Contoh.
1. Bisakah molekul H2 ada?

Beras. 23. Skema pembentukan molekul hidrogen H2.
Kesimpulan: molekul H2 akan ada karena multiplisitas ikatan Kp > 0.
2. Bisakah molekul He 2 ada?

Beras. 24. Skema pembentukan molekul helium He 2.
Kesimpulan: molekul He 2 tidak akan ada, karena multiplisitas ikatan Kp = 0.
3. Apakah partikel H 2+ ada?

Beras. 25. Skema pembentukan partikel H2+.
Partikel H 2+ dapat eksis karena multiplisitas ikatan Kp > 0.
4. Bisakah molekul O2 ada?

Beras. 26. Skema pembentukan molekul O2.
Molekul O 2 ada. Dari Gambar 26 dapat disimpulkan bahwa molekul oksigen memiliki dua elektron tidak berpasangan. Karena dua elektron ini, molekul oksigen bersifat paramagnetik.
Jadi, metode orbital molekul menjelaskan sifat magnetik molekul.
INTERAKSI INTERMOLEKULER.
Semua interaksi antarmolekul dapat dibagi menjadi dua kelompok: universal Dan spesifik. Yang universal muncul di semua molekul tanpa kecuali. Interaksi ini sering disebut koneksi atau gaya van der Waals. Meskipun gaya-gaya ini lemah (energinya tidak melebihi delapan kJ/mol), gaya-gaya ini menyebabkan transisi sebagian besar zat dari wujud gas ke wujud cair, adsorpsi gas pada permukaan benda padat, dan fenomena lainnya. Sifat gaya-gaya ini adalah elektrostatis.
Kekuatan interaksi utama:
1). Interaksi dipol – dipol (orientasi). ada di antara molekul-molekul polar.
Semakin besar momen dipol, semakin kecil jarak antar molekul, dan semakin rendah suhu, semakin besar interaksi orientasinya. Oleh karena itu, semakin besar energi interaksi ini, semakin tinggi suhu yang harus dipanaskan agar zat tersebut mendidih.
2). Interaksi induktif terjadi jika ada kontak antara molekul polar dan nonpolar dalam suatu zat. Dipol diinduksi dalam molekul nonpolar sebagai akibat interaksi dengan molekul polar.
Cl + - Cl - … Al + Cl - 3
Energi interaksi ini meningkat seiring dengan meningkatnya kemampuan polarisasi molekul, yaitu kemampuan molekul membentuk dipol di bawah pengaruh medan listrik. Energi interaksi induktif jauh lebih kecil dibandingkan energi interaksi dipol-dipol.
3). Interaksi dispersi- ini adalah interaksi molekul non-polar akibat dipol sesaat yang timbul akibat fluktuasi kerapatan elektron dalam atom.
Dalam rangkaian zat yang sejenis, interaksi dispersi meningkat seiring dengan bertambahnya ukuran atom penyusun molekul zat tersebut.
4) Kekuatan menjijikkan disebabkan oleh interaksi awan elektron molekul dan muncul ketika mereka mendekat lebih jauh.
Interaksi antarmolekul spesifik mencakup semua jenis interaksi yang bersifat donor-akseptor, yaitu terkait dengan transfer elektron dari satu molekul ke molekul lainnya. Ikatan antarmolekul yang terbentuk dalam hal ini memiliki semua ciri khas ikatan kovalen: saturasi dan arah.
Ikatan kimia yang dibentuk oleh hidrogen terpolarisasi positif yang merupakan bagian dari gugus atau molekul polar dan atom elektronegatif dari molekul lain atau molekul yang sama disebut ikatan hidrogen. Misalnya, molekul air dapat direpresentasikan sebagai berikut:

Garis padat adalah ikatan polar kovalen di dalam molekul air antara atom hidrogen dan oksigen; titik menunjukkan ikatan hidrogen. Alasan pembentukan ikatan hidrogen adalah karena atom hidrogen praktis tidak memiliki kulit elektron: satu-satunya elektron di dalamnya dipindahkan ke atom oksigen dalam molekulnya. Hal ini memungkinkan proton, tidak seperti kation lain, mendekati inti atom oksigen molekul tetangganya tanpa mengalami tolakan dari kulit elektron atom oksigen.
Ikatan hidrogen dicirikan oleh energi ikat 10 hingga 40 kJ/mol. Namun, energi ini cukup untuk menimbulkan asosiasi molekul, itu. asosiasi mereka menjadi dimer atau polimer, yang dalam beberapa kasus tidak hanya ada dalam keadaan cair suatu zat, tetapi juga dipertahankan ketika diubah menjadi uap.
Misalnya, hidrogen fluorida dalam fase gas ada dalam bentuk dimer.

Dalam molekul organik kompleks, terdapat ikatan hidrogen antarmolekul dan ikatan hidrogen intramolekul.

Molekul dengan ikatan hidrogen intramolekul tidak dapat membentuk ikatan hidrogen antarmolekul. Oleh karena itu, zat dengan ikatan tersebut tidak membentuk asosiasi, lebih mudah menguap, dan memiliki viskositas, titik leleh dan titik didih yang lebih rendah dibandingkan isomernya yang mampu membentuk ikatan hidrogen antarmolekul.
BC Leon adalah bandar taruhan online terkemuka di pasar perjudian. Perusahaan memberikan perhatian khusus pada kelancaran layanan. Fungsionalitas portal juga terus ditingkatkan. Untuk kenyamanan pengguna, mirror Leon telah dibuat.
Pergi ke cermin
Apa itu cermin Leon.
Untuk mendapatkan akses ke portal resmi BC Leon, Anda perlu menggunakan mirror. Cermin yang berfungsi memberi pengguna banyak keuntungan seperti:
- beragam acara olahraga yang memiliki peluang tinggi;
- memberikan kesempatan bermain dalam mode Live, menonton pertandingan akan menjadi pengalaman yang menarik;
- materi detail mengenai kompetisi yang diadakan;
- antarmuka yang nyaman yang bahkan pengguna yang tidak berpengalaman pun dapat dengan cepat memahaminya.
Cermin yang berfungsi adalah salinan dari portal resmi. Ini memiliki fungsionalitas yang identik dan database yang sinkron. Oleh karena itu, informasi akun Anda tidak berubah. Pengembang telah menyediakan kemampuan untuk memblokir cermin yang berfungsi, dalam kasus seperti itu, sesuatu yang lain disediakan. Salinan persisnya dikirim dan dikendalikan oleh karyawan BC Leon. Jika Anda menggunakan mirror yang berfungsi, Anda dapat mengakses portal resmi BC Leon.
Pengguna tidak akan kesulitan menemukan mirror, karena daftarnya dapat diperbarui. Dengan akses tertutup, pengunjung situs diharuskan menginstal aplikasi ponsel Leon di komputer. Anda juga perlu mengubah IP Anda ke negara lain menggunakan VPN. Untuk mengubah lokasi pengguna atau penyedia, Anda perlu menggunakan browser TOP.
Pengembang telah menyediakan berbagai kemungkinan untuk menggunakan mirror. Untuk melakukan ini, di sisi kanan situs terdapat tulisan "Akses ke situs"; tombol hijau "Lewati pemblokiran" memungkinkan pemain untuk membuka submenu dan menambahkan bookmark universal ke browser.
Aplikasi mobile juga memberikan kemudahan kepada pengguna. Jika Anda perlu mencari tahu tentang alamat baru portal mirror, Anda dapat menghubungi nomor bebas pulsa. Saluran @leonbets_official di Telegram memungkinkan Anda mengakses mirror. Aplikasi Leonacsess untuk Windows memungkinkan Anda untuk selalu mengakses situs. Metode ini memungkinkan pemain untuk mendapatkan akses ke cermin yang berfungsi.
Mengapa situs utama Leon diblokir?
Hal ini disebabkan oleh tindakan layanan Roskomnadzor. Hal ini disebabkan kurangnya izin untuk melakukan kegiatan taruhan. Blue Leon tidak menerima lisensi sehingga pemain tidak membayar 13% atas kemenangannya.
Cara mendaftar di mirror Leonbets
Mendaftar di situs ini jauh lebih mudah daripada secara resmi. Pengguna tidak perlu mendaftar di dua portal, yang memakan waktu hingga dua hari. Jika Anda memberi preferensi pada cermin yang berfungsi, maka prosedur ini akan sesederhana mungkin.
Untuk melakukan ini, pengguna hanya perlu mengisi informasi mengenai nama lengkap, kontak. Anda juga perlu memutuskan mata uangnya, menunjukkan tanggal lahir dan alamat rumah Anda. Anda juga perlu berlangganan buletin. Ini akan memungkinkan Anda menerima informasi dengan cepat dari bandar taruhan. Pengguna terdaftar mendapat kesempatan untuk memiliki akses ke akun pribadinya, yang memungkinkan dia memasang taruhan pada pertandingan dan acara. Jika timbul kesulitan, Anda dapat menghubungi dukungan teknis.
Topik Pengkode Ujian Negara Bersatu: Ikatan kimia kovalen, ragamnya dan mekanisme pembentukannya. Ciri-ciri ikatan kovalen (polaritas dan energi ikatan). Ikatan ionik. Sambungan logam. Ikatan hidrogen
Ikatan kimia intramolekul
Pertama, mari kita lihat ikatan yang timbul antar partikel dalam molekul. Koneksi seperti itu disebut intramolekul.
Ikatan kimia antar atom unsur kimia mempunyai sifat elektrostatis dan terbentuk karena interaksi elektron eksternal (valensi)., pada tingkat yang lebih atau kurang dipegang oleh inti bermuatan positif atom yang terikat.
Konsep kuncinya di sini adalah ELEKTRONEGATIVITAS. Hal inilah yang menentukan jenis ikatan kimia antar atom dan sifat-sifat ikatan tersebut.
adalah kemampuan suatu atom untuk menarik (menahan) luar(valensi) elektron. Keelektronegatifan ditentukan oleh derajat tarik-menarik elektron terluar ke inti dan terutama bergantung pada jari-jari atom dan muatan inti.
Keelektronegatifan sulit ditentukan dengan jelas. L. Pauling menyusun tabel keelektronegatifan relatif (berdasarkan energi ikatan molekul diatomik). Unsur yang paling elektronegatif adalah fluor dengan makna 4 .
Penting untuk dicatat bahwa dalam sumber yang berbeda Anda dapat menemukan skala dan tabel nilai keelektronegatifan yang berbeda. Hal ini tidak perlu dikhawatirkan, karena pembentukan ikatan kimia berperan atom, dan kira-kira sama di sistem mana pun.
Jika salah satu atom pada ikatan kimia A:B menarik elektron lebih kuat, maka pasangan elektron akan bergerak ke arahnya. Lebih perbedaan keelektronegatifan atom, semakin banyak pergeseran pasangan elektron.
Jika keelektronegatifan atom-atom yang berinteraksi sama atau kira-kira sama: EO(A)≈EO(B), maka pasangan elektron yang sama tidak berpindah ke atom mana pun: J: B. Koneksi ini disebut kovalen nonpolar.
Jika keelektronegatifan atom-atom yang berinteraksi berbeda, tetapi tidak terlalu besar (perbedaan keelektronegatifan kira-kira 0,4 hingga 2: 0,4<ΔЭО<2 ), kemudian pasangan elektron dipindahkan ke salah satu atom. Koneksi ini disebut polar kovalen .
Jika keelektronegatifan atom-atom yang berinteraksi berbeda secara signifikan (perbedaan keelektronegatifan lebih besar dari 2: ΔEO>2), kemudian salah satu elektron hampir seluruhnya berpindah ke atom lain, dengan pembentukan ion. Koneksi ini disebut ionik.
Jenis dasar ikatan kimia - kovalen, ionik Dan logam komunikasi. Mari kita lihat lebih dekat.
Ikatan kimia kovalen
Ikatan kovalen – itu adalah ikatan kimia , terbentuk karena pembentukan pasangan elektron bersama A:B . Apalagi dua atom tumpang tindih orbital atom. Ikatan kovalen dibentuk oleh interaksi atom-atom dengan perbedaan keelektronegatifan yang kecil (biasanya antara dua non-logam) atau atom dari satu unsur.
Sifat dasar ikatan kovalen
- fokus,
- saturasi,
- polaritas,
- kemampuan polarisasi.
Sifat ikatan ini mempengaruhi sifat kimia dan fisik suatu zat.
Arah komunikasi mencirikan struktur kimia dan bentuk zat. Sudut antara dua ikatan disebut sudut ikatan. Misalnya, dalam molekul air sudut ikatan H-O-H adalah 104,45 o, maka molekul air bersifat polar, dan dalam molekul metana sudut ikatan H-C-H adalah 108 o 28′.

Saturasi adalah kemampuan atom untuk membentuk ikatan kimia kovalen dalam jumlah terbatas. Banyaknya ikatan yang dapat dibentuk suatu atom disebut.
Polaritas Ikatan terjadi karena distribusi kerapatan elektron yang tidak merata antara dua atom yang keelektronegatifannya berbeda. Ikatan kovalen dibagi menjadi polar dan nonpolar.
Polarisasi koneksi adalah kemampuan elektron ikatan untuk bergeser di bawah pengaruh medan listrik eksternal(khususnya, medan listrik partikel lain). Polarisabilitas bergantung pada mobilitas elektron. Semakin jauh elektron dari inti, semakin mobile elektron tersebut, sehingga molekul semakin terpolarisasi.

Ikatan kimia kovalen nonpolar
Ada 2 jenis ikatan kovalen – KUTUB Dan NON-POlar .
Contoh . Mari kita perhatikan struktur molekul hidrogen H2. Setiap atom hidrogen pada tingkat energi terluarnya membawa 1 elektron tidak berpasangan. Untuk menampilkan atom, kami menggunakan struktur Lewis - ini adalah diagram struktur tingkat energi terluar suatu atom, ketika elektron ditunjukkan dengan titik. Model struktur titik Lewis cukup membantu ketika menangani unsur periode kedua.
H. + . H = H:H
Jadi, molekul hidrogen memiliki satu pasangan elektron bersama dan satu ikatan kimia H–H. Pasangan elektron ini tidak berpindah ke atom hidrogen mana pun, karena Atom hidrogen memiliki keelektronegatifan yang sama. Koneksi ini disebut kovalen nonpolar .

Ikatan kovalen nonpolar (simetris). adalah ikatan kovalen yang dibentuk oleh atom-atom dengan keelektronegatifan yang sama (biasanya bukan logam yang sama) dan, oleh karena itu, dengan distribusi kerapatan elektron yang seragam di antara inti atom.
Momen dipol ikatan non-polar adalah 0.
Contoh: H 2 (H-H), O 2 (O=O), S 8.
Ikatan kimia kovalen polar
Ikatan kovalen polar adalah ikatan kovalen yang terjadi antara atom yang mempunyai keelektronegatifan berbeda (biasanya, berbagai non-logam) dan dikarakterisasi pemindahan pasangan elektron bersama ke atom yang lebih elektronegatif (polarisasi).
Kerapatan elektron bergeser ke atom yang lebih elektronegatif - oleh karena itu, muatan parsial negatif (δ-) muncul pada atom tersebut, dan muatan parsial positif (δ+, delta +) muncul pada atom yang kurang elektronegatif.
Semakin besar perbedaan keelektronegatifan atom, semakin tinggi polaritas koneksi dan banyak lagi momen dipol . Gaya tarik menarik tambahan bekerja antara molekul tetangga dan muatan yang berlawanan tanda, yang semakin meningkat kekuatan komunikasi.
Polaritas ikatan mempengaruhi sifat fisik dan kimia senyawa. Mekanisme reaksi dan bahkan reaktivitas ikatan tetangga bergantung pada polaritas ikatan. Polaritas koneksi sering kali menentukan polaritas molekul dan dengan demikian secara langsung mempengaruhi sifat fisik seperti titik didih dan titik leleh, kelarutan dalam pelarut polar.
Contoh: HCl, CO2, NH3.
Mekanisme pembentukan ikatan kovalen
Ikatan kimia kovalen dapat terjadi melalui 2 mekanisme:
1. Mekanisme pertukaran pembentukan ikatan kimia kovalen adalah ketika setiap partikel menyediakan satu elektron tidak berpasangan untuk membentuk pasangan elektron yang sama:
A . + . B= SEBUAH:B
2. Pembentukan ikatan kovalen adalah mekanisme di mana salah satu partikel menyediakan pasangan elektron bebas, dan partikel lainnya menyediakan orbital kosong untuk pasangan elektron ini:
A: + B= SEBUAH:B

Dalam hal ini, salah satu atom menyediakan pasangan elektron bebas ( penyumbang), dan atom lainnya menyediakan orbital kosong untuk pasangan tersebut ( akseptor). Akibat terbentuknya kedua ikatan tersebut, energi elektron berkurang, yaitu. ini bermanfaat bagi atom.
Ikatan kovalen yang dibentuk oleh mekanisme donor-akseptor tidak berbeda dalam sifat dari ikatan kovalen lain yang dibentuk oleh mekanisme pertukaran. Pembentukan ikatan kovalen melalui mekanisme donor-akseptor merupakan ciri khas atom dengan jumlah elektron yang banyak pada tingkat energi terluar (donor elektron), atau sebaliknya, dengan jumlah elektron yang sangat sedikit (akseptor elektron). Kemampuan valensi atom dibahas lebih rinci di bagian terkait.
Ikatan kovalen dibentuk melalui mekanisme donor-akseptor:
- dalam sebuah molekul karbon monoksida CO(ikatan dalam molekul rangkap tiga, 2 ikatan terbentuk melalui mekanisme pertukaran, satu melalui mekanisme donor-akseptor): C≡O;
- V ion amonium NH 4 +, dalam ion amina organik, misalnya, pada ion metilammonium CH 3 -NH 2 + ;
- V senyawa kompleks, ikatan kimia antara atom pusat dan gugus ligan, misalnya pada natrium tetrahidroksoaluminat, ikatan Na antara ion aluminium dan hidroksida;
- V asam nitrat dan garamnya- nitrat: HNO 3, NaNO 3, dalam beberapa senyawa nitrogen lainnya;

- dalam sebuah molekul ozon O3.
Ciri-ciri dasar ikatan kovalen
Ikatan kovalen biasanya terbentuk antara atom bukan logam. Ciri-ciri utama ikatan kovalen adalah panjang, energi, multiplisitas dan arah.
Banyaknya ikatan kimia
Banyaknya ikatan kimia - Ini jumlah pasangan elektron bersama antara dua atom dalam suatu senyawa. Banyaknya suatu ikatan dapat ditentukan dengan cukup mudah dari nilai atom-atom yang membentuk molekul tersebut.
Misalnya , dalam molekul hidrogen H 2 multiplisitas ikatannya adalah 1, karena Setiap hidrogen hanya memiliki 1 elektron tidak berpasangan pada tingkat energi terluarnya, sehingga terbentuklah satu pasangan elektron bersama.
Dalam molekul oksigen O2, multiplisitas ikatannya adalah 2, karena Setiap atom pada tingkat energi terluar memiliki 2 elektron tidak berpasangan: O=O.
Dalam molekul nitrogen N2, multiplisitas ikatannya adalah 3, karena antara setiap atom terdapat 3 elektron tidak berpasangan pada tingkat energi terluar, dan atom-atom tersebut membentuk 3 pasangan elektron yang sama N≡N.
Panjang ikatan kovalen
Panjang ikatan kimia
adalah jarak antara pusat inti atom yang membentuk ikatan. Itu ditentukan dengan metode fisik eksperimental. Panjang ikatan dapat diperkirakan dengan menggunakan aturan aditif, yang menyatakan bahwa panjang ikatan pada molekul AB kira-kira sama dengan setengah jumlah panjang ikatan pada molekul A 2 dan B 2: 
Panjang ikatan kimia dapat diperkirakan secara kasar dengan jari-jari atom membentuk ikatan, atau oleh multiplisitas komunikasi, jika jari-jari atomnya tidak jauh berbeda.
Dengan bertambahnya jari-jari atom yang membentuk ikatan, panjang ikatan akan bertambah.
Misalnya
Ketika multiplisitas ikatan antar atom meningkat (jari-jari atomnya tidak berbeda atau hanya berbeda sedikit), panjang ikatan akan berkurang.
Misalnya . Pada deret: C–C, C=C, C≡C, panjang ikatannya berkurang.
Energi komunikasi
Ukuran kekuatan ikatan kimia adalah energi ikatan. Energi komunikasi ditentukan oleh energi yang dibutuhkan untuk memutuskan suatu ikatan dan melepaskan atom-atom yang membentuk ikatan tersebut pada jarak yang sangat jauh satu sama lain.
Ikatan kovalen adalah sangat tahan lama. Energinya berkisar dari beberapa puluh hingga beberapa ratus kJ/mol. Semakin tinggi energi ikatan maka semakin besar kekuatan ikatannya, begitu pula sebaliknya.
Kekuatan ikatan kimia bergantung pada panjang ikatan, polaritas ikatan, dan multiplisitas ikatan. Semakin panjang suatu ikatan kimia, semakin mudah putusnya, dan semakin rendah energi ikatannya, semakin rendah kekuatannya. Semakin pendek ikatan kimianya, semakin kuat, dan semakin besar energi ikatannya.
Misalnya, pada rangkaian senyawa HF, HCl, HBr dari kiri ke kanan, kekuatan ikatan kimianya berkurang, Karena Panjang koneksi bertambah.
Ikatan kimia ionik

Ikatan ionik adalah ikatan kimia berdasarkan tarikan elektrostatik ion.
Ion terbentuk dalam proses penerimaan atau sumbangan elektron oleh atom. Misalnya, atom dari semua logam dengan lemah menahan elektron dari tingkat energi terluar. Oleh karena itu, atom logam dicirikan oleh sifat restoratif- kemampuan untuk menyumbangkan elektron.

Contoh. Atom natrium mengandung 1 elektron pada tingkat energi 3. Dengan melepaskannya dengan mudah, atom natrium membentuk ion Na+ yang jauh lebih stabil, dengan konfigurasi elektron gas mulia neon Ne. Ion natrium mengandung 11 proton dan hanya 10 elektron, sehingga muatan total ion tersebut adalah -10+11 = +1:
+11Tidak) 2 ) 8 ) 1 - 1e = +11 Tidak +) 2 ) 8
Contoh. Sebuah atom klor pada tingkat energi terluarnya mengandung 7 elektron. Untuk memperoleh konfigurasi atom argon inert Ar yang stabil, klor perlu memperoleh 1 elektron. Setelah penambahan elektron, ion klorin stabil terbentuk, terdiri dari elektron. Muatan total ion adalah -1:
+17Kl) 2 ) 8 ) 7 + 1e = +17 Kl — ) 2 ) 8 ) 8
Catatan:
- Sifat ion berbeda dengan sifat atom!
- Ion stabil tidak hanya dapat terbentuk atom, tetapi juga kelompok atom. Contoh: ion amonium NH 4 +, ion sulfat SO 4 2-, dll. Ikatan kimia yang dibentuk oleh ion-ion tersebut juga dianggap ionik;
- Ikatan ionik biasanya terbentuk antara satu sama lain logam Dan bukan logam(golongan non-logam);
Ion-ion yang dihasilkan tertarik akibat gaya tarik listrik: Na + Cl -, Na 2 + SO 4 2-.
Mari kita rangkum secara visual perbedaan antara jenis ikatan kovalen dan ionik:


Sambungan logam adalah hubungan yang terbentuk secara relatif elektron bebas di antara ion logam, membentuk kisi kristal.
Atom logam biasanya terletak pada tingkat energi terluar satu hingga tiga elektron. Jari-jari atom logam, pada umumnya, besar - oleh karena itu, atom logam, tidak seperti non-logam, melepaskan elektron terluarnya dengan mudah, mis. merupakan agen pereduksi kuat.
Dengan menyumbangkan elektron, atom logam berubah menjadi ion bermuatan positif . Elektron yang terlepas relatif bebas pindah antara ion logam yang bermuatan positif. Di antara partikel-partikel ini sebuah koneksi muncul, Karena elektron bersama menahan kation logam yang tersusun berlapis-lapis , sehingga menciptakan yang cukup kuat kisi kristal logam . Dalam hal ini, elektron terus bergerak secara kacau, yaitu. Atom netral baru dan kation baru terus bermunculan.

Interaksi antarmolekul
Secara terpisah, ada baiknya mempertimbangkan interaksi yang timbul antara molekul individu dalam suatu zat - interaksi antarmolekul . Interaksi antarmolekul adalah jenis interaksi antara atom netral di mana tidak ada ikatan kovalen baru yang muncul. Kekuatan interaksi antar molekul ditemukan oleh Van der Waals pada tahun 1869, dan dinamai menurut namanya pasukan Van dar Waals. Pasukan Van der Waals terbagi menjadi orientasi, induksi Dan menyebar . Energi interaksi antarmolekul jauh lebih kecil dibandingkan energi ikatan kimia.
Kekuatan orientasi tarik-menarik terjadi antar molekul polar (interaksi dipol-dipol). Gaya-gaya ini terjadi antara molekul-molekul polar. Interaksi induktif adalah interaksi antara molekul polar dan molekul non-polar. Molekul nonpolar terpolarisasi karena aksi molekul polar, yang menghasilkan gaya tarik elektrostatik tambahan.
Jenis khusus interaksi antarmolekul adalah ikatan hidrogen. - ini adalah ikatan kimia antarmolekul (atau intramolekul) yang muncul antara molekul yang memiliki ikatan kovalen sangat polar - H-F, H-O atau H-N. Jika ada ikatan seperti itu dalam suatu molekul, maka antar molekul akan ada kekuatan atraktif tambahan .
Mekanisme pendidikan ikatan hidrogen sebagian bersifat elektrostatis dan sebagian lagi bersifat donor-akseptor. Dalam hal ini, donor pasangan elektron adalah atom dari unsur yang sangat elektronegatif (F, O, N), dan akseptornya adalah atom hidrogen yang terikat pada atom tersebut. Ikatan hidrogen dicirikan oleh fokus di luar angkasa dan kejenuhan
Ikatan hidrogen dapat ditunjukkan dengan titik: H ··· O. Semakin besar elektronegativitas atom yang terikat pada hidrogen, dan semakin kecil ukurannya, semakin kuat ikatan hidrogennya. Ini tipikal terutama untuk koneksi fluor dengan hidrogen , serta untuk oksigen dan hidrogen , lebih sedikit nitrogen dengan hidrogen .

Ikatan hidrogen terjadi antara zat-zat berikut:
— hidrogen fluorida HF(gas, larutan hidrogen fluorida dalam air - asam fluorida), air H 2 O (uap, es, air cair):
— larutan amonia dan amina organik- antara molekul amonia dan air;
— senyawa organik yang mempunyai ikatan O-H atau N-H: alkohol, asam karboksilat, amina, asam amino, fenol, anilin dan turunannya, protein, larutan karbohidrat - monosakarida dan disakarida.
Ikatan hidrogen mempengaruhi sifat fisik dan kimia suatu zat. Dengan demikian, daya tarik tambahan antar molekul menyulitkan zat untuk mendidih. Zat dengan ikatan hidrogen menunjukkan peningkatan titik didih yang tidak normal.
Misalnya Sebagai aturan, dengan peningkatan berat molekul, peningkatan titik didih zat diamati. Namun pada beberapa zat H 2 O-H 2 S-H 2 Se-H 2 Te kita tidak mengamati perubahan linier pada titik didih.

Yaitu, di titik didih air sangat tinggi - tidak kurang dari -61 o C, seperti yang ditunjukkan garis lurus kepada kita, tetapi lebih dari itu, +100 o C. Anomali ini dijelaskan oleh adanya ikatan hidrogen antar molekul air. Oleh karena itu, dalam kondisi normal (0-20 o C) airnya cairan berdasarkan keadaan fase.