Гемоглобин легче отдает кислород чем миоглобин. Миоглобин: функции, нормы в крови и моче, повышение и понижение уровня. Гемопротеины: миоглобин и гемоглобин
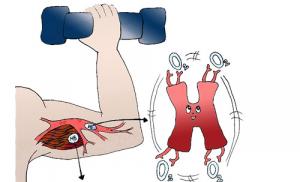
Миоглобин находится в саркоплазме в непосредственной близости к митохондриям и выполняет роль переносчика кислорода от гемоглобина к дыхательным ферментам, и резервуара для кислорода. Известно, что миоглобин обладает большим, чем гемоглобин сродством к кислороду и поэтому его много в мышцах ныряющих и диких животных, У человека из общего запаса кислорода (2450 мл) в виде оксимиоглобина запасено 14%. Тренировка мышц приводит к увеличению содержания миоглобина и улучшению их кислородного обеспечения.
Миоглобин является специфичным белком мышц и поэтому его появление в сыворотке крови указывает на повреждение мышечной ткани. Его определение в сыворотке крови является одним из самых ранних и точных методов выявления инфаркта миокарда, т. к. миоглобин при этом заболевании появляется в больших количествах в крови уже в первые два часа развития инфаркта.
Гемоглобин. Молекула Нb состоит из простого белка типа гистонов - глобина и четырех гемов. Глобин состоит из 4-х мономеров, двух α -цепей (по 141 остатку аминокислот в каждой из α-цепей и двух β-цепей (по 146 остатков аминокислот в каждой). Пространственные структуры миоглобина и гемоглобина поразительно сходны, хотя первичная структура α и β-цепей гемоглобина и цепь миоглобина имеет много различий. Молекулярная масса гемоглобина 70000 Д.
Видовая специфичность гемоглобинов обусловлена аминокислотным составом глобина. Так, глобин взрослого человека, не содержит изолейцина, а в глобине животных он присутствует. Гемы гемоглобинов всех животных имеют одинаковое строение. Составные части гемоглобина взаимно влияют друг на друга. Глобин превращает малорастворимый, химически инертный гем в высоко растворимый и активный, способный связывать кислород. Гемы же придают глобину устойчивость.
Порфин с заместителями у β-углеродов получил название порфирина. Отдельные порфирины отличаются друг от друга характером заместителей. Гем имеет следующие заместители: у С 1 , С 3 , С 5 , С 8 - метильные группы, у С 2 , С 4 - винильные радикалы, у С 6 , С 7 - остатки пропионовой кислоты. Порфирин с перечисленными заместителями получил название протопорфирина, который соединяясь с двухвалентным ионом железа (Fе 2+), образует гем. Железо присоединяется к атомам азота I и 3 колец нековалентными (координационными) связями, к атомам азота II и IV колец ковалентными связями Гем соединяется с полипептидной цепью двумя координационными связями иона железа, а полипептидная цепь за счет атомов азота имидазольных колец проксимальных гистидинов. Одна из этих связей существует постоянно, другая разрывается в момент присоединения к гемоглобину молекулы кислорода.
7. Дыхательные ферменты, понятие о строении, представители, значение.
Дыхательные ферменты бывают флавопротеиды, содержащие витамин В 2 , и гемсодержащие - цитохромы, каталазы, пероксидазы. Они участвуют в окислительно-восстановительных реакциях, необходимы для обеспечения энергией различных процессы.
8.Фосфопротеиды, общая характеристика, свойства, представители.
Фосфопротеиды - это сложные белки, состоящие из простого белка и простетической группы - фосфорной кислоты. Фосфорные кислоты сложноэфирной связью присоединяются к оксиаминокислотам, таким как серин, треонин, тирозин, образуя моно-, ди- и трифосфорные эфиры. Фосфопротеиды, в основном, полноценные белки, кислые. Имеют большое значение как источники незаменимых аминокислот и фосфорной кислоты. Поэтому фосфопротеиды необходимы для роста (для построения скелета, белков нового организма), они используются для синтеза фосфолипидов, а последние, в свою очередь, необходимы для построения клеточных и субклеточных мембран. Фосфопротеиды являются источниками фосфорной кислоты для реакций фосфорилирования и дефосфорилирования, а эти реакции лежат в основе активирования или ингибирования ферментов. Служат источником фосфорной кислоты для построения АМФ и других нуклеозидмонофосфатов, из которых образуются ди- и трифосфорные производные - источники энергии. Фосфопротеиды используются для синтеза нуклеиновых кислот.
Представители: казеиноген (содержат примерно 1% фосфора) молока, фосвитин и вителлин желтка яиц, ихтуллин икры рыб. В остальных представителях фосфопротеидов содержание фосфора достигает 10%. Все эти белки не свертываются при кипячении, не растворимы в воде, полноценные.
9.Металлопротеиды, строение, представители, значение.
Металлопротеиды - сложные белки, в составе которых имеются металлы, которые присоединяются непосредственно к аминокислотам, что и отличает их от хромопротеидов, в которых металл включен в органическое вещество, в частности, в гем. Связь между аминокислотой и металлом бывает прочная и рыхлая в зависимости от роли, которую выполняют эти белки. Различают железосодержащие, медьсодержащие, цинксодержащие и другие металлопротеиды. Они в основном выполняют транспортную и депонирующую роль. Входят в состав некоторых ферментов, витаминов.
Представители: к железосодержащим белкам относят трансферрин, ферритин, гемосидерин . Трансферрин содержит 0,13% 3 + -валентного железа, выполняет транспортную роль. В составе ферритина 20% железа, это депонируемая форма железа, сохраняется в печени и селезенке. Гемосидерин кроме железа содержит в своей молекуле нуклеотиды, углеводы. Роль неизвестна. Депонируется в клетках соединительной ткани.
10. Липопротеиды - структурные, транспортные, строение
Липопротеиды – это липид-белковые комплексы, в составе содержатся различные виды липидов. По функции делятся на структурные, которые находятся в мембранах и сывороточные (транспортные). Транспортные ЛП делятся на три вида: липопротеиды очень низкой плотности (ЛПОНП), липопротеиды низкой плотности (ЛПНП) и липопротеиды высокой плотности (ЛПВП). Образуются они в печени и, как видно из названия, переносят нерастворимые липиды.
Упражнения и ситуационнве задачи для самоконтроля
1. Написать фрагмент молекулы:
а) гиалуроновой кислоты;
б) хондроитин серной кислоты;
в) гепарина, его применение в медицине.
2. Написать гем: а) гемоглобина; б)миоглобина
3.В чем сходство и отличие в строении НЬ и Mgb?
4.У больного склонность к тромбообразованию. Какой представитель гликозамингликанов можно использовать для лечения и профилактики тромбозов?
Занятие: «НУКЛЕОПРОТЕИДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ, ДНК, РНК, ВИДЫ, СТРОЕНИЕ, СТРУКТУРЫ, ЗНАЧЕНИЕ».
Вопросы и ответы для самоподготовки:
1. Нуклеопротеиды, общий план строения, роль.
Нуклеопротеиды - белки, обладающие слабокислыми свойствами, обусловленными большим содержанием в молекулах остатков фосфорной кислоты. Нуклеопротеиды растворимы в воде и растворах щелочей. Молекулярная масса нуклеопротеидов достигает миллионов или даже миллиардов дальтон. Молекула нуклеопротеидов состоит
из простых белков и простетической группы, называемой нуклеиновой кислотой. Нуклеопротеиды играют в живых организмах важную роль: они принимают непосредственное участие в синтезе всех белков клеток и тканей, обуславливают специфичность их строения и свойств, передают наследственные свойства при размножении организмов и делении клеток.
В зависимости от того, какая нуклеиновая кислота входит в состав нуклеопротеида, различают дезоксирибонуклеопротеид (ДНП) и рибонуклеопротеид (РНП).
Белковый компонент нуклеопротеидов неоднороден и состоит из большого числа молекул простого белка типа кислых альбуминов и глобулинов у всех живых организмов и белков типа гистонов у высших животных или протаминов у рыб и морских животных. Гистоны имеют важное значение в защите ДНК, в поддержании структуры хромосом, в регуляции экспрессии генов (в частности, они являются фактором репрессии транскрипции ДНК). Негистоновые белки, входящие в состав, как правило, обладают свойствами ферментов.
3.2.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина - витамина B 2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы.
3.2.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем .
По своему химическому строению гем представляет собой протопорфирин IX , связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН- . Заместителями в пиррольных кольцах являются: четыре метильные группы СН 3 - , две винильные группы СН 2 =СН- и два остатка пропионовой кислоты - СН 2 -СН 2 -СООН . Гем соединяется с белковой частью следующим образом. Неполярные группы. протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
3.2.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α 1 , α 2 , β 1 и β 2 , каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O 2 , являются: 1) кислород; 2) концентрация Н + (рН среды); 3) углекислота (СO 2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O 2 , имеющая S-образную форму (рисунок 3.1).
Повышение содержания СO 2 , Н + , ДФГ на фоне низкого парциального давления O 2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O 2 поступает в ткани.
Рисунок 4. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом.
Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О 2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
· Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe 2+ , находящимся в центре молекулы (рис. 1-29).
· Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 ?-спиралей. ?-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис 64 , Фен 138), либо букву?-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F 8).
· Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
3.Связывание гема с апомиоглобтом
Гем - специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении
Рис. 1-29. Строение тема, входящего в состав миоглобина и гемоглобина.
между двумя?-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца тема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис 64 и Гис 93 или Гис Е 7 и Гис F 8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости тема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в теме может образовывать 6 координационных связей, 4 из которых удерживают Fe 2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe 2+ и атомом азота имидазольного кольца Гис F 8 (рис. 1-30).
Гис Е 7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда - О 2 к миоглобину.
Аминокислотное окружение тема создаёт условия для довольно прочного, но обратимого связывания О 2 с Fe 2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe 2+ в Fe 3+ . Трёхвалентное железо в составе тема не способно присоединять О 2 .
Мышечный гемоглобин? Что это такое? До сих пор многие слышали только о том железосодержащем белке, который находится в эритроцитах, доставляет кислород в органы и ткани, забирает углекислый газ и называется гемоглобином крови.
Миоглобин чаще связывают с дыханием морских млекопитающих, которые способны подолгу пребывать под водой и каким-то образом обеспечивать нормальную жизнедеятельность своего организма. Оказывается, такие способности имеют прямое отношение к присутствующему у этих животных в большом количестве белку – миоглобину. Есть этот белок и в человеческом организме, при необходимости (большая потребность мышц в О 2) он может связывать до 14% полученного через легочное дыхание кислорода.
Миоглобин – краткосрочное депо кислорода
Миоглобин – это содержащий двухвалентное железо белок, и, хотя его гем, в принципе, идентичен гему , белковая часть (глобин) имеет существенные отличия (полипептидная цепь). Это понятно – он немного по-другому работает: не носится по организму с током крови, а запасает кислород, образуя оксимиоглобин, и насыщает им мышечные ткани, тем самым обеспечивая тканевое (внутреннее) дыхание.
Какое количество кислорода потребует ткань – зависит от того, в каком функциональном состоянии находятся ее клетки. Когда человек пребывает в спокойном состоянии, то кислород, поступающий в организм во время внешнего дыхания, начнет интенсивно поглощаться сердечной мышцей, серым веществом головного мозга, печеночной паренхимой, корковым веществом почек. И только одна ткань способна отложить кислород про запас – мышечная, поскольку только она обладает специальной депонирующим гемопротеином, называемым миоглобином.
Еще о норме
Для определения миоглобина в организме подходят такие биологические жидкости, как сыворотка, плазма крови и моча. Эти материалы должны быть свежеполученными или хранившимися при низкой температуре (-25°С) не более 2 лет.
Нельзя производить забор анализа после еды (от приема пищи до исследования должно пройти не менее 8 часов), пациенту запрещают разного рода напитки (чай, кофе, сок), разрешают пить только чистую воду. За час до взятия биологического материала больному настоятельно рекомендуют не курить, а за полчаса – исключить всякую физическую и эмоциональную активность (данный анализ «любит» спокойное состояние). Кроме этого, не желательно сдавать кровь сразу после рентгенографического обследования, УЗ-диагностики, а тем более, после лечебных процедур типа электроимпульсной терапии.
Показатели нормы могут увеличиваться в зависимости от использования различных лабораторных методов:
- Иммунонефелометрического теста;
- Радиоиммунологического анализа (РИА);
- Иммунофлюоресцентного исследования.
Однако, даже не глядя на разную чувствительность тестов, количество миоглобина обычно не превышает значения от 65 до 80 мкг/л, а норма (еще раз напомним) составляет:
- Для мужчин – 19 – 92 мкг/л (среднее – 49 ± 17 мкг/л);
- Для женщин – 12 – 76 мкг/л (среднее – 35 ± 14 мкг/л);
- В моче концентрация миоглобина – менее 20 мкг/л, как правило, у здорового человека любого пола он вообще не определяется.
Тест, определяющий уровень «гемоглобина мышц» назначают при подозрении на поражение кардиомиоцитов и/или клеток скелетных мышц.
Как он работает?
При значительных физических нагрузках, например, в период напряженных спортивных тренировок или участия в ответственных соревнованиях, кислород покидает мышечный гемоглобин и направляется в митохондрии клеток, чтобы принять участие в выработке универсального источника энергии – аденозинтрифосфата (АТФ), в котором в такие моменты организм нуждается особенно.
Миоглобин обладает уникальными способностями: он связывает гемоглобин обратимо, создавая своеобразный буфер, 1 его грамм может присоединить до 1,34 мл О 2 и отложить до будущих, но очень коротких, времен. Если вдруг по каким-либо причинам сердечная мышца лишается поступления кислорода, то это количество миоглобина сумеет обеспечить дыхательный процесс до 4 секунд. В такие моменты (нарушение кровообращения в миокарде или систола) в мышце сердца связанный с кислородом гемопротеин не допустит прекращения окислительно-восстановительных реакций в местах сниженного кровотока и создаст условия для обеспечения полноценного хода этих процессов. Правда, помочь миоглобин может только в течение короткого срока, поскольку является кратковременным депо.

Повреждение кардиомиоцитов (клеток миокарда) или миоцитов скелетных мышц влечет выход больших количеств «мышечного гемоглобина» в кровеносное русло.
Инфаркт миокарда является показательным примером зависимости уровня миоглобина в крови от объема очага поражения (чем больше очаг, тем выше содержание тканевого хромопротеина – миоглобина). Определение миоглобина через пару часов после появления болевых ощущений важно, поскольку здесь повышение уровня этого белка дает основание судить не только о наличии , но и степени поражения сердечной мышцы. Следующим биохимическим анализом, указывающим на инфаркт миокарда, будет определение , а, в частности – ее изоферментного спектра (МВ-фракция).
Повышенные и пониженные концентрации «гемоглобина мышц»
Физиологически повышенный уровень миоглобина в крови наблюдается при интенсивной физической нагрузке, значительном напряжении мышечного аппарата при спортивных тренировках и состязаниях и после проведения электроимпульсной терапии.
Патологическое повышение отмечается при некоторых заболеваниях:
- Инфаркте миокарда (увеличение содержания данного гемопротеина, как правило, предшествует возрастанию активности фермента креатинкиназы). Рост значений миоглобина носит преходящий характер, поскольку наблюдать его можно через полчаса – час вслед за наступлением болевого синдрома при ИМ (и еще в течение 2 – 3 суток после его возникновения);
- Выраженной почечной недостаточности с уремическим синдромом;
- Воспалительных процессах, протекающих непосредственно в мышцах;
- Травмах (сюда можно отнести и инъекции лекарственных растворов в мышцу);
- Глубоких термических и химических ожогах;
- Судорогах.
Снижается уровень миоглобина в крови только при патологических состояниях, например, таких, как:
- РА (ревматоидный артрит);
- Полимиозит (системное воспалительное заболевание мышечной ткани);
- Миастения (повышение содержания «мышечного гемоглобина» связано с наличием в крови циркулирующих антител непосредственно к этому белку).

Как указывалось выше, в норме миоглобин в моче почти не встречается, хотя и существуют допустимые значения этого белка в данном биологическом материале. Его появление или превышение установленного показателя (20 мкг/л) обнаруживается в следующих случаях:
- Повреждения сердечной (инфаркт миокарда) или скелетных мышц;
- Вторичной токсической миоглобинурии;
- Глубоких термических или химических ожогов;
- Алкогольной интоксикации;
- Отравления отдельными видами рыбы;
- Значительного напряжения скелетных мышц, например, при занятиях спортом;
- Краш-синдрома (травматический токсикоз, развивающийся в мышечных тканях) с большим распадом мышечной массы;
- Поражений почек.
Следует отметить, что содержание миоглобина в последней биологической жидкости (моче) целиком зависит от функции почек, что следует учитывать при назначении и определении данного белка.
Видео: познавательная информация о миоглобине
3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина - витамина B2 ). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы.
3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем .
По своему химическому строению гем представляет собой протопорфирин IX , связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН— . Заместителями в пиррольных кольцах являются: четыре метильные группы СН3 — , две винильные группы СН2 =СН— и два остатка пропионовой кислоты — СН2 —СН2 —СООН . Гем соединяется с белковой частью следующим образом. Неполярные группы. протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α1 , α2 , β1 и β2 , каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2 , являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2 ) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2 , имеющая S-образную форму (рисунок 3.1).