Presentasi pelajaran "Senyawa halogen" Presentasi pelajaran kimia (kelas 9) tentang topik tersebut. Presentasi dengan topik "senyawa halogen" dan dalam bahasa lain nama "klorin" sudah diperbaiki
Survei kelas ekspres: 1. Unsur apa yang disebut halogen? 2. Jelaskan kedudukan halogen dalam Tabel Periodik D.I.Mendeleev. 3. Bagaimana struktur atom halogen? 4. Halogen manakah yang paling elektronegatif? 5. Bagaimana sifat oksidatif halogen berubah seiring bertambahnya nomor atom?


Mengapa kekuatan asam HJ >HF? F +53 J Jari-jari atom J >F HF? F +53 J +9 2 7 2 8 18 18 7 Jari-jari atom J >F"> HF ? F +53 J +9 2 7 2 8 18 18 7 Jari-jari atom J >F"> HF ? F +53 J +9 2 7 2 8 18 18 7 Jari-jari atom J >F" title="Mengapa kekuatan asam HJ >HF ? F +53 J +9 2 7 2 8 18 18 7 Jari-jari atom J > F"> title="Mengapa kekuatan asam HJ >HF? F +53 J +9 2 7 2 8 18 18 7 Jari-jari atom J >F"> !}





CFC 1970 Semprotan aerosol Refrigeran (refrigeran) Penipisan ozon Kebutaan akibat katarak Kanker kulit Penekanan sistem imun tubuh CI + O 3 = CIO + O 2 Satu atom klorin menghancurkan molekul O 3 dan dapat bertahan hingga 300 tahun.

Soal Pilihan Jawaban 1) Persamaan struktur atom halogen: a) jari-jari atom b) muatan inti c) jumlah elektron pada lapisan terluar 2) Bagaimana perubahan keelektronegatifan pada golongan: F-Cl-Br-I: a) berkurang b) bertambah c) tidak berubah 3) Zat manakah yang diambil berpasangan dapat digunakan untuk memperoleh hidrogen klorida: a) NaCl (TV) dan H 2 SO 4 (larutan) b) NaCl (larutan) dan H 2 SO 4 (larutan) c ) NaCl (TV) dan H 2 SO 4 (j) 4) Asam hidrohalat dan garamnya (kecuali senyawa fluor) dapat dibedakan dengan menggunakan satu reagen: a) KCl b) AgNO 3 c) BaSO 4 5) Sebutkan zat halogen cair: a ) klorin b) brom c) uji yodium
Pembelajaran ini merupakan pembelajaran penguasaan ilmu baru, dibangun atas dasar presentasi, seluruh tahapan pembelajaran diikuti mulai dari pengecekan pekerjaan rumah hingga refleksi (memantapkan materi baru). Juga berisi penggalan video percobaan “pembakaran antimon dalam klorin”.
Unduh:
Pratinjau:
Untuk menggunakan pratinjau presentasi, buat akun Google dan masuk ke akun tersebut: https://accounts.google.com
Keterangan slide:
Ciri-ciri umum halogen pelajaran terbuka kimia di kelas 9 Disiapkan oleh: Vyskrebentseva S.V. Guru kimia Sekolah Menengah MBOU No.6 Seni. Oktyabrskaya
Tujuan pembelajaran: Memberikan gambaran tentang halogen berdasarkan sifat perbandingannya; Pertimbangkan zat sederhana - halogen, sifat fisik dan kimianya; Terus kembangkan kemampuan membandingkan sifat-sifat zat sederhana.
Pemeriksaan pekerjaan rumah: pengujian tuliskan jumlah sifat dan karakteristik untuk (pilihan 1) logam, untuk (pilihan 2) non-logam: Jari-jari atom kecil Jari-jari atom besar Pada tingkat terluar dari 1 hingga 3 elektron Pada tingkat terluar dari 4 hingga 8 elektron Kelenturan Kilau logam Keadaan agregasi gas Plastisitas Berbagai warna Konduktivitas listrik yang buruk Keadaan agregasi padat Konduktivitas termal yang baik Konduktivitas listrik yang baik Sifat reduksi yang jelas Sifat pengoksidasi yang jelas Alotropi
Jawaban yang benar: logam dicirikan oleh: Jari-jari atom yang kecil Jari-jari atom yang besar Pada tingkat terluar dari 1 hingga 3 elektron Pada tingkat terluar dari 4 hingga 8 elektron Kelenturan Kilau logam Keadaan agregasi gas Plastisitas Berbagai warna Konduktivitas listrik yang buruk Keadaan padat agregasi Konduktivitas termal yang baik Konduktivitas listrik yang baik Sifat reduksi yang jelas Sifat pengoksidasi yang jelas Alotropi
Jawaban yang benar: non-logam dicirikan oleh: Jari-jari atom yang kecil Jari-jari atom yang besar Pada tingkat terluar dari 1 hingga 3 elektron Pada tingkat terluar dari 4 hingga 8 elektron Kelenturan Kilau logam Keadaan agregasi gas Plastisitas Berbagai warna Konduktivitas listrik yang buruk Padat keadaan agregasi Konduktivitas termal yang baik Konduktivitas listrik yang baik Sifat reduksi yang jelas Sifat pengoksidasi yang jelas Alotropi
Rantai transformasi: H 2 → NaH → H 2 → HCl NaOH H 2 + 2Na = 2NaH NaH + HCl = NaCl + H 2 H 2 + Cl 2 = 2HCl NaH + H 2 O = NaOH + H 2 2NaOH + 2Al + 6H 2 HAI = 2Na +3H 2
Soal No.2 hal.93 Diberikan: Solusi: V(udara)=100 l V (O 2)= V(udara) * ᵠ (O 2)= 100*0.21= ᵠ (O 2)=21% 21 l. ᵠ (N 2) = 78% n (O 2) = V/ V m = 21 l / 22,4 l/mol = 0,94 mol n (O 2) =? V(N 2) = 100*0,78 = 78 l n (N 2) =? n (N 2) = 78L / 22,4L/mol = 3,48mol Jawaban: 0,94 mol, 3,48 mol.
Soal No.3 hal.103 Diberikan: Solusi: m tech. (WO 3) = 928 kg W (WO 3) = 100% -25% = 75% W (pengotor) = 25% m (WO 3) = m tech. * W (WO 3) = V (H 2) =? 928kg * 0,75 = 696kg n(L)=? n(WO 3) = m/M = 696 kg /232 kg/ kmol = = 3 kmol WO 3 + 3H 2 = W + 3H 2 O 1 mol 3 mol 1 mol 3 kmol 9 kmol 3 kmol V(H 2) = nV m = 9 kmol * 22,4 m3/ kmol = 201,6 m3 Jawaban: 201,6 m3, 3 kmol.
Kajian materi baru: Posisi dalam PSHE dan struktur atom: Subgrup utama golongan VII
Ciri-ciri umum halogen: terdapat 7 elektron pada tingkat terluar; jari-jari atom bertambah; o sifat non-logam melemah; o kapasitas oksidasi menurun. Fluor merupakan oksidator terkuat (s.o.-1) Selebihnya: s.o. -1, +1, +3, +5, +7
Halogen adalah zat sederhana.Fluorin F 2 adalah gas beracun berwarna kuning muda dengan bau yang sangat mengganggu.
Zat sederhana - halogen 2. Klorin Cl 2 - gas kuning-hijau dengan bau menyesakkan yang menyengat
Zat sederhana - halogen 3. Brom Br 2 - cairan berwarna coklat dengan bau busuk
Zat sederhana - halogen 4. Yodium I 2 - padatan hitam abu-abu dengan kilau logam dan bau menyengat
Sifat kimia halogen Interaksi dengan zat sederhana: a) dengan hidrogen H 2 H 2 + G 2 = 2НГ b) dengan logam F 2 bereaksi genap dengan Au, Ag dan Pt bila dipanaskan
Pembakaran antimon dalam klorin
Sifat kimia halogen 2. Interaksi dengan zat kompleks: a) dengan air 2F 2 + 2H 2 O = 4HF + O 2 b) dengan logam halida Cl 2 → Br 2 → I 2 kapasitas oksidasi menurun
Pekerjaan Rumah: Paragraf 18, tugas setelah paragraf 18 No. 4,5 Paragraf 20, tugas setelah paragraf 20 No. 1 Terima kasih atas perhatiannya!
Pratinjau:
BUKA SKRIP PELAJARAN
kimia di kelas 9 dengan topik:
“KARAKTERISTIK UMUM HALOGEN”
Tujuan pelajaran: Berikan gambaran umum tentang halogen dan pertimbangkan sifat fisik dannya
Sifat kimia.
Tujuan pelajaran: 1) Terus mengembangkan keterampilan membandingkan sifat-sifat sederhana
Zat;
2) Untuk memantapkan gagasan umum tentang nonlogam dan sifat-sifatnya;
3) Mengembangkan keterampilan dalam memecahkan masalah dan menyusun persamaan
Reaksi kimia yang melibatkan bukan logam.
Jenis pelajaran: pelajaran dalam mempelajari pengetahuan baru
Metode pelajaran: percakapan, cerita, pekerjaan mandiri
Peralatan: Tabel periodik unsur kimia D.I. Mendeleev,
Sistem multimedia, komputer.
SELAMA KELAS:
- Waktu pengorganisasian.(1-2 menit)
Saling menyapa, bersiap bekerja, mengkomunikasikan topik dan tujuan pembelajaran hari ini.
- Memeriksa pekerjaan rumah.(10-12 menit)
- Panggil 3 orang ke papan: 1 memecahkan rantai di tengah papan, 2 di belakang papan memecahkan masalah:
Rantai transformasi:
H2 → NaH → H2 → HCl
NaOH
- H2 + 2Na = 2NaH
- NaH + HCl = NaCl + H2
- H2 + Cl2 = 2HCl
- NaH + H2O = NaOH + H2
- 2NaOH + 2Al + 6H2O = 2Na +3H2
Soal No. 2 hal.93
Diberikan: Solusi:
V(udara)=100 l V(O2)= V(udara)* ᵠ (O2)= 100*0,21=
ᵠ (O2)=21% 21 liter.
ᵠ (N2) = 78% n (O2) = V/ Vm = 21 l / 22,4 l/mol = 0,94 mol
N(O2)=? V(N2) = 100*0,78 = 78 liter
N(N2) =? n (N2)=78L / 22,4L/mol = 3,48mol
Jawaban: 0,94 mol, 3,48 mol.
Soal No.3 hal.103
Diberikan: Solusi:
Mtech.(WO3) =928 kg W(WO3) = 100%-25%=75%
W(pengotor) = 25% m (WO3) = mtech. * W (WO3) =
V(H2)=? 928kg * 0,75 = 696kg
n(W)=? n(WO3)=m/M=696kg/232kg/kmol = 3 kmol
WO3 + 3H2 = W + 3H2O
1 mol 3 mol 1 mol
3 kmol 9 kmol 3 kmol
V(H2)= nVm = 9 kmol * 22,4 m3/kmol = 201,6 m3
Jawaban: 201,6 m3, 3 kmol.
- Semua orang menulis tes: pilih sejumlah sifat dan karakteristik untuk (opsi pertama) logam, untuk (opsi kedua) non-logam:
- Jari-jari atom kecil
- Jari-jari atom yang besar
- Pada tingkat terluar dari 1 hingga 3 elektron
- Pada tingkat terluar terdapat 4 hingga 8 elektron
- Daktilitas
- Kilau metalik
- Keadaan agregasi gas
- Plastik
- Berbagai warna
- Konduktivitas listrik yang buruk
- Keadaan agregasi yang solid
- Konduktivitas termal yang baik
- Konduktivitas listrik yang baik
- Sifat restoratif yang diucapkan
- Sifat pengoksidasi yang diucapkan
- Alotropi
Jawaban yang benar: Opsi 1 – 2,3,5,6,8,11,12,13,14
Opsi 2 – 1,4,7,9,10,11,15,16
- Mempelajari materi baru.(20 menit)
- Posisi dalam PSHE dan struktur atomnya.
Halogen F, Cl, Br, I, At adalah unsur golongan 7 dari subkelompok utama Tabel Periodik kimia. elemen.
Fluor adalah oksidator terkuat (s.o.-1)
Selebihnya: jadi. -1, +1, +3, +5, +7
Selain fluor, klor, brom, dan yodium, ada unsur lain dalam kelompok ini yang termasuk dalam halogen - astatin. Hal itu sudah diprediksi oleh D.I sendiri. Mendeleev sebagai eka-iodine, merupakan unsur radioaktif, oleh karena itu tidak dipelajari dalam pelajaran sekolah.
- Halogen - zat sederhana dan keberadaannya di alam.
Mendengar pesan tentang fluor, klor, brom dan yodium. (4 orang, dengan fokus pada slide presentasi, berbicara tentang halogen, sejarah penemuannya, dan senyawa yang terdapat di alam) Sisa kelas mencatat sebentar tentang pembicara.
- Sifat kimia halogen.
- Interaksi dengan zat sederhana:
a) dengan hidrogen H2
H2 + G2 = 2NG
Fluor bereaksi dengan hidrogen dalam kondisi apapun dengan ledakan, klor bereaksi dengan ledakan hanya jika dinyalakan atau terkena sinar matahari langsung, brom bereaksi dengan hidrogen hanya jika dipanaskan dan tanpa ledakan. Reaksi-reaksi ini bersifat eksotermik, tetapi reaksi yodium dengan hidrogen bersifat endotermik lemah; reaksi ini berlangsung lambat bahkan ketika dipanaskan.
b) dengan logam - garam terbentuk - logam halida.
Jadi fluorida dalam kondisi normal ia bereaksi dengan sebagian besar logam, dan ketika dipanaskan ia bahkan bereaksi dengan Au, Ag dan Pt, yang dikenal karena kepasifan kimianya.
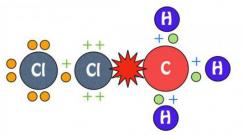
Halogen lainnya bereaksi dengan logam terutama ketika dipanaskan. Jadi, dalam labu berisi klorin, kristal antimon yang dihancurkan menyala dan terbakar dengan indah:
2Sb + 3Cl 2 = 2SbCl 3 (menonton video percobaan antimon dengan klorin)
2Sb + 5Cl 2 = 2SbCl 5
Tugas mandiri adalah menulis persamaan reaksi besi dengan klor dan tembaga dengan brom.
2. Interaksi dengan zat kompleks:
a) dengan air
2F2 + 2H2O = 4HF + O2
b) dengan logam halida(kecuali fluor, yang terutama berinteraksi dengan air)
Cl2 → Br2 → I2
daya oksidasi berkurang dari klorin menjadi yodium:
Cl2 + 2NaBr = 2NaCl + Br2
Br2 + 2KI = 2KBr + I2
- Konsolidasi. (5 menit.)
Jawab 5 soal tes pada topik yang dipelajari (lihat slide presentasi)
- Analisis nilai pelajaran.(1 menit)
Evaluasi responden di dewan d/z yang melakukan presentasi tentang halogen.
- Pekerjaan rumah:(1 menit)
Paragraf 18, tugas setelahnya No.4,5
Paragraf 20, tugas setelahnya No.1
Untuk menggunakan pratinjau presentasi, buat akun Google dan masuk ke akun tersebut: https://accounts.google.com
Keterangan slide:
Senyawa halogen
Halogen di alam. Karena daya oksidasinya yang tinggi, halogen di alam hanya terdapat dalam keadaan terikat. Kandungan halogen di kerak bumi: fluor - 0,027% klorin - 0,045% brom - 0,000 1 6% yodium - 0,0000 3%
Halogen di alam Halit (garam batu) Laminaria Lihat buku teks hal.86
Hidrogen halida (HH) Lihat buku teks § 18, hal.83 H F hidrogen fluorida +19,5 0 C H Cl hidrogen klorida -84,8 0 C H Br hidrogen bromida -67,0 0 C H I hidrogen iodida -35,0 0 C Gas tak berwarna (tidak termasuk H F), dengan a bau menyengat, beracun. t kip Larut dengan baik dalam air, membentuk asam.
Asam hidrohalat asam fluorida asam hidrobromat asam klorida asam fluorida asam hidroiodik HF HCl HBr HI
Panjang ikatan dalam molekul asam hidrohalat. H Br H I H Cl H F
Asam hidrohalat Kekuatan asam meningkatkan hidrofluorik hidrobromida asam klorida asam fluorida iodida HF HCl HBr HI
Hidrogen klorida (HCl) Pembuatan: NaCl(solv.) + H 2 SO 4 (conc.) = NaHSO 4 + HCl Dalam industri: H 2 + Cl 2 = 2HCl Di laboratorium: 2NaCl(solv.) + H 2 SO 4 (conc. .) = Na 2 SO 4 + 2HCl t Sifat kimia: Dalam kondisi normal, hidrogen klorida tidak bereaksi dengan logam dan oksidanya! NaCl? HCl
Asam klorida (HCl) Sama dengan asam lain (H+) 2. Interaksi dengan logam. 3. Interaksi dengan oksida basa dan amfoter. 4. Interaksi dengan basa. 5. Interaksi dengan garam. Sifat Khusus (Cl -) 2. Interaksi dengan oksidator (MnO 2, KMnO 4, KClO 3, dll) Sifat kimia : 1. Perubahan warna indikator. 1. Interaksi dengan perak nitrat. Dengan melarutkan hidrogen klorida dalam air, Anda dapat memperoleh larutan asam klorida 40% dengan massa jenis 1,19 g/cm3. Kuitansi:
Penerapan asam klorida Lihat buku teks halaman 85 gbr. 19
Garam asam hidrohalat Reaksi kualitatif. fluorida klorida bromida iodida Me F Me Br Me I Me Cl - F - Br - I - + Ag + = AgCl + Ag + = AgBr + Ag + = AgI + Ca 2+ = CaF 2 putih putih Kuning muda 2
Selesaikan rantainya, tulis persamaan ion untuk reaksi pertukaran, beri nama zat dalam rantai tersebut. Pilihan 1. I 2 HI NaI AgI Br 2 HBr KBr AgBr Opsi 2.
Pekerjaan rumah. § 18, mis. 2 (lisan), mis. 4 (tertulis), pekerjaan laboratorium lengkap.
Kaca buram dalam kehidupan sehari-hari Pintu kaca Dekorasi kantor
Degtyareva M.O.
wilayah Moskow
Korolev AOU LNIP

- Unsur golongan VII yang merupakan subkelompok utama antara lain
fluor F , klorin Kl , brom Sdr , yodium SAYA , astatin Pada
- Nama yang umum - halogen ( Orang yunani . "pembentuk garam" ) - sebagian besar senyawanya dengan logam adalah garam khas (KCl, NaCl, dll.).

Fluorit CaF 2

Garam karang NaCl

C ilvinite
KCl NaCl


Jari-jari atom
Keelektronegatifan
Sifat oksidatif
Sifat non-logam
Fluor
Klorin
Brom
2 S 2 2p 5
Astatin
3 S 2 3 P 5
4 S 2 4 P 5
5 S 2 5 P 5
6 S 2 6 P 5
+ 9
2 7
2 8 7
2 8 18 7
2 8 18 18 7
2 8 18 32 18 7


- Nama "fluor" (dari bahasa Yunani phthoros - kehancuran, kematian)
- Fluor diperoleh dalam keadaan bebas pada tanggal 26 Juni 1886 oleh ahli kimia Perancis Moissan.
- Ini adalah gas berwarna kuning kehijauan, sedikit lebih berat dari udara, dengan bau khas dan aktivitas kimia yang luar biasa.
- Tidak ada satupun unsur kimianya
membawa begitu banyak tragedi bagi ahli kimia
peristiwa seperti fluorida .

- Klorin ditemukan oleh ahli kimia Swedia Carl Scheele pada tahun 1774.
- pada tahun 1810 Sir Humphry Davy menamai gas tersebut "Klorin", dari bahasa Yunani yang berarti "hijau".
- Istilah ini digunakan dalam bahasa Inggris,
dan dalam bahasa lain nama “klorin” melekat.
- Gas berwarna kuning kehijauan dengan bau menyengat, beracun
- 2,5 kali lebih berat dari udara
- Sekitar 2 volume klorin dilarutkan dalam 1 volume air pada suhu 20 °C

79 Saudara ( 50,56% ) 81 Saudara ( 49,44% )
- dari bahasa Yunani bromo - bau
- satu-satunya non-logam yang berbentuk cair pada suhu kamar
- cairan kental berwarna merah kecokelatan dengan bau yang tidak sedap
- uap bromin berwarna kuning kecoklatan
- pada suhu –7,25° C, brom membeku, berubah menjadi kristal berbentuk jarum berwarna merah kecoklatan dengan kilau logam samar

- dari bahasa Yunani iodes - memiliki warna ungu
- berubah menjadi uap pada suhu kamar tanpa meleleh (sublimasi);
- pasangan ungu
12 6,9
Yodium ditemukan pada tahun 1811 oleh Courtois dalam abu rumput laut, dan pada tahun 1815 Gay-Lussac mulai menganggapnya sebagai unsur kimia.
Terdapat 37 isotop yodium yang diketahui dengan nomor massa 108 hingga 144.


- Molekul halogen terdiri dari dua atom.
Kl + Kl → Kl Kl
- Obligasi – kovalen nonpolar

- Halogen adalah zat pengoksidasi yang khas
- Sifat pengoksidasi dan non-logam atom berkurang dari fluor menjadi yodium

Sifat oksidatif
Sifat non-logam
Jari-jari atom
Fluor
Klorin
Brom
Astatin
+ 9
2 7
2 8 7
2 8 18 7
2 8 18 18 7
2 8 18 32 18 7

- Ion halogen adalah agen pereduksi yang khas
- Dengan hidrogen, halogen membentuk senyawa hidrogen yang mudah menguap
- Stabilitas hidrogen halida menurun dengan urutan sebagai berikut:
- C lumpur asam hidrohalat meningkat dalam deret:

- 3 detik 2 Zr 5
pengoksidasi
agen pereduksi
Keadaan oksidasi
HCl NaCl MgCl 2
+ 3
HClO 2

agen pereduksi
- Konfigurasi elektronik eksternal atom Cl 3 detik 2 Zr 5
Keadaan oksidasi
HCl NaCl MgCl 2
+ 3
HClO 2
+ 5
HClO 3
+ 7
HClO 4

1. Interaksi dengan logam
Klorin bereaksi langsung dengan hampir semua logam (ada pula yang hanya bereaksi dengan adanya uap air atau saat dipanaskan):
2. Interaksi dengan nonlogam
Dengan non-logam (kecuali karbon, nitrogen, oksigen dan gas inert), ia membentuk klorida yang sesuai.

3. Interaksi dengan air
dengan terbentuknya campuran asam
+ 1
hipoklorit
garam
4. Interaksi dengan garam halogen lain
halogen yang lebih aktif menggantikan halogen yang kurang aktif dari larutan garamnya
5 . Interaksi dengan larutan alkali
dengan pembentukan garam

- Dalam industri: elektrolisis larutan leleh atau natrium klorida
- Di laboratorium:

produksi
obat
dana
pemutihan
kertas dan kain
produksi
dari asam klorida
plastik
karet
pestisida

Dalam kedokteran
- Larutan alkohol 5% yodium digunakan untuk mendisinfeksi kulit di sekitar luka
- Dalam studi sinar-X dan tomografi, zat kontras yang mengandung yodium digunakan
Dalam teknologi
- Lampu halogen - lampu pijar dengan uap halogen (brom atau yodium) ditambahkan ke dalam silinder
- Fusi termonuklir laser- senyawa organoiodine digunakan untuk produksi laser gas berkekuatan tinggi pada atom yang tereksitasi

- Apa arti nama “Halogen”?
- Bagaimana struktur elektronik unsur-unsur ini serupa?
- Sifat redoks apa yang ditunjukkan halogen?
- Halogen manakah yang paling reaktif?
- Bagaimana aktivitas halogen berubah ke bawah golongan?

Buku Teks "Kimia-9"
§ 13, 14 hal.71 No.1 – 4